2. 湖南省郴州市第一人民医院药剂科,郴州 423001;
3. 南华大学衡阳医学院应用解剖与生殖医学研究所,衡阳 421001;
4. 湖南环境生物职业技术学院医学院,衡阳 421001;
5. 江西省赣州市人民医院病理科,赣州 341099;
6. 南华大学附属第一医院肿瘤放疗科,衡阳 421001;
7. 海南医学院病理学教研室,海口 571199
2. Department of Pharmacy, Chenzhou First People′s Hospital, Chenzhou 423001, China;
3. Clinical Anatomy & Reproductive Medicine Application Institute, School of Medicine, University of South China, Hengyang 421001, China;
4. Medical College of Hunan Vocational College of Environmental Biology, Hengyang 421001, China;
5. Department of Pathology, Ganzhou people′s Hospital, Ganzhou 341099, China;
6. Department of Oncology and Radiotherapy, the First Affiliated Hospital of Nanhua University, Hengyang 421001;
7. Department of Pathology, Hainan Medical College, Haikou 571199, China
放射治疗使脑肿瘤患者的存活率大大提高[1]。但脑肿瘤放疗后高发的认知功能障碍不容忽视[2],包括学习和记忆困难,注意力、决策力和执行力等功能下降,并逐渐恶化,严重影响患者生活质量[3]。目前辐射所致认知功能障碍的机制尚不清楚,缺乏有效的干预措施,临床根据其他中枢神经系统疾病的推断来选择治疗,效果并不理想[4]。热量限制包括连续性热量限制和间歇性热量限制,是指在保证机体基本营养前提下,减少30%~40%的食物摄入[5]。研究证明间歇性热量限制(intermittent fasting, IF)可以改善阿尔兹海默病以及癫痫动物模型的认知功能障碍[6]。IF作为一种无创的生活干预方式,既有抗癌作用[7]又有改善认知作用,那么IF在辐射所致认知功能障碍中发挥怎样的作用,值得探讨。本研究构建放射性认知功能障碍小鼠动物模型,采取间歇性热量限制,初步探讨IF对放射性认知功能障碍的作用及可能机制,为预防放射性认知功能障碍的发生及临床治疗提供理论依据。
材料与方法1. 实验动物及材料:清洁健康雄性7周龄c57BL/6J小鼠36只,体重(21±2)g,购于湖南斯莱克景达实验动物有限公司[合格证号SYXK(湘)2020-0002], 在温度(22±2)℃,湿度(50±5)%,12 h明/12 h暗周期循环的环境下饲养,自由摄食摄水。小鼠适应环境1周后进行实验。旷场(上海永州实验设备有限公司,40 cm×40 cm×40 cm的白色无顶箱子;一抗:兔抗ATG5、LC3II、P62、VDAC1,鼠抗Tubulin(武汉三鹰公司),兔抗IL-1β(武汉博士德公司),羊抗IBA-1、鼠抗NEUN(美国Abcam公司),鼠抗GFAP(美国Millipore公司),兔抗SYP、SYN-1、PSD95(武汉三鹰公司),兔抗β-肌动蛋白(武汉爱博泰克公司);二抗:Alexa488标记的驴抗兔、Cy3标记的驴抗羊、Cy3标记的羊抗鼠(美国Introvigen公司)、辣根过氧化物酶标记的羊抗兔、羊抗鼠(武汉三鹰公司);BCA蛋白浓度测定试剂盒、超敏ECL显影液(北京康为世纪公司);西门子ONCOR型直线加速器(德国SIEMENS公司)。
2. 实验动物分组与照射:36只7周龄c57BL/6J雄性小鼠,按随机数表法分为3组:假辐射+随意饮食组(Sham-AL)、辐射+随意饮食组(IR-AL)、辐射+间歇性禁食组(IR-IF),每组12只。参照本组前期研究方法[8]进行单次头部辐射。腹腔注射4%水合氯醛(0.1 ml/10 g)麻醉后,IR-AL和IR-IF组给予10 Gy 6 MV高能X射线头部照射(为保证辐射剂量的均匀,使用1 cm厚的生物膜覆盖于小鼠头部),剂量率为3 Gy/min。Sham-AL组在相同的辐射环境下给予0 Gy照射。照射完成放回笼子中,让其自由获得食物和水。
3. 间歇性热量限制干预:间歇性热量限制干预参照文献[9]。辐射后第2天,IR-IF组小鼠开始进行间歇性热量限制干预,每隔1天禁食24 h,不禁水,持续8周。其余小鼠(IR-AL和Sham-AL组)在整个实验过程中随意摄食摄水。
4. 新旧事物识别实验:运用新旧事物识别实验(novel object recognition test, NPRT)评估动物的记忆功能。实验装置包括旷场和两个完全相同的物体。参考文献[10]方法,进行适应和测试。适应阶段,在旷场(40 cm × 40 cm × 40 cm)对称位置放入两个完全相同的物体(旧物体)。小鼠由正中放入,记录5 min内小鼠探索两物体的时间。1 h后进入测试阶段,测试阶段将其中一个物体换为大小、形状及颜色不同的物体(新物体),再次将小鼠放入,记录5 min内对新物体探索时间(time exploring novel object,TN)和旧物体的探索时间(time exploring familiar object,TF)。计算新事物识别指数(%)=(TN-TF)/(TN+TF)×100%。新事物识别指数越高,表明小鼠对新物体偏好性强,小鼠记忆好。实验过程中使用70%的乙醇擦拭去除小鼠气味。
5. Western blot检测:行为学测试结束,快速解剖小鼠大脑,分离海马,并在-80℃下储存。使用组织蛋白裂解液和蛋白酶抑制剂提取一侧海马总蛋白。BCA法测定蛋白浓度,变性配平蛋白后,每孔蛋白上样量为25 μg,先使用10%或15%SDS-Page凝胶电泳,再转移到0.45或0.22 μm硝酸纤维素膜上,经5%脱脂牛奶室温封闭2 h后,加入相应一抗,室温摇床2 h,4℃冰箱过夜。次日磷酸盐吐温缓冲液(PBST)洗膜10 min × 3次。加入相应的辣根过氧化物酶标记的特异性二抗,室温摇床2 h,PBST漂洗10 min × 3次,使用凝胶成像仪进行显影和拍摄,采用Image pro plus软件进行灰度值分析,目的蛋白和内参蛋白的比值得出目的蛋白相对表达量。一抗分别为兔抗ATG5(1/1 000)、兔抗LC3II(1/1 000)、兔抗P62(1/1 000)、兔抗VDAC1(1/1 000)、兔抗IL-1β(1/1 000) 兔抗SYP(1/40 000)、兔抗SYN-1(1/8 000)、兔抗PSD95(1/8 000)、兔抗β-肌动蛋白(1/10 000),鼠抗β-Tubulin(1/5 000);二抗是相应的辣根过氧化物酶标记的羊抗兔(1/1 000)、羊抗鼠(1/1 000)。
6. 免疫荧光检测:取小鼠完整脑组织,在4%多聚甲醛中保存至少24 h。经15%和30%蔗糖浓度梯度脱水后,双蒸水包埋,在冷冻切片机进行冠状连续冷冻切片,切片厚度为30 μm。选取海马大小一致的切片经磷酸盐缓冲液(PBS)(0.01 mol/L,pH7.4)漂洗3次×10 min。5%驴血清室温封闭2 h,加入线粒体阴离子通道蛋白1(VDAC1)(1/200)、神经胶质纤维酸性蛋白(GFAP)(1/2 000)、神经元核抗原蛋白(NEUN)(1/2 000)、离子钙接头蛋白分子1(IBA-1)(1/1 000), 室温孵育2 h后,4℃过夜。第2天复温30 min后,PBS漂洗10 min×3次,加入Alexa488标记的驴抗兔(1/1 000)、Cy3标记的羊抗鼠(1/1 000)、Cy3标记的驴抗羊(1/1 000), 避光孵育1h后,PBS漂洗10 min×3次。贴片后,使用抗荧光衰减封片剂(含DAPI)封片,在荧光显微镜下进行观察和拍摄。
7. 统计学处理:采用GraphPad Prism 6软件进行统计学分析,数据经正态性检验符合正态分布,数据以x±s表示,多组之间比较采用单因素方差分析,Bonferroni法进行组间比较。P < 0.05为差异有统计学意义。
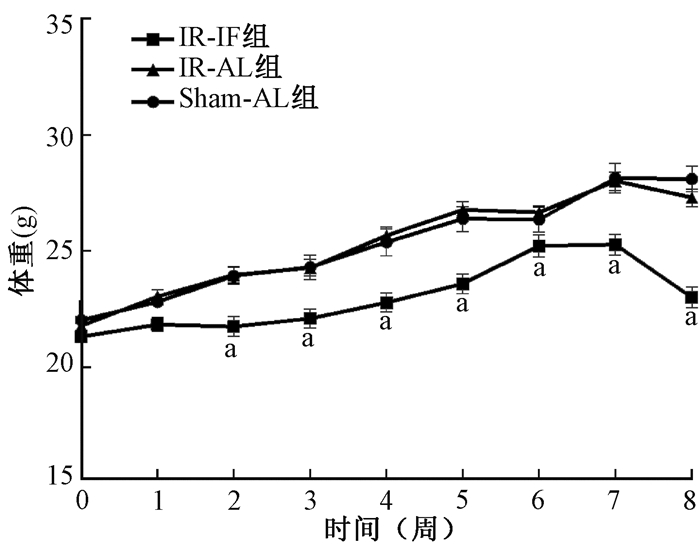
结果1. 间歇性热量限制对小鼠体重的影响:整个间歇性热量限制处理过程中动物的平均体重变化见图 1。照射后,Sham-AL组和IR-AL组小鼠平均体重差异无统计学意义(P>0.05)。照射后第2天开始进行间歇性热量限制(隔日禁食,不禁水)。照射后2周IR-IF组小鼠平均体重明显低于Sham-AL组和IR-AL组(F=3.30,P < 0.05)。
|
注:a与IR-AL组比较,t=3.93、3.86、5.12、5.66、2.57、4.86、7.61,P < 0.05 图 1 3组小鼠照射后不同时间平均体重变化 Figure 1 Change in average weights of mice in the 3 groups at different time points after irradiation |
2.间歇性热量限制对辐射小鼠认知功能的影响:新旧事物识别实验结果显示,间歇性热量限制可以改善辐射所致小鼠认知功能障碍(F=5.64, P < 0.05),与Sham-AL组小鼠新事物识别指数(30.02 ± 9.05)相比,IR-AL组小鼠新事物识别指数(-22.45 ± 16.76)明显下降(t=3.03, P < 0.05);与IR-AL组小鼠相比,IR-IF组小鼠新事物识别指数(21.22 ± 5.62)有所升高,差异有统计学意义(t=2.70, P < 0.05)。
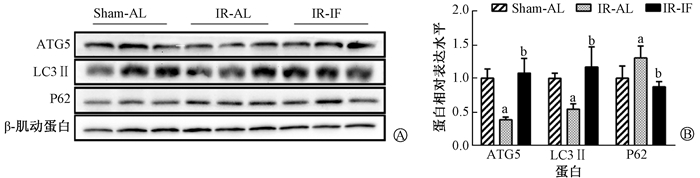
3.间歇性热量限制对小鼠海马自噬相关蛋白的影响:组间ATG5、LC3II和P62的表达差异有统计学意义(F=4.71、4.10、5.58,P < 0.05),见图 2。与Sham-AL组相比,IR-AL组小鼠海马自噬标记蛋白(ATG5和LC3II)表达下降(t=2.49、2.19, P < 0.05),抗自噬标记蛋白(P62)表达上升(t=2.40, P < 0.05)。与IR-AL组相比,IR-IF组小鼠海马自噬标记蛋白(ATG5和LC3II)表达上升(t=2.88、2.71, P < 0.05),抗自噬标记蛋白(P62)表达下降(t=3.18, P < 0.05),表明间歇性热量限制可以激活辐射小鼠海马内自噬。
|
注: a与Sham-AL组比较,t=2.49、2.19、2.40,P < 0.05; b与IR-AL组比较,t=2.88、2.71、3.18,P < 0.05 A. Western blot实验的蛋白条带;B.蛋白的相对表达量 图 2 照射后各组小鼠海马区自噬相关蛋白(ATG5、LC3II、P62)表达变化 A. Representative protein bands of Western blot assay; B. Relative expression level of each protein Figure 2 The expressions of autophagy-related protein ATG5, LC3II, P62 in mice hippocampus of each group after irradiation |
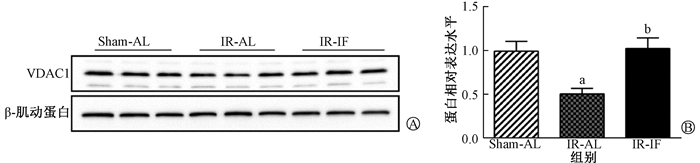
4.间歇性热量限制对辐射小鼠海马VDAC1蛋白的影响:间歇性热量限制可以改善辐射诱导小鼠海马VDAC1蛋白表达的下降(F=7.49,P < 0.05),见图 3。与Sham-AL组相比,IR-AL组小鼠海马VDAC1蛋白表达明显下降(t=3.47, P < 0.05)。与IR-AL组相比,IR-IF组小鼠海马VDAC1蛋白表达明显上升(t=3.18, P < 0.05)。
|
注: a与Sham-AL组相比较,t=3.47,P < 0.05; b与IR-AL组相比较,t=3.18,P < 0.05 A. Western blot实验的蛋白条带;B.蛋白的相对表达量 图 3 辐射后各组小鼠海马区VDAC1蛋白表达变化 A. Representative protein bands of Western blot assay; B. Relative expression level of each protein Figure 3 Expression of VDAC1 protein in mice hippocampus of each group after irradiation |
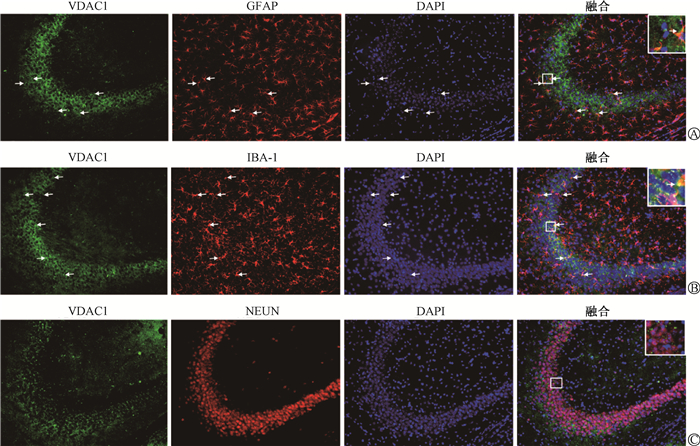
5.VDAC1的细胞定位:VDAC1在小鼠海马区的细胞定位,结果见图 4。免疫荧光分析显示,VDAC1与小胶质细胞标记物IBA-1和星形胶质细胞标记物GFAP共表达,但与神经元标记物NEUN不共表达。
|
注:A,B图中箭头所指均为共定位区域 A.VDAC1与星形胶质细胞标记物GFAP的荧光双标;B.VDAC1与小胶质细胞标记物IBA-1的荧光双标;C.VDAC1与神经元标记物NEUN的荧光双标 图 4 VDAC1分别与GFAP、IBA-1、NEUN的细胞免疫荧光定位 ×20 A. Dual-labeling of VDAC1 protein and GFAP protein (marker for astrocytes); B. Dual-labeling of VDAC1 protein and IBA-1 (marker for microglia); C. Dual-labeling of VDAC1 protein and NEUN (marker forneuron) Figure 4 Immunofluorescence localizations of VDAC1, GFAP, IBA-1 and NEUN ×20 |
6.间歇性热量限制对辐射小鼠海马炎症因子的影响:间歇性热量限制对辐射小鼠海马炎症因子(IL-1β)的影响(F=5.99,P < 0.05,)见图 5。与Sham-AL组相比,IR-AL组小鼠海马IL-1β蛋白表达上升(t=2.87,P < 0.05)。与IR-AL组相比,IR-IF组小鼠海马IL-1β蛋白表达明显下降(t=3.11,P < 0.05)。
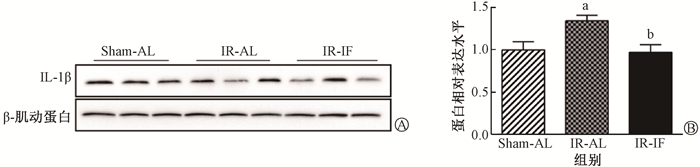
|
注: a与Sham-AL组相比较,t=2.87,P < 0.05; b与IR-AL组相比较,t=3.11,P < 0.05 A. Western blot实验的蛋白条带;B.蛋白的相对表达量 图 5 照射后各组小鼠海马区IL-1β蛋白表达变化 A. Representative protein bands of Western blot assay; B. Relative expression level of each protein Figure 5 Expression of IL-1β protein in mice hippocampus of each group after irradiation |
7.间歇性热量限制对辐射小鼠海马区神经元突触可塑性的影响:实验各组海马突触相关蛋白的表达见图 6。各组间突触相关蛋白SYP、SYN-1、PSD95的表达差异有统计学意义(F=5.67、5.76、3.81, P < 0.05)。与Sham-AL组相比,辐射下调海马SYP、SYN-1、PSD95的表达(t=2.25、2.17、2.31, P < 0.05),而间歇性热量限制干预上调其表达(t=3.30、3.35、2.53,P < 0.05)。
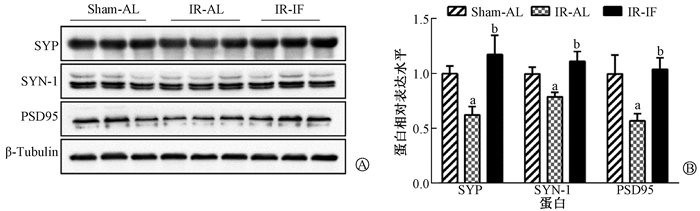
|
注: a与Sham-AL组比较,t=2.25、2.17、2.31,P < 0.05; b与IR-AL组比较,t=3.30、3.35、2.53,P < 0.05 A. Western blot实验的蛋白条带;B.蛋白的相对表达量 图 6 照射后各组小鼠海马区突触相关蛋白SYP、SYN-1、PSD95表达变化 A. Representative protein bands of Western blot assay; B. Relative expression level of each protein Figure 6 Expressions of synapse-associated proteins SYP, SYN-1, PSD95 in mice hippocampus of each group after irradiation |
讨论
本研究参照Tong等[11]的研究给予10 Gy单次全脑X射线照射小鼠成功构建放射性认知功能障碍模型,采用间歇性热量限制干预,结果表明,间歇性热量限制对辐射所致小鼠认知功能障碍具有改善作用,其机制可能与上调海马区VDAC1蛋白表达、诱导自噬发生,最终抑制炎症因子释放和保护神经元突触可塑性有关。
自噬与细胞营养状况密切相关,热量限制可以诱导自噬[12],自噬增强改善认知功能[13]。抑制自噬会降低记忆和认知功能[14]。自噬是通过形成双膜囊泡启动的,这些囊泡包裹蛋白质或细胞器,形成成熟的自噬体,并与溶酶体融合,形成自噬溶酶体并降解其内容物[15]。间歇性热量限制导致细胞内代谢物乙酰辅酶A的消耗[16]。乙酰辅酶A介导的自噬抑制所需的主要乙酰转移酶是EP300,它可以将乙酰基从乙酰辅酶A转移到自噬核心蛋白(包括ATG5和LC3),从而抑制它们的自噬活性[17]。ATG5是自噬启动所必需的,细胞质蛋白LC3向吞噬体的脂质化和再分布有助于自噬发生。P62蛋白通过其泛素结合域和LC3相互作用区识别标记为降解的细胞成分,并以其作为自噬靶点,自噬清除障碍导致P62的累积和细胞功能障碍[18-19]。本研究对全脑辐射后小鼠行间歇性热量限制干预,其体重增加明显低于假辐射+随意饮食组和辐射+随意饮食组小鼠,表明干预措施有效。检测结果表明,全脑辐射后小鼠海马区自噬相关蛋白ATG5、LC3Ⅱ表达下降,P62表达升高,行为学结果提示辐射后小鼠认知功能出现障碍。间歇性热量限制干预后,ATG5、LC3II蛋白表达上升,P62蛋白表达下降,认知功能得到改善。这提示间歇性热量限制可能通过增强小鼠海马区自噬改善放射性认知功能障碍。
线粒体自噬是自噬选择性清除线粒体的一个过程,自噬通过线粒体自噬参与线粒体的质量控制[20]。线粒体是调节神经元功能的基础[21]。由于VDAC1与线粒体功能密切相关[22],因此,进一步检测小鼠海马区VDAC1蛋白表达变化,发现辐射后小鼠海马区VDAC1表达下降,间歇性热量限制干预可以逆转这一变化。LC3通过VDAC在线粒体外膜上形成的通道激活线粒体自噬[23],提示VDAC1可能是间歇性热量限制改善放射性认知功能障碍的一个重要靶点。本研究采用免疫荧光技术,观察了VDAC1在小鼠海马中的细胞定位。免疫荧光分析显示,VDAC1与小胶质细胞标记物IBA-1和星形胶质细胞标记物GFAP共表达,但与神经元标记物NeuN不共表达。胶质细胞(包括小胶质细胞和星形胶质细胞)是神经炎症的主要介质[24-25]。活化的小胶质细胞和星形胶质细胞,释放炎症因子,引发神经炎症,导致认知功能障碍[25-26]。进一步检测小鼠海马区炎症因子IL-1β,结果显示,辐射后小鼠海马区IL-1β表达上升,经间歇性热量限制干预后,辐射小鼠海马区IL-1β被抑制。Ye等[27]的研究发现自噬与炎症密切相关,抑制自噬会引发神经炎症。提示间歇性热量限制改善辐射小鼠认知功能障碍可能与海马区VDAC1蛋白表达上调,诱发线粒体自噬,抑制胶质细胞释放炎症因子有关。
胶质细胞激活等神经炎症会影响突触可塑性[28],导致学习能力和其他认知功能下降[29]。为了研究间歇性热量限制干预后神经炎症和突触可塑性之间的关系,检测了小鼠海马组织突触相关蛋白,后者主要由突触前标记物突触素(SYP)和突触酶1(SYN-1)以及突触后密度蛋白95(PSD95)组成)[30-31]。检测结果显示,照射后小鼠海马组织SYP、SYN-1、PSD95蛋白表达下降,间歇性热量限制干预后蛋白表达上升,提示间歇性热量限制改善认知功能可能是通过抑制胶质细胞炎症因子释放,保护神经元突触可塑性起作用。
总之,本研究结果表明,间歇性热量限制对辐射所致小鼠认知功能障碍具有改善作用,其机制可能与上调海马区VDAC1蛋白表达,诱导自噬,抑制炎症因子释放和保护神经元突触可塑性有关。
利益冲突 所有研究者未因该研究接受不正当的职务或财务利益,在此对研究的独立性和科学性予以保证
作者贡献声明 吴琼、袁蕾、刘政海、王贞负责研究方案的设计、动物饲养、行为学拍摄及评分、论文撰写;余敏、杨惠、李彩指导实验设计和论文修改;艾小红提供辐射仪及技术指导;何洁、万炜负责总体实验设计,指导论文撰写
| [1] |
Kerschbaumer J, Pinggera D, Holzner B, et al. Sector irradiation vs. whole brain irradiation after resection of singular brain metastasis-a prospective randomized monocentric trial[J]. Front Oncol, 2020, 10(1): 591884. DOI:10.3389/fonc.2020.591884 |
| [2] |
Makale MT, McDonald CR, Hattangadi-Gluth JA, et al. Mechanisms of radiotherapy-associated cognitive disability in patients with brain tumours[J]. Nat Rev Neurol, 2017, 13(1): 52-64. DOI:10.1038/nrneurol.2016.185 |
| [3] |
McDuff SG, Taich ZJ, Lawson JD, et al. Neurocognitive assessment following whole brain radiation therapy and radiosurgery for patients with cerebral metastases[J]. J Neurol Neurosurg Psychiatry, 2013, 84(12): 1384-1391. DOI:10.1136/jnnp-2013-305166 |
| [4] |
Kleinberg L. Neurocognitive challenges in brain tumor survivors: is there anything we can do?[J]. J Clin Oncol, 2015, 33(15): 1633-1636. DOI:10.1200/JCO.2014.60.2805 |
| [5] |
Erbaba B, Arslan-Ergul A, Adams MM. Effects of caloric restriction on the antagonistic and integrative hallmarks of aging[J]. Ageing Res Rev, 2021, 66(1): 101228. DOI:10.1016/j.arr.2020.101228 |
| [6] |
Liu Y, Cheng A, Li YJ, et al. SIRT3 mediates hippocampal synaptic adaptations to intermittent fasting and ameliorates deficits in APP mutant mice[J]. Nat Commun, 2019, 10(1): 1886. DOI:10.1038/s41467-019-09897-1 |
| [7] |
Chen Y, Ling L, Su G, et al. Effect of intermittent versus chronic calorie restriction on tumor incidence: a systematic review and meta-analysis of animal studies[J]. Sci Rep, 2016, 6(1): 33739. DOI:10.1038/srep33739 |
| [8] |
张圆, 林祎, 吴琼, 等. 头部X射线照射致认知障碍过程中小鼠海马小胶质细胞形态变化[J]. 辐射研究与辐射工艺学报, 2021, 39(6): 63-71. Zhang Y, Lin Y, Wu Q, et al. Relationship between cognitive impairment induced by local radiation and morphological changes of hippocampal microglia[J]. J Radiat Res Radiat Pro, 2021, 39(6): 63-71. DOI:10.11889/j.1000-3436.2021.rrj.39.060301 |
| [9] |
牛磊, 罗诗诗, 曾佳玉, 等. 热量限制改善早期社会隔离诱导的小鼠认知功能障碍[J]. 解剖学报, 2019, 50(4): 418-422. Niu L, Luo SS, Zeng JY, et al. Effect and mechanism of caloric restriction on early social isolation-induced cognitive impairment in mice[J]. Acta Anatomica Sinica, 2019, 50(4): 418-422. DOI:10.16098/j.issn.0529-1356.2019.04.003 |
| [10] |
刘政海, 罗诗诗, 王贞, 等. NLRP3炎性小体抑制剂MCC950对辐射所致认知障碍的保护作用[J]. 中华放射医学与防护杂志, 2020, 40(10): 733-739. Liu ZH, Luo SS, Wang Z, et al. MCC950, a NLRP3 inflammasome inhibitor, prevents radiation-induced cognitive impairment in mice[J]. Chin J Radiol Med Prot, 2020, 40(10): 733-739. DOI:10.3760/cma.j.issn.0254-5098.2020.10.001 |
| [11] |
Tong F, Zhang J, Liu L, et al. Corilagin attenuates radiation-induced brain injury in mice[J]. Mol Neurobiol, 2016, 53(10): 6982-6996. DOI:10.1007/s12035-015-9591-6 |
| [12] |
Thomas M, Davis T, Nell T, et al. Amino acid starvation sensitizes resistant breast cancer to doxorubicin-induced cell death[J]. Front Cell Dev Biol, 2020, 8(1): 565915. DOI:10.3389/fcell.2020.565915 |
| [13] |
Zhu JP, Zhang ZZ, Yang QY, et al. Metformin attenuates sevoflurane-induced neurocognitive impairment through AMPK-ULK1-dependent autophagy in aged mice[J]. Brain Res Bull, 2020, 157(1): 18-25. DOI:10.1016/j.brainresbull.2020.01.018 |
| [14] |
Zhang W, Feng C, Jiang H. Novel target for treating Alzheimer's diseases: Crosstalk between the Nrf2 pathway and autophagy[J]. Ageing Res Rev, 2021, 65(1): 101207. DOI:10.1016/j.arr.2020.101207 |
| [15] |
Devenport SN, Shah YM. Functions and implications of autophagy in colon cancer[J]. Cells, 2019, 8(11): 1349. DOI:10.3390/cells8111349 |
| [16] |
Marino G, Pietrocola F, Madeo F, et al. Caloric restriction mimetics: natural/physiological pharmacological autophagy inducers[J]. Autophagy, 2014, 10(11): 1879-1882. DOI:10.4161/auto.36413 |
| [17] |
Cho YH, Kim GH, Park J J. Mitochondrial aconitase 1 regulates age-related memory impairment via autophagy/mitophagy-mediated neural plasticity in middle-aged flies[J]. Aging Cell, 2021, 20(12): e13520. DOI:10.1111/acel.13520 |
| [18] |
Manirujjaman M, Ozaki I, Murata Y, et al. Degradation of the tumor suppressor PDCD4 is impaired by the suppression of p62/SQSTM1 and autophagy[J]. Cells, 2020, 9(1): 218. DOI:10.3390/cells9010218 |
| [19] |
Yurube T, Hirata H, Ito M, et al. Involvement of autophagy in rat tail static compression-induced intervertebral disc degeneration and notochordal cell disappearance[J]. Int J Mol Sci, 2021, 22(11): 5648. DOI:10.3390/ijms22115648 |
| [20] |
Vera-Ramirez L. Cell-intrinsic survival signals. The role of autophagy in metastatic dissemination and tumor cell dormancy[J]. Semin Cancer Biol, 2020, 60(1): 28-40. DOI:10.1016/j.semcancer.2019.07.027 |
| [21] |
Zhou J, Yang Z, Shen R, et al. Resveratrol improves mitochondrial biogenesis function and activates pgc-1alpha pathway in a preclinical model of early brain injury following subarachnoid hemorrhage[J]. Front Mol Biosci, 2021, 8(1): 620683. DOI:10.3389/fmolb.2021.620683 |
| [22] |
Zhu Y, Zhang C, Xu F, et al. System biology analysis reveals the role of voltage-dependent anion channel in mitochondrial dysfunction during non-alcoholic fatty liver disease progression into hepatocellular carcinoma[J]. Cancer Sci, 2020, 111(11): 4288-4302. DOI:10.1111/cas.14651 |
| [23] |
Moras M, Hattab C, Gonzalez-Menendez P, et al. Downregulation of mitochondrial TSPO inhibits mitophagy and reduces enucleation during human terminal erythropoiesis[J]. Int J Mol Sci, 2020, 21(23): 9066. DOI:10.3390/ijms21239066 |
| [24] |
Qi Y, Li R, Xu L, et al. Neuroprotective effect of dioscin on the aging brain[J]. Molecules, 2019, 24(7): 1247. DOI:10.3390/molecules24071247 |
| [25] |
乃爱桃, 王贞, 曹文宇, 等. 丰富环境对辐射诱导小鼠认知障碍的保护作用及可能机制[J]. 中华放射医学与防护杂志, 2018, 38(6): 401-406. Nai AT, Wang Z, Cao WY, et al. The protective effect of environmental enrichment on radiation induced cognitive dysfunction and underlying mechanism[J]. Chin J Radiol Med Prot, 2018, 38(6): 401-406. DOI:10.3760/cma.j.issn.0254-5098.2018.06.001 |
| [26] |
Acharya MM, Baulch JE, Lusardi TA, et al. Corrigendum: adenosine kinase inhibition protects against cranial radiation-induced cognitive dysfunction[J]. Front Mol Neurosci, 2017, 10(1): 218. DOI:10.3389/fnmol.2017.00218 |
| [27] |
Ye X, Zhu M, Che X, et al. Lipopolysaccharide induces neuroinflammation in microglia by activating the MTOR pathway and downregulating Vps34 to inhibit autophagosome formation[J]. J Neuroinflammation, 2020, 17(1): 18. DOI:10.1186/s12974-019-1644-8 |
| [28] |
Cai M, Lee JH, Yang EJ. Electroacupuncture attenuates cognition impairment via anti-neuroinflammation in an Alzheimer's disease animal model[J]. J Neuroinflammation, 2019, 16(1): 264. DOI:10.1186/s12974-019-1665-3 |
| [29] |
Chen X, Drew J, Berney W, et al. Neuroprotective natural products for Alzheimer's disease[J]. Cells, 2021, 10(6): 1309. DOI:10.3390/cells10061309 |
| [30] |
Shah SA, Khan M, Jo MH, et al. Melatonin stimulates the SIRT1/Nrf2 signaling pathway counteracting lipopolysaccharide (LPS)-induced oxidative stress to rescue postnatal rat brain[J]. CNS Neurosci Ther, 2017, 23(1): 33-44. DOI:10.1111/cns.12588 |
| [31] |
Yakoub AM, Sadek M. Analysis of synapses in cerebral organoids[J]. Cell Transplant, 2019, 28(9-10): 1173-1182. DOI:10.1111/cns.12588 |
 2022, Vol. 42
2022, Vol. 42


