电离辐射诱导的远端效应是指射线局部集中照射肿瘤后,距离肿瘤远端部位的非照射区域发生损伤[1-2]。远端效应除了引起转移瘤消退外,对正常组织的损伤也不容忽视,后者会给肿瘤患者带来一系列不良反应,甚至影响治疗效果和生存质量[3]。胸部放射治疗是治疗胸部肿瘤的主要方法之一,为提高放疗比、缩短治疗时间,大分割模式(单次剂量> 2.5 Gy)治疗肿瘤开始被接纳并推广[4]。育龄男性肿瘤患者在放射治疗后出现生育能力下降和后代健康受损等一系列生殖健康问题,引起广泛关注。近年研究发现,胸部电离辐射可诱导雄性小鼠睾丸结构和功能损伤,并使其生育能力降低[5-6],提示育龄男性胸部肿瘤患者在放射治疗后也可能出现生育力降低等生殖健康问题。因此,本研究观察了X射线胸部照射对雄性成年小鼠精子质量的影响,并从附睾组织结构、睾丸分泌功能和生精细胞凋亡等方面探讨了胸部电离辐射诱导远端效应致精子发生障碍的机制,以期为临床胸部放射治疗诱导的远端效应致男性生殖系统损伤的防治提供理论和实验依据。
材料与方法1. 动物分组和取材:清洁级C57BL/6小鼠24只,健康雄性,6~8周龄,体重(22.4 ± 1.0)g,购自空军军医大学实验动物中心[生产许可证号:XK(陕2014-002)],饲养于恒定室温环境中,温度(23 ± 1)℃,空气湿度(50 ± 5)%,自由进食进水。将小鼠按照随机数表法分为照射组(Radiation)和假照射组(Sham),每组12只,于照射后第7天和第21天取材。1%戊巴比妥钠60 mg/kg腹腔麻醉小鼠后,剥离双侧睾丸,一侧冻存于-80℃待提取组织全蛋白,另一侧固定于Bouin氏液(北京雷根公司)中进行组织形态学检测;剥离双侧附睾尾制备精子悬液用于精子数量统计。所有动物操作均依照空军军医大学实验动物伦理要求进行,并已获得实验动物中心实验动物福利与伦理委员会批准(IACUC-20210105)。
2. X射线照射条件:采用Rad Source RS 2000系列X射线生物照射仪(Rad Source,美国)。照射组小鼠在清醒状态下单只放置于有机玻璃盒内以固定体位,使用铅屏蔽装置遮挡小鼠身体其他部位,实施胸部X射线照射。胸部照射面积为1.5 cm × 2 cm,剂量率3.04 Gy/min,8 Gy/d,连续照射3 d,总剂量24 Gy。假照射组小鼠操作同照射组,但X射线源关闭。
3. 小鼠体重和睾丸系数测定:小鼠适应性喂养5 d后进行X射线胸部照射。照射期间,每天照射前记录各组小鼠体重,照射后每3天记录一次体重。照射后第7天和第21天取材,剥离双侧睾丸并称重,计算睾丸系数。
4. 小鼠睾丸和附睾组织HE染色:小鼠睾丸、附睾在Bouin氏液中固定20 h后,梯度脱水后石蜡包埋,进行冠状面切片(厚度4 μm),常规脱蜡复水后进行HE染色。
5. 小鼠睾丸生精小管直径和上皮厚度测定:HE染色后,在光学显微镜(德国Leica公司)下观察生精小管结构,每组随机选取40个长径:短径 < 1.2 ∶1的生精小管,用ImageJ 1.43 u软件进行十字交叉法测量其直径和生精上皮厚度。
6. 小鼠精子数量统计:将双侧附睾尾横剪后置于1 ml精子培养液中,在37℃摇床上缓慢摇晃40 min后制成精子悬液,稀释10倍后冲入一次性尿沉渣计数板(BMJ Ventures Inc, 加拿大),在光学显微镜下计数。
7. TUNEL染色及凋亡相关蛋白水平测定:小鼠睾丸组织石蜡切片脱蜡复水,进行TUNEL染色(美国罗氏TUNEL染色试剂盒)。小鼠睾丸组织进行全蛋白提取(南京凯基生物公司)后,进行Western blot(小鼠抗β-肌动蛋白单克隆抗体,1 ∶5 000,美国CMCTAG公司;兔抗Cleaved caspase-3多克隆抗体,1 ∶2 000,武汉Proteintech公司,检测睾丸内Cleaved Caspase-3的蛋白水平。
8. 睾丸支持细胞分泌因子的测定:干细胞因子(stem cell factor, SCF)和胶质源性神经营养因子(glial derived neurotrophic factor, GDNF)是由支持细胞分泌,对精原干细胞的增殖和分有重要的作用。在冰上提取小鼠睾丸组织全蛋白(南京凯基生物公司),使用ELISA试剂盒(武汉Elabscience生物公司)检测SCF和GDNF水平。
9. 统计学处理:采用SPSS 25.0软件进行分析。数据符合正态分布,以x±s形式表示。组间均数比较采用独立样本t检验,GraphpadPrism 8.2软件作图。P < 0.05为差异有统计学意义。
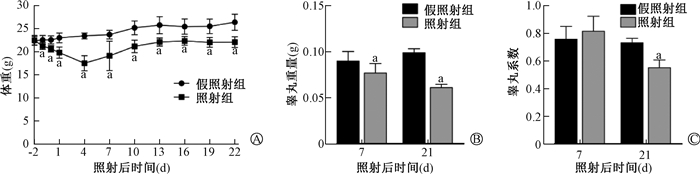
结果1. 小鼠一般状况:小鼠体重监测结果显示,与假照射组相比,照射后第1天照射组小鼠体重即开始下降,照射后第4天体重下降至最低,之后照射组体重开始缓慢增加,但到照射后第21天时,照射组小鼠体重仍显著低于假照射组(t = 5.01,P < 0.05,图 1);与假照射组相比,照射后第7天和第21天,照射组小鼠睾丸重均明显降低(t = 3.14、16.33,P < 0.05,图 1),照射组小鼠睾丸系数在照射后第7天无明显变化,但在照射后第21天明显降低(t = 6.57,P < 0.05,图 1)。上述结果提示,本研究条件下的X射线胸部照射可损害小鼠的一般健康状况。
|
注:a与同一时间假照射组比较,t =5.70、9.36、10.77、11.61、4.79、5.97、5.33、4.86、5.48、5.01、3.14、16.33、6.57,P < 0.05 A.小鼠体重; B. 睾丸重; C. 睾丸系数 图 1 X射线胸部照射对成年雄性C57小鼠一般健康状况的影响 A. Body weight of mice; B. Testicular weight; C. Testicular index Figure 1 The effect of thoracic X-ray irradiation on the general health status of adult male C57 mice |
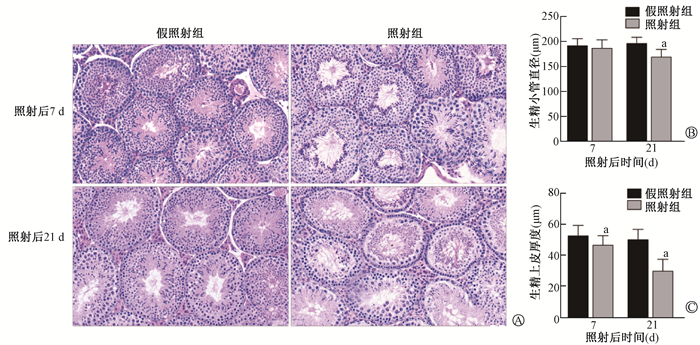
2. 小鼠睾丸形态、生精小管直径和生精上皮厚度的变化:睾丸HE染色结果显示,与假照射组相比,照射组在照射后第7天生精小管内各级生精细胞排列絮乱,管腔内成熟精子开始减少;照射后第21天各级生精细胞大量减少,管腔内精子丢失并伴有大量空泡化(图 2)。与假照射组相比,照射组在照射后第7天生精小管直径无明显改变,但在照射后第21天生精小管直径显著降低(t = 8.93,P < 0.05,图 2)。照射组在照射后第7天和第21天生精上皮厚度均减小(t = 4.24、12.77,P < 0.05,图 2)。上述结果提示,本研究条件的X射线胸部照射可损伤小鼠睾丸组织结构。
|
注:a与同一时间假照射组比较,t = 8.93、4.24、12.77,P < 0.05 A. 睾丸组织HE染色×200;B. 生精小管直径;C. 生精上皮厚度 图 2 X射线胸部照射第7天和21天对成年雄性C57小鼠睾丸组织生精小管形态结构的影响 A. The results of testicular HE staining ×200; B. The diameter of the seminiferous tubule; C. The seminiferous epithelium Figure 2 The effect of thoracic X-ray irradiation on the morphology and structure of seminiferous tubules in adult male C57 mice testis at 7 d and 21 d after irradiation |
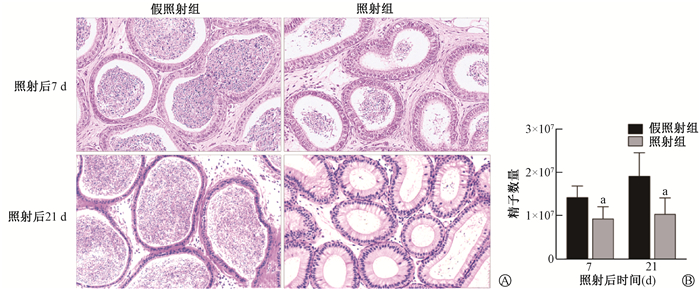
3. 小鼠附睾形态和精子数量的变化:附睾HE染色结果显示,与假照射组相比,照射组在照射后第21天,附睾基底层细胞肿胀,管腔内精子明显减少(图 3)。与假照射组相比,照射组在照射后第7天和第21天精子数量均下降(t = 4.30、2.98,P < 0.05,图 3)。上述结果提示,本研究条件下的X射线胸部照射可损伤小鼠附睾形态结构并降低精子数量。
|
注:a与同一时间假照射组比较,t =4.30、2.98,P < 0.05 A. 附睾组织HE染色×200;B. 精子数量 图 3 X射线胸部照射后第7天和21天对成年雄性C57小鼠精子数量的影响 A. The representative images of epididymis HE staining ×200; B. Sperm number Figure 3 The effect of thoracic X-ray irradiation on the sperm number of adult male C57 mice at 7 d and 21 d after irradiation |
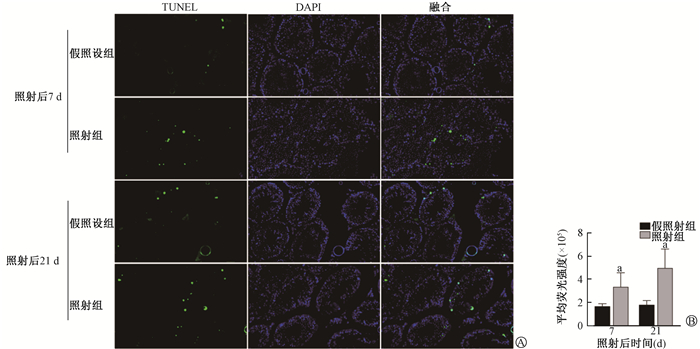
4. 小鼠睾丸生精细胞凋亡的变化:TUNEL染色结果显示,与假照射组相比,照射组睾丸内生精小管上皮中TUNEL阳性细胞在照射后第7天和第21天明显增加(t = -2.73、-3.74,P < 0.05,图 4)。Western blot结果显示,Cleaved Caspase-3蛋白表达在照射后第7天和第21天显著增加(t = -2.96、-2.46,P < 0.05,图 5)。上述结果提示,本研究条件下的X射线胸部照射可诱导生精细胞凋亡。
|
注:a与同一时间假照射组比较,t =-2.73、-3.74,P < 0.05 A. TUNEL染色×200;B. TUNEL染色荧光定量分析 图 4 X射线胸部照射后第7天和第21天成年雄性C57小鼠睾丸组织TUNEL染色结果 A. TUNEL staining ×200; B. Fluorescence quantitative analysis of TUNEL staining Figure 4 TUNEL staining of testis tissue of adult male C57 mice at 7 d and 21 d after thoracic X-ray irradiation |

|
注:a与同一时间假照射组比较,t =-2.96、-2.46,P < 0.05 A. 蛋白杂交结果图;B. Cleaved Caspase-3蛋白水平定量分析 图 5 X射线胸部照射后第7天和21天成年雄性C57小鼠睾丸组织凋亡相关蛋白水平的变化 A. Western blot assay of Cleaved-Caspase-3; B. Quantitative analysis of Cleaved Caspase-3 protein expression levels Figure 5 The levels of apoptosis-related proteins in adult male C57 mice testis tissue at 7 d and 21 d after thoracic X-ray irradiation |
5. 小鼠睾丸内SCF和GDNF含量的变化:ELISA检测结果显示,与假照射组相比,照射组睾丸内SCF和GDNF在照射后第7天差异均无统计学意义(P > 0.05),在照射后第21天均显著增加(t = -10.46、-5.42,P < 0.05,图 6)。上述结果提示,本研究条件下的X射线胸部照射可增强睾丸支持细胞的分泌功能。

|
注:SCF.干细胞因子;GDNF.胶质源性神经营养因子;a与同一时间假照射组比较,t =-10.46、-5.42,P < 0.05 A. SCF含量;B. GDNF含量 图 6 X射线胸部照射后第7天和第21天成年雄性C57小鼠睾丸组织SCF和GDNF水平的变化 A. The concentrations of SCF; B. The concentrations of GDNF Figure 6 The concentrations of SCF and GDNF in adult male C57 mice testis tissue at 7 d and 21 d after thoracic X-ray irradiation |
讨论
既往研究表明,放射治疗不仅可以杀死照射区域的肿瘤,远端未照射的肿瘤会受到抑制[7-8],同时也会引起远端正常组织和器官的异常,并影响肿瘤患者的治疗效果[9]。众所周知,睾丸是对电离辐射较为敏感的器官之一。电离辐射可以破坏睾丸的正常代谢、增殖和分化,进而导致精子发生障碍和不育[10]。近年来研究表明,胸部电离辐射的远端效应可导致雄性动物生殖系统损伤及生育力下降。因此,本研究采用X射线(8 Gy × 3 d)胸部照射探讨X射线胸部照射远端效应致成年小鼠精子发生障碍及其机制。
睾丸组织生精上皮主要是由支持细胞和各级生精细胞组成,是精子发生的起始部位。Guo等[6]研究发现,小鼠头部X射线(5 Gy × 4 d)照射后4周,辐射诱导的远端效应对睾丸结构和功能均产生损伤,并最终降低小鼠的精子质量,与本研究的结果一致,表明了睾丸对电离辐射诱导的远端效应较为敏感。Zhang等[11]研究发现,胸部X射线(8 Gy × 3 d)照射小鼠右胸后第0、1、7、60和180天,观察小鼠睾丸组织形态结构,在照射后第7天睾丸组织形态结构损伤最为严重,第7天后损伤开始恢复。本实验结果显示,X射线胸部照射小鼠后第7天睾丸组织形态发生损伤,但在照射后第21天睾丸组织形态损伤更为严重,考虑由于胸部照射面积不同,导致睾丸组织发生损伤的时间不同,同时再次证实了X射线胸部照射远端效应可诱导生殖系统的损伤。
睾丸输出的精子需要在附睾中进行一系列形态结构和功能的变化,并获得运动和受精能力[12]。目前关于电离辐射诱导的远端效应对附睾的影响少见报道。本研究结果显示,X射线胸部照射小鼠后第7天和21天均会损伤附睾组织形态结构,且在照射后第21天附睾组织损伤更为严重,精子质量也进一步下降,这与睾丸损伤的变化规律是一致的,提示X射线胸部照射可诱导附睾形态结构发生损伤。
细胞凋亡是一种正常机体发育机制中由基因调控的细胞程序性死亡的过程,对机体的正常生存及内环境稳态等有重要作用。众所周知,电离辐射直接照射可诱导多种正常组织和器官发生细胞凋亡[13]。据报道,X射线右胸照射大鼠后,大鼠睾丸组织Caspase-3和Caspase-8表达均增强,用照射后的大鼠血清体外培养TM4细胞,发现细胞凋亡也显著增加,这表明电离辐射的远端效应也可诱导睾丸组织的凋亡[14]。本研究也显示,X射线胸部照射小鼠后7 d和第21 d睾丸生精上皮细胞凋亡明显增加,导致细胞最终凋亡的主要执行蛋白酶Cleaved Caspase-3蛋白水平显著升高,提示X射线胸部照射诱导的睾丸损伤可能与生精细胞凋亡增加有关。
支持细胞在睾丸内与生精细胞相邻,为不同阶段生精细胞提供所需营养因子和生存微环境[15]。SCF和GDNF是有支持细胞分泌的两种活性因子,SCF可促进精原细胞分化,GDNF可促进精原细胞增殖[16-17]。研究报道,X射线头部照射诱导远端效应在照射后4周出现支持细胞分泌功能紊乱[6]。本实验研究条件下,X射线胸部照射后21 d支持细胞分泌功能也出现明显紊乱,提示,睾丸支持细胞分泌功能紊乱可能参与了电离辐射致远端生殖系统的损伤效应。
辐射远端效应的作用机制较为复杂,目前尚不清楚,常见的学说有氧化应激,免疫介导,炎症因子和外泌体等。关于胸部照射介导远端生殖损伤的作用机制,目前研究较少。本研究重点探讨了X射线胸部照射诱导的远端效应对成年小鼠精子发生及其微环境的影响,证实胸部照射的确可以导致生精障碍,并且其机制可能与睾丸结构损伤、生精细胞凋亡增加和支持细胞分泌功能紊乱有关。关于其上游机制,本研究认为辐射诱导的远端效应是多因子共同参与的结果。除已报道的炎症因子外,自由基和外泌体是否也介导了胸部照射后生殖系统的损伤,是下一步将开展的研究工作。
利益冲突 无
作者贡献声明 来盼盼负责实验操作、数据采集、统计分析和论文撰写;荆云涛、郭玲、薛一哲、刘力源、秦佟洲、周桂强、杜俊泽、苗霞协助实验操作;丁桂荣负责指导课题设计和修改论文
| [1] |
Ashrafizadeh M, Farhood B, Eleojo Musa A, et al. Abscopal effect in radioimmunotherapy[J]. Int Immunopharmacol, 2020, 85: 106663. DOI:10.1016/j.intimp.2020.106663 |
| [2] |
Liu Y, Dong Y, Kong L, et al. Abscopal effect of radiotherapy combined with immune checkpoint inhibitors[J]. J Hematol Oncol, 2018, 11(1): 104. DOI: 10.1186s13045-018-0647-8.
|
| [3] |
金丽娅, 凤志慧. 放疗诱导远端效应的免疫相关机制研究进展[J]. 中国药理学与毒理学杂志, 2020, 34(12): 930-936. Jin LY, Feng ZH. Advances in research on immune-related mechanisms of radiotherapy-induced distal effect[J]. Chin J Pharm Toxicol, 2020, 34(12): 930-936. DOI:10.3867/j.issn.1000-3002.2020.12.005 |
| [4] |
Vischioni B, Petrucci R, Valvo F. Hypofractionation in prostate cancer radiotherapy: a step forward towards clinical routine[J]. Transl Androl Urol, 2019, 8(Suppl 5): S528-S532. DOI:10.21037/tau.2019.11.06 |
| [5] |
Hu S, Zhu L, Song Y, et al. Radiation-induced abscopal reproductive effect is driven by TNF-α/p38 MAPK/Rac1 axis in Sertoli cells[J]. Theranostics, 2021, 11(12): 5742-5758. DOI:10.7150/thno.56853 |
| [6] |
Guo L, Qin TZ, Liu LY, et al. The abscopal effects of cranial irradiation induce testicular damage in mice[J]. Front Physiol, 2021, 12: 717571. DOI:10.3389/fphys.2021.717571 |
| [7] |
Demaria S, Ng B, Devitt ML, et al. Ionizing radiation inhibition of distant untreated tumors (abscopal effect) is immune mediated[J]. Int J Radiat Oncol Biol Phys, 2004, 58(3): 862-870. DOI:10.1016/j.ijrobp.2003.09.012 |
| [8] |
Sun R, Sbai A, Ganem G, et al. Non-targeted effects (bystander, abscopal) of external beam radiation therapy: an overview for the clinician[J]. Cancer Radiother, 2014, 18(8): 770-778. DOI:10.1016/j.canrad.2014.08.004 |
| [9] |
Tamminga J, Koturbash I, Baker M, et al. Paternal cranial irradiation induces distant bystander DNA damage in the germline and leads to epigenetic alterations in the offspring[J]. Cell Cycle, 2008, 7(9): 1238-1245. DOI:10.4161/cc.7.9.5806 |
| [10] |
Marzban M, Anjamshoa M, Jafari P, et al. Effects of gamma rays on rat testis tissue according to the morphological parameters and immunohistochemistry: radioprotective role of silymarin[J]. Electron Physician, 2017, 9(6): 4524-4532. DOI:10.19082/4524 |
| [11] |
Zhang J, Yao D, Song Y, et al. Fractionated irradiation of right thorax induces abscopal damage on testes leading to decline in fertility[J]. Sci Rep, 2019, 9(1): 15221. DOI:10.1038/s41598-019-51772-y |
| [12] |
Sostaric E, Aalberts M, Gadella BM, et al. The roles of the epididymis and prostasomes in the attainment of fertilizing capacity by stallion sperm[J]. Anim Reprod Sci, 2008, 107(3-4): 237-248. DOI:10.1016/j.anireprosci.2008.04.011 |
| [13] |
Almeida C, Correia S, Rocha E, et al. Caspase signalling pathways in human spermatogenesis[J]. J Assist Reprod Genet, 2013, 30(4): 487-495. DOI:10.1007/s10815-013-9938-8 |
| [14] |
Zhang J, Yao D, Zhang J, et al. TGF-β mediates thoracic radiation-induced abscopal effects of testis injury in rat[J]. Biochem Biophys Res Commun, 2019, 514(3): 678-683. DOI:10.1016/j.bbrc.2019.05.016 |
| [15] |
You X, Chen Q, Yuan D, et al. Common markers of testicular Sertoli cells[J]. Expert Rev Mol Diagn, 2021, 21(6): 613-626. DOI:10.1080/14737159.2021.1924060 |
| [16] |
Cardoso HJ, Figueira MI, Correia S, et al. The SCF/c-KIT system in the male: Survival strategies in fertility and cancer[J]. Mol Reprod Dev, 2014, 81(12): 1064-1079. DOI:10.1002/mrd.22430 |
| [17] |
Parekh PA, Garcia TX, Hofmann MC. Regulation of GDNF expression in Sertoli cells[J]. Reproduction, 2019, 157(3): R95-R107. DOI:10.1530/REP-18-0239 |
 2022, Vol. 42
2022, Vol. 42


