2. 中国人民解放军军事科学院军事医学研究院生命组学研究所,北京 100850;
3. 解放军第307临床学院(解放军总医院第五医学中心),北京 100071;
4. 河北大学生命科学学院,保定 071028
2. Beijing Institute of Lifeomics, Academy of Military Medical Sciences, Academy of Military Sciences, Beijing 100850, China;
3. The Fifth Medical Center, General Hospital of PLA, Beijing 100071, China;
4. School of Life Sciences, Hebei University, Baoding 071028, China
电离辐射对生物体的影响是多方面和破坏性的。辐射可导致线粒体膜通透性受损、ATP合成障碍、Ca2+渗入线粒体基质以及线粒体电位降低[1]。受损线粒体可导致细胞活性氧(reactive oxygen species,ROS)水平增加[2],异常升高的ROS可导致造血干/祖细胞(hematopoietic stem and progenitor cells,HSPCs)干性丢失及细胞凋亡,产生衰老表型[3]。骨髓是电离辐射最敏感的器官,高剂量电离辐射可引起骨髓衰竭,全血细胞减少,HSPCs功能下降。但是,目前对暴露于辐射后HSPCs中线粒体结构、功能以及呼吸代谢变化特点尚不清楚。Seahorse XF分析动态仪是分析细胞氧化磷酸化水平以及线粒体呼吸能力的有效工具,已广泛应用于肿瘤等疾病研究。本研究通过对ROS、线粒体结构及氧化磷酸化状态的检测,分析HSPCs受照后线粒体变化特点,为深入探索线粒体在受照条件下对HSPCs的作用奠定基础。
材料与方法1. 实验动物及受照条件:C57BL/6J雄性小鼠(SPF级),购自北京斯贝福生物技术有限公司,实验动物许可证号:SCXK(京)2019-0010。饲养在军事医学研究院SPF级实验动物中心,合格证号: SYXK(军)2012-0065。实验小鼠8周龄,体重20~23 g。48只小鼠按随机数表法分为对照组(0 Gy组)、全身60Co单次照射1 Gy组和4.5 Gy组,每组16只,剂量率为61.28 cGy/min。c-Kit+细胞对照组不接受照射,照射组接受15 Gy单次60Co照射后培养24 h检测,剂量率为61.68 cGy/min。照射前(0 h)和照射后6、12、24 h分别取尾静脉血10 μl,置于2 ml稀释液中混匀,后进行血常规检测。
2. 主要试剂与仪器:c-Kit+细胞分选试剂盒、M3434培养基购自加拿大Stemcell公司;红细胞裂解液购自深圳达科为公司;Lin-细胞分选试剂盒购自美国BioLegend公司;ROS检测试剂盒和线粒体膜电位(JC-1)检测试剂盒购自大连美仑生物技术有限公司;葡萄糖、丙酮酸钠、L-谷氨酰胺、羰基-氰-对-三氟甲氧基苯肼(FCCP)、鱼藤酮(Rotenone)购自美国Sigma公司;Mitotracker Red染液购自美国Invitrogen公司;Cell-TakTM细胞组织黏合剂购自美国Corning公司;FVS 510,Sca1 BV605,c-Kit PE,c-Kit APC,CD150 BV421,CD48 FITC,生物素偶联抗体Gr1、CD11b、Ter119、CD4、CD8、B220,APC-H7-生物素-链霉亲和素偶联抗体均购自美国BioLegend公司;寡霉素(Oligomycin)、抗霉素A(Antimycin A)购自英国Abcam公司。Seahorse XFe96细胞代谢呼吸动态分析仪(美国安捷伦公司);流式细胞仪(BD LSRFortessaTM,美国);全自动血液细胞分析仪(Nihon Konden Celltac E,日本);荧光共聚焦显微镜(ANDOR Dragonfly200,英国)。倒置相差显微镜及成像系统(Olympus,日本)。
3. 骨髓细胞的制备:取小鼠两侧股骨和胫骨,用磷酸盐缓冲液(PBS)冲出骨髓,离心收集细胞。加入红细胞裂解液,室温孵育5 min,再次离心收集细胞,经45 μm细胞筛过滤后,制成单细胞悬液。按照试剂盒说明书操作步骤,分选骨髓Lin-细胞和c-Kit+细胞。LSK细胞先通过磁珠分选Lin-细胞,然后流式分选Lin-Sca-1+c-Kit+细胞。
4. ROS检测:在5×106细胞悬液中加入10 μmol/L的DCFH-DA装载探针,37℃、5% CO2避光孵育30 min,用无血清培养液洗涤细胞3次。300 μl PBS重悬,上机检测,流式检测使用FITC通道。
5. 骨髓细胞集落形成能力检测:将1.5×104个骨髓细胞加入500 μl M3434培养液并接种到细胞孔中。37℃、5% CO2培养箱培养10 d,倒置显微镜下观察集落形成情况。细胞数≥50为阳性集落。
6. 线粒体膜电位(JC-1)检测:配制JC-1染色工作液,将5×106细胞悬液重悬于其中。37℃、5% CO2避光孵育20 min,再用已冰浴的JC-1染色缓冲液洗涤两次。最后用350 μl JC-1染色缓冲液重悬,上机检测,流式检测使用FITC和Percp通道。
7. 细胞能量代谢检测:检测细胞外氧气消耗速率(oxygen consumption rate, OCR)。按照Seahorse XFe96细胞代谢分析仪操作步骤进行,葡萄糖、谷氨酰胺和丙酮酸钠的使用浓度分别为1、2、10 mmol/L,pH为7.40±0.05。线粒体压力测试分别注射2 μmol/L Oligomycin、1.75 μmol/L FCCP、R&A包括1 μmol/L Antimycin A和1 μmol/L Rotenone。实验结果按照Seahorse提供的数据计算线粒体压力测试相关指标.。
8. 线粒体结构检测:终浓度为500 nmol/L的Mitotracker Red染液重悬细胞,37℃避光孵育25 min。加入Hoechst33342,避光孵育5 min。取出细胞甩片,4%多聚甲醛固定。使用50%甘油封片,荧光共聚焦显微镜观察。
9. 统计学处理:流式图采用FlowJo软件分析,实验数据采用Graphpad 7.0软件处理和图形绘制,计量资料采用x±s表示,组间比较采用双侧t检验。P < 0.05为差异有统计学意义。
结果1. 受照小鼠外周血的全血细胞数量减少:小鼠在照射后,白细胞数量、血红蛋白均显著减少(t=3.20~20.25,P < 0.05),并呈照射剂量依赖与时间相关效应。1 Gy照射后红细胞、血小板数量差异无统计学意义(P>0.05),4.5 Gy照射则导致小鼠红细胞及血小板数量降低(t=4.81、6.62、4.33、6.68,P < 0.05),并呈现时间相关效应,结果示于表 1。
|
|
表 1 小鼠受不同剂量照射后不同时间的外周血细胞计数(x±s) Table 1 Peripheral blood cell counts at different times after different doses of irradiation in mice(x±s) |
2. 受照小鼠骨髓细胞及HSPCs的数量减少,功能降低:结果如图 1所示,与0 Gy组相比,小鼠受照后骨髓细胞数量减少(t=4.04、5.66、9.45、19.43,P < 0.05),集落形成能力显著降低(t=16.27、55.66、17.06、43.75,P < 0.05)。骨髓中Lin-Sca1+c-Kit+ (LSK)的数量均显著降低(t=10.46、11.25、28.72、45.01,P < 0.05),并呈照射剂量与时间效应。而LSKCD48-CD150+(LT-HSC)即HSCs的细胞数在照射后12 h差异无统计学意义(P>0.05),但在照射后24 h,HSCs数量均显著降低(t=5.16、11.55,P < 0.05)。
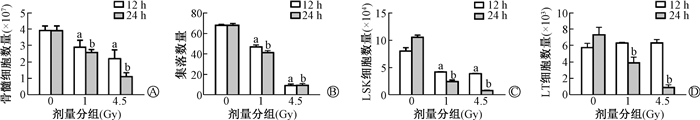
|
注:与同一时间0 Gy组比较,at=4.04、5.66、16.27、55.66、10.46、11.25,bt=9.45、19.43、17.06、43.75、28.72、45.01、5.16、11.55,P < 0.05 A.骨髓细胞;B. 集落;C. LSKs;D. HSCs 图 1 小鼠受不同剂量照射后不同时间骨髓细胞数量的变化 A. Bone marrow cells number; B. Colonies number; C. LSKs number; D. HSCs number Figure 1 Changes of bone marrow cells in mice at different times after different doses of irradiation |
3. 受照小鼠HSPCs中ROS水平变化:结果如图 2所示,4.5 Gy组小鼠在照射后,HSPCs中ROS水平相比于对照组显著增加(t=4.63、4.12,P < 0.05);但1 Gy组小鼠在照射后,HSPCs中ROS水平相比于对照组差异无统计学意义(P>0.05);c-Kit+细胞体外照射后与对照组相比,ROS水平显著增加(t=11.30,P < 0.05)。
|
注:与同一时间0 Gy组比较,at=4.63,bt=4.12、11.30,P < 0.05 A. 小鼠受照后12和24 h HSPCs中的ROS水平;B. c-Kit+细胞体外受照后24 h ROS水平 图 2 不同剂量照射后不同时间HSPCs中ROS水平的变化 A. ROS levels in HSPCs of mice at 12 h and 24 h post irradiation; B. ROS levels of cultured c-Kit+ cells at 24 h post irradiation Figure 2 ROS levels in HSPCs at different times after different doses of irradiation |
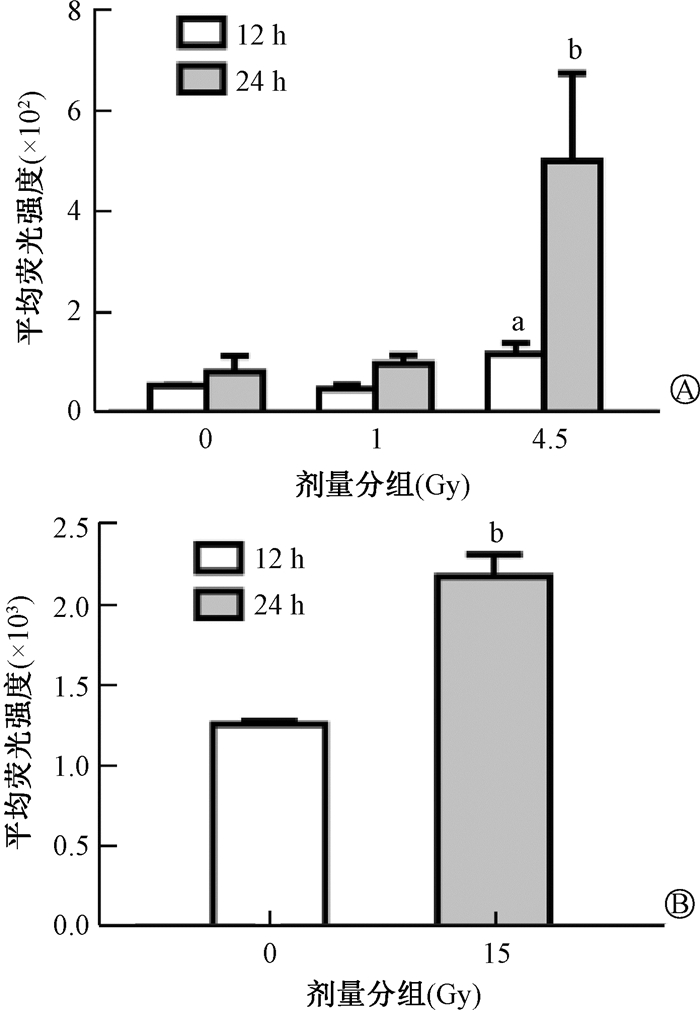
4. 受照小鼠HSPCs中线粒体膜电位变化:结果如图 3所示,与0 Gy组相比,1 Gy组、4.5 Gy组小鼠在照射后HSPCs中线粒体膜电位降低(t=8.82、12.29、9.24、10.46,P < 0.05)。c-Kit+细胞体外照射后,线粒体膜电位显著性降低(t=34.92,P < 0.05)。以上结果表明照射可导致HSPCs线粒体膜电位降低。
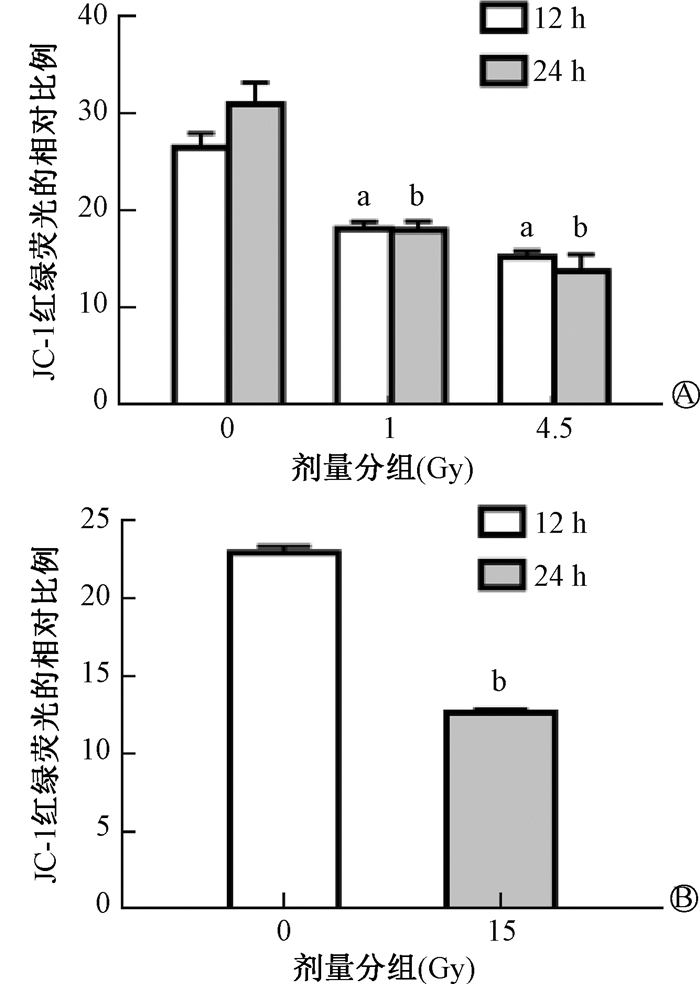
|
注:与同一时间0 Gy组比较,at=8.82、12.29,bt=9.24、10.46、34.92,P < 0.05 A. 小鼠照射后12和24 h c-Kit+细胞的线粒体膜电位;B. c-Kit+细胞体外受照后24 h的线粒体膜电位 图 3 HSPCs受不同剂量照射后线粒体膜电位的变化 A. Mitochondrial membrane potential of c-Kit+ cells from mice at 12 h and 24 h post irradiation; B. Mitochondrial membrane potential of cultured c-Kit+ cells at 24 h post irradiation Figure 3 Mitochondrial membrane potential in HSPCs after irradiation |
5. 受照小鼠HSPCs中线粒体数量改变:采用免疫荧光染色检测小鼠骨髓HSPCs中线粒体数量,结果如图 4所示,不同剂量照射组小鼠在照射后,与0 Gy组相比,HSPCs中线粒体荧光强度均显著降低,表明线粒体数量出现异常。
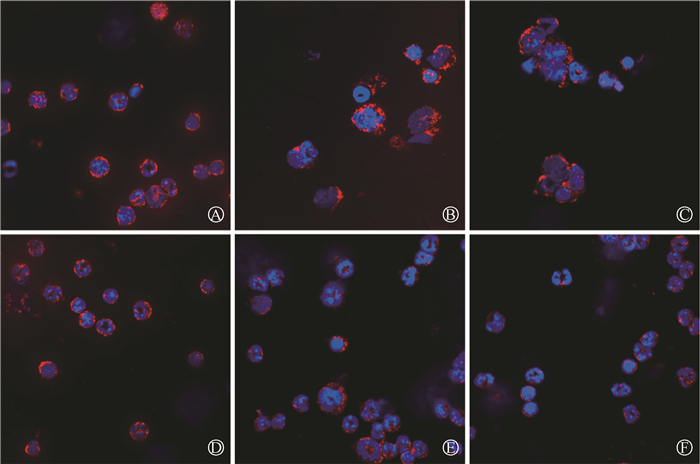
|
注:线粒体用mitotracker red(红色)染色,细胞核用Hoechst33342(蓝色)染色 A.0 Gy组12 h;B.1 Gy照射后12 h;C. 4.5 Gy照射后12 h;D. 0 Gy组24 h;E. 1 Gy照射后24 h;F. 4.5 Gy照射后24 h 图 4 小鼠受不同剂量照射后不同时间HSPCs中线粒体数量的变化 A. Control group at 12 h; B. 1 Gy irradiation group at 12 h; C. 4.5 Gy irradiation group at 12 h; D. Control group at 24 h; E. 1 Gy irradiation group at 24 h; F. 4.5 Gy irradiation group at 24 h Figure 4 Changes in the number of mitochondria in HSPCs of mice at different times after different doses of irradiation |
6. 确定线粒体压力测试条件:分选小鼠骨髓c-Kit+细胞,每孔细胞密度为2 ×105细胞数。随即使用0.2%明胶包被,换液时细胞有脱落,未能检测到正常的细胞呼吸能力。调整包被条件,使用Cell-TakTM细胞组织粘合剂进行包被,细胞状态良好无脱落。进一步采用不同浓度FCCP,在FCCP 2 μmol/L时能检测到最优的最大呼吸和呼吸储备能力,因此确定FCCP 2 μmol/L为最适浓度。结果示于图 5。
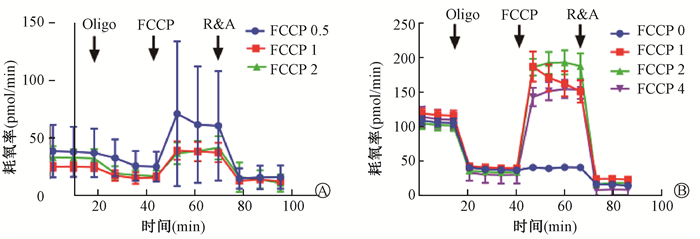
|
注:FCCP 0.5、FCCP 0、FCCP 1、FCCP 2、FCCP 4指FCCP浓度分别为0.5、0、1、2和4 μmol/L A. 0.2%明胶包被;B. Cell-TakTM细胞组织粘合剂包被 图 5 线粒体压力测试条件探索 A. 0.2% gelatin coating; B. Cell-TakTM cell tissue adhesive coating Figure 5 Conditions of mitochondrial stress test |
7. 照射后对小鼠HSPCs线粒体呼吸能力的影响:结果如图 6所示,对各组小鼠照射后12和24 h的HSPCs以及c-Kit+细胞体外15 Gy照射后24 h的OCR进行测定,绘制曲线显示3组细胞均呈现典型的海马曲线。根据细胞线粒体应激实验曲线计算不同组细胞的线粒体基础代谢指数,包括基础呼吸、ATP产生、质子泄漏,线粒体功能包括最大呼吸能力、呼吸储备值。偶联效率是ATP产生与基础呼吸的比率。4.5 Gy组在照射后,HSPCs最大呼吸能力和呼吸储备能力均降低,与0 Gy组相比,差异有统计学意义(t= 7.81、5.78、6.70、5.83,P < 0.05);12 h基础呼吸和氧化磷酸化ATP产能降低(t=8.48、3.80,P < 0.05,);细胞偶联效率与0 Gy组差异无统计学意义(P>0.05)。24 h质子泄漏增高(t=6.57,P < 0.05);偶联效率降低(t=11.43,P < 0.05),与0 Gy组相比,差异有统计学意义。在1 Gy照射后12 h,各项指标差异无统计学意义(P>0.05)。在照射后24 h,HSPCs基础呼吸、最大呼吸能力、呼吸储备能力、氧化磷酸化ATP产能以及质子泄漏提高,与0 Gy组相比,差异有统计学意义(t=4.58、7.36、3.68、3.15、3.15,P < 0.05)。
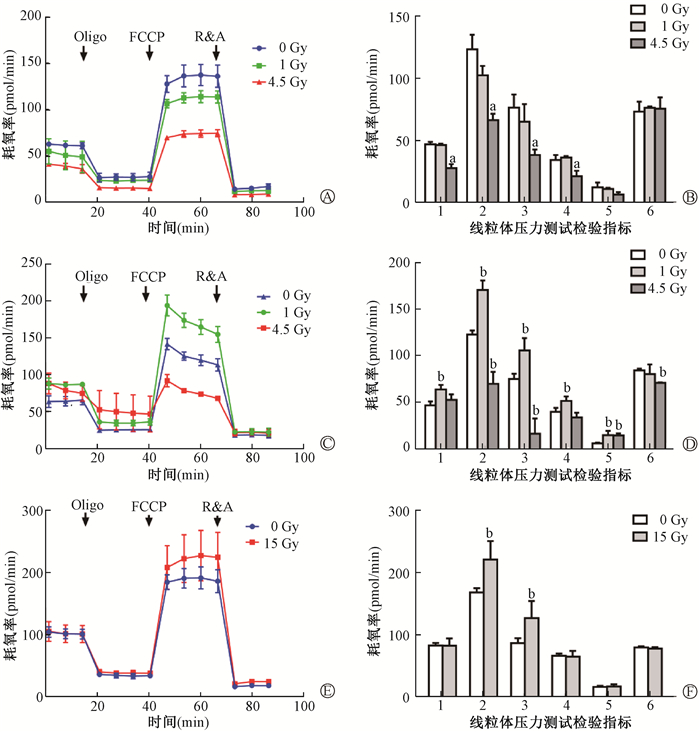
|
注:1.基础呼吸;2.最大呼吸能力;3.呼吸储备能力;4.ATP产生;5.质子泄漏;6.偶联效率。与0 Gy组比较,at= 8.48、7.81、5.78、3.80,bt= 4.58、7.36、6.70、3.68、5.83、3.15、3.15、6.57、11.43、4.25、3.44,P < 0.05 A、B. 小鼠受照后12 h分选的c-Kit+细胞线粒体压力测试的典型海马曲线和OCR定量分析;C、D. 小鼠受照后24 h分选的c-Kit+细胞的典型海马曲线和OCR定量分析;E、F. 体外培养的c-Kit+细胞照射后24 h的典型海马曲线和OCR定量分析 图 6 不同剂量照射后不同时间HSPCs线粒体压力测试实验 A, B. The typical hippocampal curve and OCR quantitative analysis of mitochondrial stress test of c-Kit+ cells sorted 12 h after irradiation in mice, respectively; C, D. The typical hippocampal curve and OCR quantitative analysis of c-Kit+ cells sorted 24 h after irradiation in mice, respectively; E, F. The typical hippocampal curve and OCR quantitative analysis of c-Kit+ cells cultured in vitro 24 h after irradiation Figure 6 Mitochondrial stress analysis of HSPCs at different time after different doses of irradiation |
进一步采用c-Kit+细胞检测HSPCs体外照射后线粒体功能的影响。细胞照射后基础呼吸和氧化磷酸化ATP产能以及偶联效率,与0 Gy组差异无统计学意义(P>0.05),但线粒体最大呼吸和呼吸储备能力增高(t=4.25、3.44,P < 0.05),与1 Gy组照射后24 h结果一致。
讨论线粒体是动态细胞器,可协调许多基本代谢和信号传导过程,通过氧化磷酸化产生大部分能量。HSPCs具有相对大量的线粒体,这些线粒体大多是不活跃的,其功能还未阐明[4-5]。线粒体对HSPCs的调控与活性氧水平有关。HSPCs通过细微调节ROS来感知线粒体健康和活动。HSPCs干性维持被认为可以通过限制线粒体代谢,将ROS控制在低水平,防止HSPCs进行细胞命运决定和细胞分化[6]。
线粒体稳态对于HSPCs功能维持具有重要作用[6],线粒体功能过度和不足都会损害成年人的HSPCs内环境稳定,线粒体生物合成异常会影响HSPCs功能[7]。但在辐射应激下HSPCs中线粒体如何变化尚未明确。本研究显示,受照1 Gy后,HSPCs中ROS的水平无明显差异、线粒体膜电位,线粒体数量降低。照射4.5 Gy后可引起ROS水平上升,线粒体数量、线粒体膜电位降低,这与以往的报道一致[8]。c-Kit+细胞体外经15 Gy剂量照射后,ROS明显增多,膜电位下降。表明受照后伴随HSPCs功能下降,线粒体功能出现异常,提示线粒体稳态可在辐射应激条件下调控HSPCs功能。
近年研究表明,HSPCs不同发育阶段或不同应激情况下,HSPCs能依赖氧化磷酸化来维持其功能[9]。如小鼠胎肝HSPCs氧化磷酸化水平明显升高,而这可能与成体HSPCs有所不同[10]。如在Ptpmt1(一种PTEN样线粒体磷酸酶)丧失后抑制HSPCs中氧化磷酸化活性,损害HSPCs早期分化,导致造血功能缺陷[11]。本研究发现,线粒体呼吸及氧化磷酸化水平在不同剂量照射后呈现不同变化。在照射1 Gy后24 h,HSPCs的线粒体功能、线粒体基础代谢指数增强,可能与1 Gy辐射下诱发HSPCs活化有关。在照射4.5 Gy后,HSPCs的最大呼吸和呼吸储备能力降低,可能与4.5 Gy辐射引起线粒体功能损伤有关。本研究中,1 Gy与4.5 Gy照射后24 h,质子泄漏升高,表明剩余的呼吸与ATP合成无关。c-Kit+细胞体外经15 Gy剂量照射后,最大呼吸和呼吸储备能力增加,这也进一步证实HSPCs中线粒体的变化不依赖骨髓微环境。
综上,本研究在以往对线粒体研究基础上,优化、完善了线粒体结构与功能的评估方法,明确了电离辐射对线粒体功能的影响,为后续研究辐射应激下线粒体代谢调控HSPCs机制奠定基础。
利益冲突 无
作者贡献声明 王琪负责实验和论文撰写;赵珂、高慧英、向慎思指导论文修改;高雅萌、李欣、武云强参与实验操作;朱亚新、吕志春、孙慧颖参与论文修改;李长燕提供研究思路和指导论文修改
| [1] |
Kujoth GC, Hiona A, Pugh TD, et al. Mitochondrial DNA mutations, oxidative stress, and apoptosis in mammalian aging[J]. Science, 2005, 309(5733): 481-484. DOI:10.1126/science.1112125 |
| [2] |
Wardman P. The importance of radiation chemistry to radiation and free radical biology (The 2008 Silvanus Thompson Memorial Lecture)[J]. Br J Radiol, 2009, 82(974): 89-104. DOI:10.1259/bjr/60186130 |
| [3] |
Jang YY, Sharkis SJ. A low level of reactive oxygen species selects for primitive hematopoietic stem cells that may reside in the low-oxygenic niche[J]. Blood, 2007, 110(8): 3056-3063. DOI:10.1182/blood-2007-05-087759 |
| [4] |
Norddahl GL, Pronk CJ, Wahlestedt M, et al. Accumulating mitochondrial DNA mutations drive premature hematopoietic aging phenotypes distinct from physiological stem cell aging[J]. Cell Stem Cell, 2011, 8(5): 499-510. DOI:10.1016/j.stem.2011.03.009 |
| [5] |
Rimmelé P, Liang R, Bigarella CL, et al. Mitochondrial metabolism in hematopoietic stem cells requires functional FOXO3[J]. EMBO Rep, 2015, 16(9): 1164-1176. DOI:10.15252/embr.201439704 |
| [6] |
Filippi MD, Ghaffari S. Mitochondria in the maintenance of hematopoietic stem cells: new perspectives and opportunities[J]. Blood, 2019, 133(18): 1943-1952. DOI:10.1182/blood-2018-10-808873 |
| [7] |
Nakamura-Ishizu A, Ito K, Suda T. Hematopoietic stem cell metabolism during development and aging[J]. Dev Cell, 2020, 54(2): 239-255. DOI:10.1016/j.devcel.2020.06.029 |
| [8] |
Saenko YV, Shutov AM, Rastorgueva EV, et al. The role of mitochondria in the development of radiation-induced oxidative stress in K562 leukemia cells[J]. Bull Exp Biol Med, 2013, 154(5): 631-634. DOI:10.1007/s10517-013-2017-4 |
| [9] |
陈迟琪, 黄丹, 郝晓鑫, 等. 造血干细胞的代谢调控规律[J]. 中国细胞生物学学报, 2019, 41(7): 1252-1261. Chen CQ, Huang D, Hao XX, et al. Metabolic regulations in hematopoietic stem cells[J]. Chin J Cell Biol, 2019, 41(7): 1252-1261. DOI:10.11844/cjcb.2019.07.0004 |
| [10] |
Manesia JK, Xu Z, Broekaert D, et al. Highly proliferative primitive fetal liver hematopoietic stem cells are fueled by oxidative metabolic pathways[J]. Stem Cell Res, 2015, 15(3): 715-721. DOI:10.1016/j.scr.2015.11.001 |
| [11] |
Yu WM, Liu X, Shen J, et al. Metabolic regulation by the mitochondrial phosphatase PTPMT1 is required for hematopoietic stem cell differentiation[J]. Cell Stem Cell, 2013, 12(1): 62-74. DOI:10.1016/j.stem.2012.11.022 |
 2022, Vol. 42
2022, Vol. 42


