随着对恶性肿瘤治疗手段的提高,患者生存期的延长,至少40%的实体肿瘤患者出现脑转移瘤[1-2]。立体定向放射外科(stereotactic radiosurgery,SRS)和立体定向放射治疗(stereotactic radiotherapy,SRT)以其疗程短、生物效应高及对危及器官损伤小等优势成为脑转移瘤首选治疗策略[3]。传统SRS定位采用头部框架固定,因其有创性和不能用于多分次SRT治疗,各种非侵入性的无框架定位系统被应用于SRS/SRT,无框架系统多采用热塑面罩材料,单纯使用其固定强度和稳定性低于SRS的金标准框架固定[4-5],同时SRS/SRT治疗时间较长患者易出现非自主性体位移动。因此,监测运动的影像引导系统逐渐被应用于无框架SRS/SRT。
光学表面监测系统(optical surface monitoring system,OSMS)是近年来应用于临床的一种光学引导放射治疗技术,它是利用可见光斑投射到患者体表,由摄像头获取患者体表光斑经计算机重建形成表面轮廓影像,因此不会对患者造成额外辐射,不仅能辅助治疗前摆位,而且能实时监测患者分次内运动,并能与加速器联动,超过预设误差阈值加速器会产生联锁停止出束[6-7]。本研究的目的是使用头部SRS模体评价OSMS实时监测位置误差的精确性和有效性,应用锥形束CT(CBCT)评估OSMS对Q-Fix开孔面罩固定的头部SRT患者分次内误差的监测精度,以期为临床开展头部无框架SRS/SRT精准放疗技术提供参考。
材料与方法1. 光学表面监测系统OSMS:OSMS采用英国Vision RT公司光学表面监测系统5.1.2版本,其硬件包括安装在加速器治疗床两侧及尾部天花板上的3组摄像机,和放置在治疗室及控制室内的2台显示屏。每组吊顶摄像机有3个镜头:1个投影机镜头,将伪随机散斑图投射到患者体表,提供重建过程所需的纹理变化;2个图像传感器镜头,获取用于3D表面重建的原始纹理数据。运用近距离数字光斑成像法重建体模的三维表面影像,此系统不需要身体表面标记点,且成像过程不产生辐射。该系统每月和每日都需进行校准,月检包括:使用带有点阵的专用校准板校准摄像头的位置和方向,本系统配有高级摄像头优化功能(ACO),还需进行升床10 cm校准;MV等中心校准,使用专用模体将OSMS等中心校准到加速器等中心。日检的作用是按照月检校准数据核对摄像头是否在正确的位置。该系统应用前需要预热10 min,以保证监测信号稳定性。治疗前辅助摆位,静态图像使用3组摄像机获取;对于分次内运动监控,当第3组摄像机被机架遮挡时,至少使用两组摄像机可获得患者表面影像实时运动的偏差,这种偏差在OSMS系统中被称为RTD(real time delta, RTD),整个治疗过程中RTD数据持续记录,并保存在OSMS系统日志文件中。OSMS将参考表面作为标准,参考表面可基于计划CT图像的外轮廓生成,也可基于OSMS采集的图像生成。在参考表面勾画感兴趣区域ROI(region of interest),作为摆位和运动监控区域。系统将实时重建的表面与参考表面进行刚性配准,计算出两者在六维方向(3个平移方向,3个旋转方向)的位置偏差。治疗中门控监测需要在治疗前设定阈值,本研究阈值设定范围在1 mm/1°,即线性平移 > 1 mm或旋转角度 > 1°将停止出束。
2. 使用头部SRS模体验证OSMS治疗中运动监测的精准性:使用头部SRS仿真模体(CIRS)和Edge六维床评估OSMS分次内实时运动监测的准确性,见图 1。模体使用头枕和水化垫固定,德国西门子SOMATOM Definition AS CT机扫描,层厚2 mm,CT图像导入Eclipse治疗计划系统,生成体表轮廓,并创建一个虚拟的治疗计划,选取治疗等中心。将虚拟计划和体表轮廓数据导入OSMS,模体按照CT扫描时的固定方式放置于加速器治疗床上,为防止模体表面反光,面部监测范围使用纸胶布覆盖。使用激光灯等中心摆位,OSMS采集当前位置图像并设置为参考图像,按照临床患者监控的体表范围勾画ROI(包括:眉毛、鼻子、额头和双眼,上界眉骨1~2指上,外界耳屏前,下界鼻孔下缘)。Edge加速器的治疗床为Perfect Pitch六维治疗床,六维床的平移精度0.1 mm,旋转精度0.1°[8]。在加速器Service模式下控制治疗床运动进行如下3个测试:① RTD实时运动监测3个平移方向包括:床左右(X轴)、进出(Y轴)和升降(Z轴),范围从0.0到5.0 mm;3个旋转方向包括:床旋转(rotation, RTN)、进出倾斜(pitch)和左右转动(roll),运动范围从0°到3.0°,并分别以每10秒增加0.2 mm和0.2°的增量移动。②机架和治疗床0°时,六维方向预设偏差随机组合,验证分次内运动监测的精确度(正负表示矢量方向):包括3个平移方向分别为±1、±2、±3、±4和±5 mm;以及3个旋转方向预设±0.5°、±1.0°和±1.5°、±2.0°、±2.5°和±3.0°,分30次在6个方向随机组合偏移,记录OSMS系统显示的监测偏移值。③使用②中30组六维方向随机组合数据,治疗床0°时,大机架在±90°之间每隔15°旋转,记录OSMS监测偏移值;治疗床分别旋转45°、90°、315°和270°,机架在±180°之间每隔15°旋转,记录OSMS监测偏移值,分别评估其中一个摄像头被遮挡以及使用非共面治疗时OSMS的监测精度。

|
图 1 SRS头部仿真模体于等中心摆位 Figure 1 Cranial SRS anthropomorphous phantom setup at the isocenter |
3. 临床资料和CT模拟定位:回顾性选取2021年4月至2021年11月于深圳市人民医院行脑转移瘤放疗的10例患者资料,其中6例有一处转移,4例有2~5处转移,年龄36~75岁,中位年龄49岁,所选病例均采用Q-Fix Encompass开孔面罩固定,该面罩由前后两块热塑面膜形成360°包围,在鼻孔下缘和眉弓之间留有开孔设计,并配有咬合器和垫片设计,咬合器限定下颚的位置,同时也限制头部的转动,尤其是Pitch和Roll方向动作,垫片设计有1~4档位用于调整每个位置的松紧度,定位时需标记好档位,见图 2。模拟定位扫描使用德国西门子公司大孔径螺旋CT,扫描范围从头顶到锁骨下缘,扫描条件为120 kV、410 mAs、层厚2 mm。模拟CT图像经内网传输至美国瓦里安Eclipse放疗计划系统(13.6版本),与磁共振成像(MRI)图像融合配准后勾画肿瘤靶区(GTV),GTV外放3 mm生成计划靶区(PTV)。SRT计划处方30 Gy/5次覆盖95%PTV,计划设计采用共面或非共面3~4容积弧形调强放射治疗(VMAT)计划或9~11野调强放射治疗(IMRT)计划,能量6 MV或6 FFF(flatten-filter free),分别使用最大剂量率为600和1 400 MU/min。所有计划应用Edge加速器执行,其配有高分辨率多叶光栅(high definition multiple leaf collimator, HDMLC),中间8 cm等中心处MLC投影宽度2.5 mm,两侧各7 cm等中心处MLC投影宽度5 mm。

|
图 2 Q-Fix Encompass开口热塑面罩 Figure 2 Q-Fix Encompass open-faced thermoplastic mask |
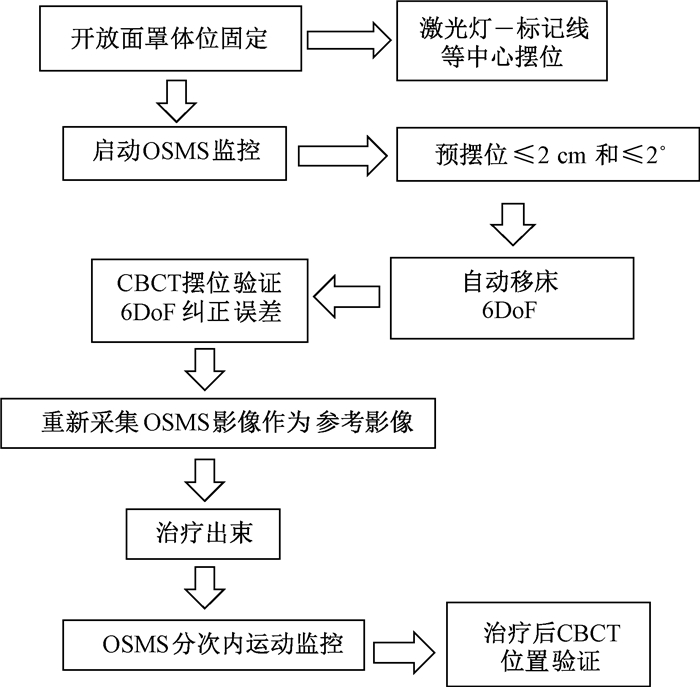
4. SRT治疗摆位及位置验证流程: 患者首次治疗,治疗师辅助患者平躺于加速器治疗床上,按照模拟定位开孔面罩各项参数固定患者,先根据激光线和体表标记等中心摆位。OSMS将实时重建的表面与计划CT参考表面的感兴趣区(ROI)进行配准比较,预摆位使误差平移≤2 cm和旋转≤2°,之后使用自动移床功能使六维方向误差数值均接近0。使用Edge加速器搭载的CBCT影像验证系统,头部扫描使用“全扇面”模式扫描,扫描条件为100 kVp,150 mAs,扫描范围为直径25 cm,长18 cm的圆柱型区域。使用前CBCT系统已使用IsoCal方法校准,保证CBCT等中心在治疗等中心点0.5 mm半径内。完成扫描后CBCT图像与计划CT图像进行骨性自动配准,配准后的摆位误差使用六维床纠正,然后采集OSMS表面影像,作为后续治疗摆位和本次治疗内监控的参考影像(具体流程见图 3)。治疗中OSMS实时监控的RTD数据(六维方向)被保存用于离线回顾性分析。患者治疗后行CBCT扫描,通过与计划CT配准获得六维偏差作为CBCT监测的OSMS联合开孔面罩头部SRT的分次内误差。
|
图 3 SRT治疗位置验证流程图 Figure 3 Position verification flow for SRT procedure |
5. 数据处理:采用Excel 2007和SPSS 19软件进行分析,六维度方向的监测数据使用x±s表示;3D矢量偏差
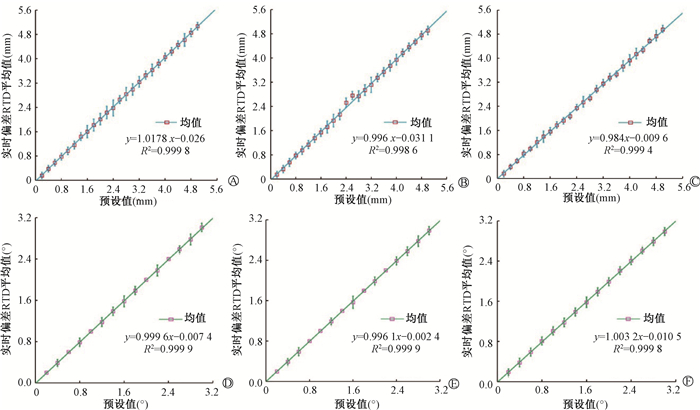
1. 验证OSMS分次内实时运动监测的精确性:头部SRS仿真模体于治疗等中心摆位,物理预设位移和OSMS监测位移之间偏差的线性回归拟合结果(图 4),平移方向增量为0.2 mm,旋转方向增量为0.2°。平移方向x、y和z轴的线性斜率和相关系数分别为1.018 (1.000)、0.996(0.999)和0.984(0.999),旋转方向Pitch、Roll和RTN的线性斜率和相关系数分别为1.000 (1.000)、0.996(1.000)和1.003(1.000)。
|
注:Pitch. 进出倾斜;Roll.左右转动;RTN. 床旋转 A~C.分别为x、y和z轴平移方向;D~F. 分别为Pitch、Roll和RTN方向 图 4 使用头部SRS模体验证物理预设值与OSMS实时监测的线性回归拟合图 A-C. Translational directions for x, y, z axis; D-F. Rotational directions for Pitch, Roll, RTN Figure 4 Linear regression fittings between the physical shifts and OSMS RTO detected shifts using SRS head phantom |
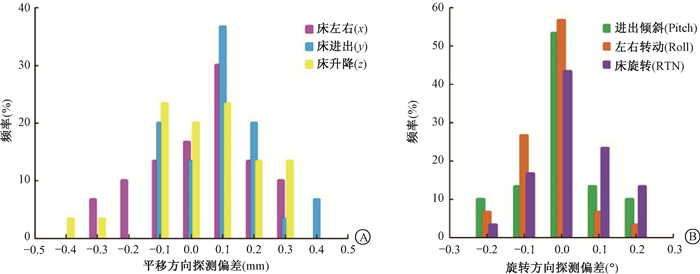
2.验证机架和治疗床0°时OSMS运动监测的精确性:治疗床与机架角度均为0°时,30组六维方向随机组合的预设位移与OSMS探测的偏差在六维方向的分布,见图 5,其中y轴和z轴平移方向偏差相对较大,最大偏差值达0.4 mm;旋转方向最大偏差值为0.2°。
|
A. 平移方向; B. 旋转方向 图 5 床与机架0°时OSMS探测的六维方向偏差的分布频率 (A) and rotational (B) directions Figure 5 Distributions of deviations in six-dimensional directions at 0° between the couch gantry in the translational |
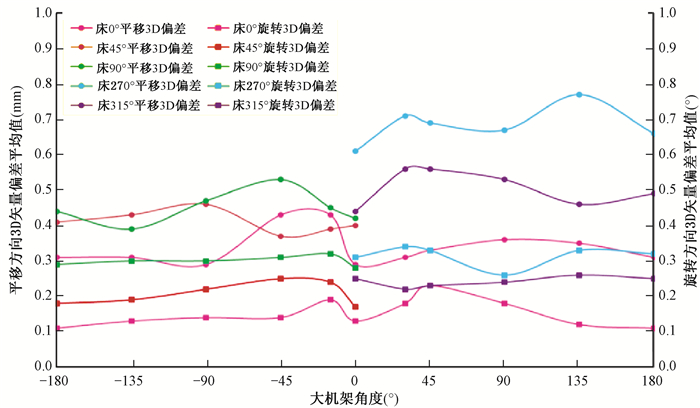
3. 验证OSMS一组摄像头被遮挡以及治疗床非零角度下监测的精确性:使用在线采集重建的图像作为参考表面图像,六维方向预设位移随机组合,图 6显示治疗床分别旋转0°、45°、90°、315°和270°,随着机架旋转角度的不同,OSMS监测的平移方向和旋转方向3D矢量偏差的分布趋势,治疗床和机架角度均为0°时,平移方向3D矢量偏差(0.28±0.10)mm,旋转方向3D矢量偏差(0.15±0.09)°;治疗床转角为270°时OSMS探测的3D矢量偏差最大,平移和旋转方向偏差分别为(0.69±0.19)mm和(0.32±0.12)°;床0°时,机架在±90°之间旋转,即模拟治疗中有一组摄像头被机架遮挡情况,OSMS探测的平移和旋转方向3D矢量偏差分别为(0.35±0.13)mm和(0.17±0.09)°,与3组摄像头采集图像时结果相近,见表 1。
|
图 6 不同床与机架角度OSMS探测的3D矢量偏差的分布趋势 Figure 6 Distribution trend of 3D vector deviations detected suing OSMS at different angles between the couch and gantry |
|
|
表 1 头部SRS模体不同机架和床角度的OSMS探测的3D矢量偏差(x±s) Table 1 3D vector deviations of cranial SRS phantoms detected by OSMS at different angles between the couch and gantry (x±s) |
4. OSMS与CBCT对Q-Fix开孔面罩头部SRT分次内误差监测的比较:分析了7个月10名患者的50个分次的OSMS和CBCT数据,10个无框架Q-Fix开孔面罩固定SRT患者的分次内头部运动幅度,平移方向的3D矢量幅度偏差OSMS与CBCT分别为(0.40±0.26)mm和(0.29±0.10)mm;旋转方向的3D矢量幅度偏差OSMS与CBCT分别为(0.33±0.20)°和(0.26±0.08)°。
讨论OSMS以其不产生电离辐射并可实现分次内实时运动监测的优势,联合开放式面罩应用于头部SRS/SRT中[9-11],为验证OSMS分次内运动检测的精确性,本研究应用端对端头部SRS模体和Edge六维床进行分析,预设的运动范围采用平移方向0到5.0 mm,旋转方向0°到3.0°,设置运动范围的依据:传统SRS头架建立的SRS/SRT摆位精度标准 < 1 mm,目前已报道的无框架面罩固定系统作为侵入性头架固定技术的替代方案摆位精度均 < 5 mm[9-10, 12];并且研究发现预设位移大小与OSMS运动监测精度没有明显相关性,预设位移增大,OSMS监测偏差没有明显增大趋势[13]。
模体研究中,机架和治疗床0°时,本研究显示预设位移与OSMS实时运动监测位移强相关,以及平移和旋转3D矢量偏差值均与Peng等[14]对OSMS位置监测精确性的研究结果一致,其平移3D偏差为(0.2±0.3)mm。治疗床0°时,机架旋转模拟一个摄像机头被机架遮挡情况,本研究结果与Covington等[7]和Mancosu等[13]研究结果一致,OSMS监测偏差有所增加,但数值增加量为亚毫米级。在治疗床非0°时,OSMS实时动态监测偏差值明显大于床0°监测值,考虑到本中心Edge加速器治疗床旋转中心偏差在(0.3~0.5)mm,因此本研究中治疗床旋转中心的偏差可能是OSMS非0床角度监测偏差增加的主要原因。ACO升级前后也会对OSMS非0床角度下的运动监测精度产生影响,Covington等[15]发现ACO升级后OSMS运动监测的平均偏差由升级前的0.79 mm,降为0.57 mm,本研究结果与该研究ACO升级后的结果一致;同时该研究通过与电子射野影像系统(EPID)监测的床旋转中心偏差进行对比,发现ACO升级后,治疗床非0角度OSMS与EPID监测偏差由升级前>1 mm,降低为升级后 < 0.5 mm,ACO升级后,极大提高了0SMS在治疗床非0°下的位置监测精度。本研究发现治疗床在270°时3D矢量偏差值最大,这与Covington等[7]通过对324例SRT治疗中OSMS实时监测运动误差分析的结果相似,该研究将偏差增大归因于摄像机组的几何形状、配置和排列的变化引起的性能差异。虽然本研究与Covington等[7]研究包括了模体和临床数据,但两项研究数据均在单一的OSMS系统上收集,仍需更多研究数据支持以明确是否存在趋势性。
OSMS在端到端头部模体测试中可以实现位置偏差的实时精确监控,但临床应用比模体测试复杂得多,研究发现OSMS在临床患者治疗中不确定的随机噪声幅度达0.4 mm是模体中的2倍,原因可能是受患者局部皮肤表面变形的影响[16]。CBCT是公认的影像引导放射治疗(IGRT)的金标准,为评估OSMS在临床无框架SRS/SRT监测分次内误差的精确性,本研究治疗结束时采集CBCT影像,与模拟CT配准的差异作为CBCT监测的分次内误差[17]。OSMS和CBCT监测的平移和旋转方向3D矢量幅度差异为0.12 mm/0.08°,两者存在微小差异的主要原因在于:①CBCT和OSMS与加速器等中心校准之间不可避免的存在差异。②CBCT常使用组织内部骨性标记配准,稳定且不易变形;而OSMS使用面部有限区域自动配准,且监测精度会受到面部表情变化,以及定位到治疗期间可能出现的体重变化的影响。③这两种IGRT配准算法间存在一定差异和不确定性。④本研究中OSMS监测分次内运动的参考影像是在线获取的表面影像,有研究发现OSMS在线获取的表面影像与模拟定位CT轮廓略有不同[16]。本研究采用在线获取的表面影像,作为OSMS分次内监控的参考影像,是因为参考和验证影像均使用相同的影像模态,系统误差将被抵消;并且当使用摆位验证后在线获取的影像作为参考ROI,CBCT摆位与OSMS摆位之间的偏差将被消除,即排除了摆位误差的干扰。此外,根据TG142报告[18]对SRS/SRT技术影像中心 < 1 mm容差范围的要求,此偏差远远小于OSMS和CBCT的校准精度,因而考虑到统计结果可能不具有临床意义,未对这个差异进行统计学比较。通过与CBCT进行比较,提示OSMS技术具备亚毫米的位移变化实时探测能力,可以精确监测头部运动,OSMS完全可以应用到实际临床治疗中,提高放疗的位置精度使患者获益。
无框架SRS/SRT提高了患者舒适度和依从性,但其固定的强度和稳定性以及分次内误差仍然是临床上最关心的问题。Ramakrishna等[9]研究发现BrainLAB无框架固定系统分次内平均误差为(0.7± 0.5)mm,其中≥1 mm误差约占22%。本研究通过对10名Q-Fix开孔面罩固定的SRS/SRT患者,50个分次的OSMS离线RTD数据进行分析,获得分次内平移和旋转方向3D矢量误差 < 0.5 mm/0.5°,分次内误差较小的主要原因在于Q-Fix开孔面罩增加了口含器配件,限制头部垂直运动的同时也可减少头部旋转运动,加强面罩的固定效果进而显著减少了整个头部的分次内运动;以及本研究使用非共面治疗病例较少,未发现六维度方向>1 mm/1°的分次内误差。但Li等[16]发现无框架SRT治疗中约有2%的时间(包括射束关闭期间)出现>1 mm/1°的分次内误差;Komiyama等[17]通过分析89例应用Q-Fix固定系统HyperArc治疗的分次内误差,也发现X轴和Y轴方向偏差值最大可达1.2 mm和1.6 mm;同时,SRS/SRT治疗中由于PTV外扩边界较小,旋转方向误差达到1°就可导致V95%(95%处方剂量覆盖的靶区体积)明显减小,引起不容忽视的靶区剂量覆盖不足[19]。因此,随着非共面治疗的增加以及SRS/SRT治疗时间相对较长,分次内不自主运动的发生率大大增加[20],提示应用OSMS实时运动监测及射束门控功能,以确保无框架SRS/SRT精准实施是必要的。
综上所述,OSMS是一种无辐射影像引导技术,可以高精度地实现分次内实时运动监测功能,在非共面治疗和一组摄像头被机架遮挡情况下,也可对分次内误差进行亚毫米级监控;与Q-Fix开孔面罩联合应用于头部无框架SRS/SRT患者中,可保证头部SRS/SRT放疗的精确实施。
利益冲突 无
作者贡献声明 高艳负责数据整理分析和论文撰写;梁晓敏、张定、李壮玲负责模体研究数据采集;吴何苟、许雄波、张艳完负责临床数据资料采集;钟鹤立负责总体规划和修改
| [1] |
Kocher M, Soffietti R, Abacioglu U, et al. Adjuvant whole-brain radiotherapy versus observation after radiosurgery or surgical resection of one to three cerebral metastases: results of the EORTC 22952-26001 study[J]. J Clin Oncol, 2011, 29(2): 134-141. DOI:10.1200/JCO.2010.30.1655 |
| [2] |
Mehta MP, Tsao MN, Whelan TJ, et al. The American Society for Therapeutic Radiology and Oncology (ASTRO) evidence-based review of the role of radiosurgery for brain metastases[J]. Int J Radiat Oncol Biol Phys, 2005, 63(1): 37-46. DOI:10.1016/j.ijrobp.2005.05.023 |
| [3] |
Kocher M, Wittig A, Piroth MD, et al. Stereotactic radiosurgery for treatment of brain metastases. A report of the DEGRO working group on stereotactic radiotherapy[J]. Strahlenther Onkol, 2014, 190: 521-532. DOI:10.1007/s00066-014-0648-7 |
| [4] |
Kumar S, Burke K, Nalder C, et al. Treatment accuracy of fractionated stereotactic radiotherapy[J]. Radiother Oncol, 2005, 74(1): 53-59. DOI:10.1016/j.radonc.2004.06.008 |
| [5] |
Verbakel WF, Lagerwaard FJ, Verduin AJ, et al. The accuracy of frameless stereotactic intracranial radiosurgery[J]. Radiother Oncol, 2010, 97(3): 390-394. DOI:10.1016/j.radonc.2010.06.012 |
| [6] |
李俊禹, 于松茂, 周舜, 等. 光学体表监测系统在乳腺癌术后放疗颈胸膜固定中的应用[J]. 中华放射医学与防护杂志, 2020, 40(7): 524-528. Li JY, Yu SM, Zhou S, et al. Application of optical surface monitoring system(OSMS)during postoperative radiotherapy for breast cancer patients immobilized with neck and thorax thermoplastic mask[J]. Chin J Radiol Med Prot, 2020, 40(7): 524-528. DOI:10.3760./cma.j.issn.0254-5098.2020.07.006 |
| [7] |
Covington EL, Stanley DN, Fiveash JB, et al. Surface guided imaging during stereotactic radiosurgery with automated delivery[J]. J Appl Clin Med Phys, 2020, 21(12): 90-95. DOI:10.1002/acm2.13066 |
| [8] |
Schmidhalter D, Fix MK, Wyss M, et al. Evaluation of a new six degrees of freedom couch for radiation therapy[J]. Med Phys, 2013, 40(11): 111710. DOI:10.1118/1.4823789 |
| [9] |
Ramakrishna N, Rosca F, Friesen S, et al. A clinical comparison of patient setup and intra-fraction motion using frame-based radiosurgery versus a frameless image-guided radiosurgery system for intracranial lesions[J]. Radiother Oncol, 2010, 95(1): 109-115. DOI:10.1016/j.radonc.2009.12.030 |
| [10] |
Ohtakara K, Hayashi S, Tanaka H, et al. Clinical comparison of positional accuracy and stability between dedicated versus conventional masks for immobilization in cranial stereotactic radiotherapy using 6-degree-of-freedom image guidance system-integrated platform[J]. Radiother Oncol, 2012, 102(2): 198-205. DOI:10.1016/j.radonc.2011.10.012 |
| [11] |
Wiersma RD, Tomarken SL, Grelewicz Z, et al. Spatial and temporal performance of 3D optical surface imaging for real-time head position tracking[J]. Med Phys, 2013, 40(11): 111712. DOI:10.1118/1.4823757 |
| [12] |
Minniti G, Valeriani M, Clarke E, et al. Fractionated stereotactic radiotherapy for skull base tumors: analysis of treatment accuracy using a stereotactic mask fixation system[J]. Radiat Oncol, 2010, 13(5): 1. DOI:10.1186/1748-717X-5-1 |
| [13] |
Mancosu P, Fogliata A, Stravato A, et al. Accuracy evaluation of the optical surface monitoring system on EDGE linear accelerator in a phantom study[J]. Med Dosim, 2016, 41(2): 173-179. DOI:10.1016/j.meddos.2015.12.003 |
| [14] |
Peng JL, Kahler D, Li JG, et al. Characterization of a real-time surface image guided stereotactic positioning system[J]. Med Phys, 2010, 37(10): 5421-5433. DOI:10.1118/1.3483783 |
| [15] |
Covington EL, Fiveash JB, Wu X, et al. Optical surface guidance for submillimeter monitoring of patient position during frameless stereotactic radiotherapy[J]. J Appl Clin Med Phys, 2019, 20(6): 91-98. DOI:10.1002/acm2.12611 |
| [16] |
Li G, Ballangrud Å, Kuo LC, et al. Motion monitoring for cranial frameless stereotactic radiosurgery using video-based three-dimensional optical surface imaging[J]. Med Phys, 2011, 38(7): 3981-3994. DOI:10.1118/1.3596526 |
| [17] |
Komiyama R, Ohira S, Ueda H, et al. Intra-fractional patient motion when using the Qfix Encompass immobilization system during HyperArc treatment of patients with brain metastases[J]. J Appl Clin Med Phys, 2021, 22(3): 254-260. DOI:10.1002/acm2.13143 |
| [18] |
Klein EE, Hanley J, Bayouth J, et al. Task Group 142 report: quality assurance of medical accelerators[J]. Med Phys, 2009, 36(9): 4197-4212. DOI:10.1118/1.3190392 |
| [19] |
Roper J, Chanyavanich V, Betzel G, et al. Single-isocenter multiple-target stereotactic radiosurgery: risk of compromised coverage[J]. Int J Radiat Oncol Biol Phys, 2015, 93(3): 540-546. DOI:10.1016/j.ijrobp.2015.07.2262 |
| [20] |
Sagawa T, Ohira S, Ueda Y, et al. Dosimetric effect of rotational setup errors in stereotactic radiosurgery with HyperArc for single and multiple brain metastases[J]. J Appl Clin Med Phys, 2019, 20(10): 84-91. DOI:10.1002/acm2.12716 |
 2022, Vol. 42
2022, Vol. 42


