2. 浙江大学医学院附属第一医院放疗科,杭州 310002;
3. 安徽省肿瘤医院放疗科,合肥 230031
2. Department of Radiation Oncology, First Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310002, China;
3. Department of Radiotherapy, Anhui Cancer Hospital, Hefei 230031, China
在放射治疗计划的设计中,由于物理师之间的经验、偏好、习惯等不同以及患者个体化的差异[1-2],计划质量往往参差不齐,因此计划评估显得尤为重要。在计划评估中,通常由物理师根据放疗医生给出的临床目标,选取具有代表性的剂量参考点进行评估,其受放疗中心的规定和物理师主观因素的影响较大。为了使评估方式更加客观,放疗计划打分的方法被广泛研究,现有打分方法都是基于一些给定的剂量-体积直方图(DVH)指标,并赋予一定的权重,从而进行打分,标准相对固定,并未考虑患者个体化的差异[1, 3-7],因此存在片面和不足。
本研究基于调强放射治疗(IMRT)的剂量预测模型,首次提出了一套个性化的放射治疗计划质量的定量评价方法,并在15例直肠癌病例上验证了该计划评价方法在临床放疗计划设计过程中的有效性。本方法通过剂量预测得到患者的DVH指标,并根据其对放疗计划进行打分,考虑了个体化的差异,有利于对物理师制定的计划质量做出更加客观的评估,而且能够通过观察计划的总得分和各器官的得分情况,为物理师提供改进的方向,对计划的制定有指导作用。
材料与方法1.数据获取:从中国科学技术大学附属第一医院选取5年以上从业经验的物理师制定的45例已接受静态调强放射治疗的直肠癌临床病例用于剂量预测模型的训练,另外采用简单随机抽样方法从医院直肠癌病例数据库中随机选取15例已接受静态调强放射治疗的直肠癌临床病例用于测试。成像设备是美国GE公司discovery CT590模拟定位机,选择盆腔部位进行增强CT扫描。两名主治医生参考融合的增强电子计算机体层扫描(CT)图像、核磁共振(MR)图像在平扫CT图像上勾画临床靶体积(CTV)和危及器官(OARs),考虑到器官运动和摆位的不确定性,CTV均匀外扩7 mm形成计划靶体积(PTV)并经主任医师审核确认。治疗射束采用加速器Trilogy 6 MV(美国瓦里安公司)的X射线、5个共面射野,采用DeepPlan治疗计划系统[8-11],该系统由中国科学技术大学医学物理研究所与安徽慧软科技有限公司联合研发,其剂量计算精度已经通过了《调强放射治疗计划系统性能和试验方法》(YY/T 0889-2013)[12]标准测试,目前已经在多家医院投入使用。
靶区处方剂量为50 Gy,分25次照射,V100%≥95%,V107% < 10%,Dmax < 56 Gy。各危及器官的剂量约束为:小肠Dmax < 52 Gy,V50 < 10%;膀胱V50 < 30%;左股骨头V50 < 5%;右股骨头V50 < 5%。其中Vx%为靶区PTV在x%处方剂量以上的体积占其总体积的百分比;Vx为OARs在x Gy以上的体积占其总体积的百分比;Dmax为目标结构的最大剂量。
2. 剂量预测模型的构建:基于之前在放射治疗剂量预测方面的工作[13-14],用本研究中提到的45例直肠癌病例数据训练了一个剂量预测模型。该剂量预测模型基于3D U-Net,输入为一个6×128×128×128的四维矩阵(包括CT矩阵,PTV位置矩阵和4个OARs位置矩阵),输出为预测的三维剂量矩阵。
3. 放疗计划评估方法:临床物理师通常根据感兴趣且具代表性的DVH点进行计划评估,这种评估方法有很强的主观性。为进行客观有效评估,本研究建立了直肠癌的计划质量评估标准。共考虑了临床上所关心的10个指标,每个指标赋予一个特定权重,权重满分为70分,为便于对比,将总得分归一化为满分100分处理(归一化系数为100/70≈1.43)。评估指标包含了若干个剂量学指标和几何学指标如:最大剂量Dmax、剂量-相对体积(V′ x%)、适形性指数(CI)[15]、均匀性指数(HI)[16]等。其中CI=(Vptv, ref·Vptv, ref)/(Vptv·Vref),式中,Vptv, ref为接受剂量等于或大于处方剂量的体积;Vptv为靶区体积,Vref为处方剂量线所包围的体积,cm3。HI=(D2-D98)/Dp,式中D2、D98分别为受照射剂量最高的2%和98%;Dp为处方剂量,在本研究中为50 Gy。CI越接近于1,则靶区适形度越高;HI越接近于0,则靶区剂量均匀性越好。
对于15个用于测试的病例,根据训练好的剂量预测模型生成这些患者的预测剂量分布,统计得到靶区PTV和各个OARs的预测DVH图,最终得到10个评估指标对应的值,对这些值,规定一个合适的区间和权重,在该区间内,该指标的分数根据权重呈线性分布。评估指标、线性区间长度和权重值如表 1所示。对于PTV的D95%和CI,得分计算如式(1)所示:
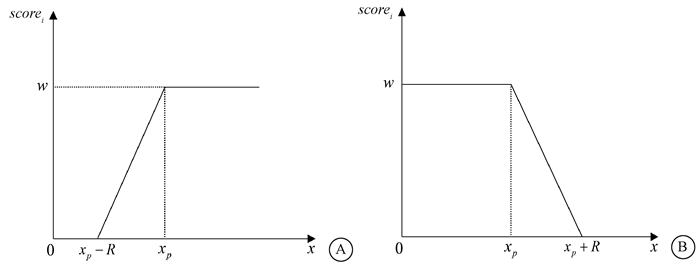
| $ score _{i}=\left\{\begin{array}{c} 0, x<\left(x_{\mathrm{p}}-R\right) \\ w\left(x+R-x_{\mathrm{p}}\right) / R, \left(x_{\mathrm{p}}-R\right) \leq x \leq x_{\mathrm{p}} \\ w, x>x_{\mathrm{p}} \end{array}\right. $ | (1) |
|
|
表 1 直肠癌计划质量评估指标、对应区间和权重 Table 1 Quality evaluation indexes of rectal cancer radiotherapy plans and theirintervals and weights |
对于PTV的Dmax、V107%和HI以及OARs的Dmax以及V50,得分计算如式(2)所示:
| $ score _{i}=\left\{\begin{array}{c} w, x<x_{\mathrm{p}} \\ -w\left(x-R-x_{\mathrm{p}}\right) / R, x_{\mathrm{p}} \leq x \leq\left(x_{\mathrm{p}}+R\right) \\ 0, x>\left(x_{\mathrm{p}}+R\right) \end{array}\right. $ | (2) |
在式(1)和式(2)中,scorei为i指标的得分,w为指标权重,R为线性区间长度,x为指标的真实值,xp为指标的预测值。式(1)和式(2)对应的得分曲线如图 1所示。
|
注:score.总得分;w.指标权重;R.线性区间长度;x.指标的真实值;xp.指标的预测值 A.式(1)对应的得分曲线;B.式(2)对应的得分曲线 图 1 scorei的得分曲线 A. Score curve corresponding to equation(1); B. Score curve corresponding to equation(2) Figure 1 Score curve of scorei |
总得分score的计算如式(3)所示:
| $ score =\sum\limits_{i=1}^{N} score _{i} $ | (3) |
式中,score为总得分,scorei为i指标对应的得分,N为指标个数。
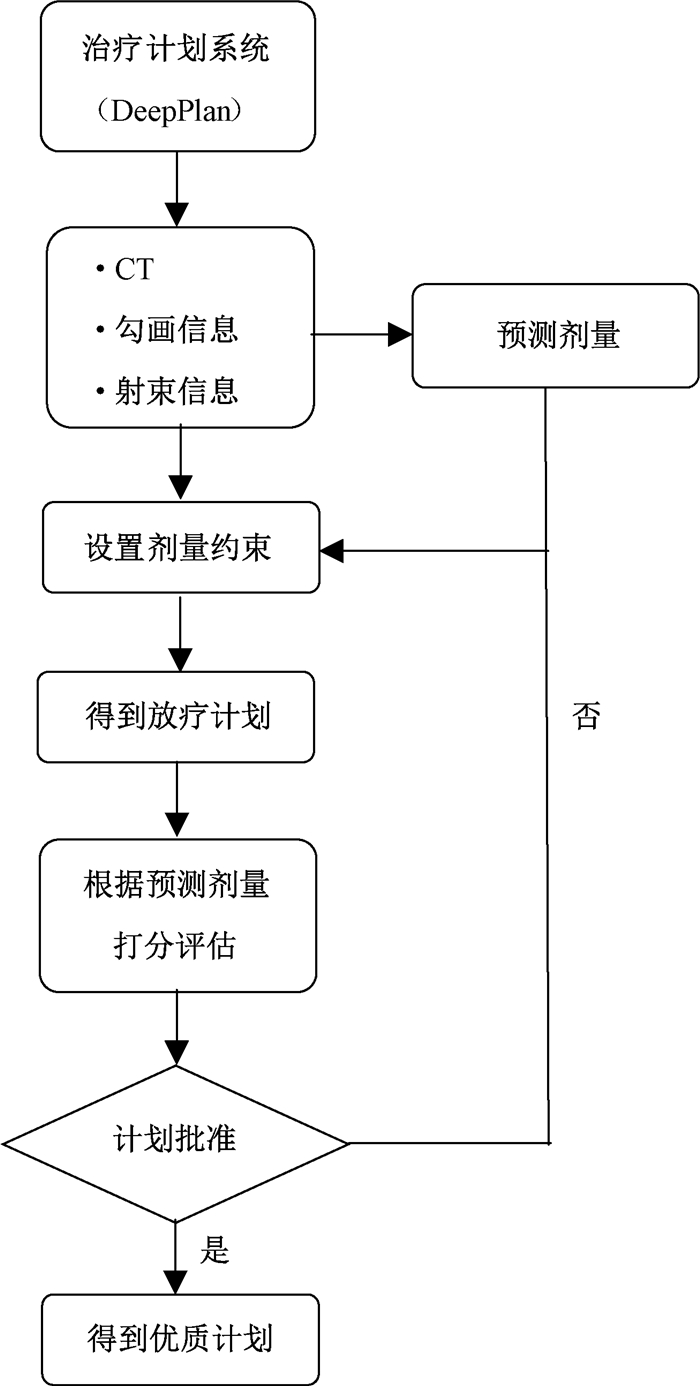
以10个评估指标和计划总分数为指导,用DeepPlan对计划重新进行制定,并打分评估。优化前后计划的约束指标与打分的指标保持一致,以确保计划是由相同的约束指标制定得到,区别只是约束指标对应不同的值。整个流程如图 2所示。比较优化前后计划得分情况以及剂量学参数差异,从而验证该打分方法的临床意义。
|
图 2 放疗计划评估及优化流程 Figure 2 Evaluation and optimization process of a radiotherapy plan |
4.统计学处理:采用SPSS 25.0软件进行分析。计划优化前和优化后组的总得分、靶区得分、OARs得分以及DVH指标和CI、HI, 数据服从正态分布,两组间比较采用配对t检验,数据以x±s形式表示。P < 0.05为差异具有统计学意义。
结果1. 对优化前后的两组计划评分进行对比:统计15例直肠癌病例的得分,优化前计划的得分为(77.21±9.74)分,优化后计划的得分为(88.78±4.92)分,差异具有统计学意义(t=-4.105,P < 0.05),优化后的计划平均得分提高了11.57分。分别对靶区、危及器官和总得分进行统计学分析,靶区优化前的得分为(42.35±5.04)分,优化后的得分为(50.30±4.23)分,差异具有统计学意义(t=-4.683,P < 0.05),优化后的靶区得分有显著提高;小肠和膀胱优化前后的得分有小幅度提高,差异无统计学意义(P>0.05)。
2. 对优化前和优化后的两组计划进行剂量学分析:PTV的剂量学指标统计如表 2所示。PTV的处方剂量在优化前后均满足临床要求。相同射束条件下,根据预测值优化后的PTV的Dmax、V107%、HI均低于优化前,且差异均具有统计学意义(t=2.555~5.771,P < 0.05)。但CI优化前后接近,差异无统计学意义(P>0.05)。
|
|
表 2 15例直肠癌病例放射治疗计划优化前后PTV剂量学指标对比(x±s) Table 2 Comparison of PTV dosimetric indices before and after radiotherapy plan optimization in 15 cases of rectal cancer(x±s) |
OARs的剂量学指标统计如表 3所示。由于左右股骨头的V50为0,且对左右股骨头以及膀胱部位的打分均接近满分,为了更好地对比剂量学上的改变,在表 3中额外统计了对应的Dmax。由表 3可得,与优化前相比,所有危及器官的Dmax在优化后,其平均值上均有不同程度地降低。对于膀胱的Dmax,优化后的值低于优化前的值,且差异具有统计学意义(t=2.346,P < 0.05)。
|
|
表 3 15例直肠癌病例的危及器官剂量学指标对比(x±s) Table 3 Comparison of OARs dosimetric indices in 15 cases of rectal cancer(x±s) |
为更好地对比平均值和标准差,将靶区和所有危及器官的Dmax,以及小肠、膀胱的V50绘制成箱线图,如图 3所示,其中蓝色箱线图代表优化后的结果,绿色箱线图代表优化前的结果。

|
A.靶区和危及器官的Dmax;B.小肠和膀胱的V50 图 3 15例病例优化前和优化后的剂量学指标对比结果 A. Dmax of PTV and OARs; B. V50 of the small intestines and bladders Figure 3 Comparison results of dosimetric indices of 15 cases before and after optimization |
讨论
放射治疗计划评估作为计划制定的最后一步,在整个放疗计划制定中起着至关重要的作用。基于DVH指标的打分方法相比物理师人工评估,更加客观、直观和高效。现有的基于DVH指标的打分方法,如Nelms等[1]建立了一套计划质量标准(PQM)进行量化打分和Ruan等[3]将计划的剂量学参数划分为不同等级用于量化计划质量,以上方法打分标准相对固定,并未考虑患者个体化的差异,存在片面和不足的问题。本研究基于3D U-Net网络预测出直肠癌病例的三维剂量分布,提出结合剂量预测的个性化放疗计划质量评估,与现有同类方法相比,首次考虑了个体化的差异对计划制定的影响,不仅实现了个性化地客观有效评估,尤其是对于非常规病例,例如当靶区和危及器官相对位置很远时,用传统打分标准评估,制定的计划很容易得到很高的分数,因此不会考虑进一步优化计划;若使用该研究提出的个性化打分方法,通过剂量预测得到的DVH指标,能提前预知该病例的上限,这将有利于客观评判不同物理师制定的计划质量,而不受患者个体情况(如靶区、危及器官相对位置分布)的影响,而且能够通过观察计划总得分以及各器官的得分情况,挑选出得分较差的器官,并为物理师提供改进的方向,对计划的制定有指导作用。物理师能够在临床目标与预测值之间进行权衡,更明确地设定约束函数,对于辅助临床物理师制定放疗计划有很大帮助,从而能够减少计划质量的不确定性。
实验结果这表明,优化前的临床计划仍存在一定的优化空间,根据预测的剂量,可以更加明确地约束临床目标,实现计划优化。同时也反映了在制定临床计划时,有必要将左右股骨头及膀胱的Dmax作为约束指标,同时也作为打分指标考虑,这样确保了约束指标和打分指标的一致性。在临床上,部分物理师出于时间因素考虑,做计划时通常不会设置太多的约束指标,本研究为约束指标的设置提供了指导,一定程度上能节约物理师制定计划的时间,使得制定计划更加高效。
此外,优化后的计划在膀胱部位各指标的提升效果显著,这佐证了DeepPlan能更好地保护膀胱组织[17]。在PTV的处方剂量指标D95%上,优化后的计划略低于优化前的计划,但均满足临床目标。这种情况是因为剂量预测得到的D95%值偏低,根据该值优化后导致的,这种情况并非个例,在Kearney等[18]的研究中也表明,部分神经网络的预测剂量在D95%指标上低于临床计划。
作为临床研究,本研究是在剂量预测的基础上进行计划评估的,因此选用了剂量预测的误差小的神经网络结构并且剂量预测模型是基于一些优质的临床计划进行训练的。本研究只考虑了直肠癌的IMRT计划,打分指标也只是参考了中国科学技术大学附属第一医院一家机构做放疗计划时的约束指标。另一方面,打分结果高低只反映了计划的质量好坏,在用于临床时还需考虑计划的复杂程度,这通常与一些加速器的参数,如总的MU值,多叶准直器口径大小等相关。因此,未来本研究的工作将更多聚焦于丰富不同类型的癌症以及考虑更多临床关注的指标,设置更加合理的权重,并分析计划得分和计划复杂度之间的关系,使得这种个性化打分系统更加客观、通用和公平,最终推动个性化打分方法应用到临床治疗。
利益冲突 所有研究者未因进行该研究接受任何不正当职务或利益,在此对研究的独立性和科学性予以保证
作者贡献声明 吴秉志负责研究的设计、实施以及论文的撰写、修改;彭昭、闫永恒、周解平负责数据的收集、处理和分析;徐榭和裴曦负责研究设计、技术指导和论文修改
| [1] |
Nelms BE, Robinson G, Markham J, et al. Variation in external beam treatment plan quality: an inter-institutional study of planners and planning systems[J]. Pract Radiat Oncol, 2012, 2(4): 296-305. DOI:10.1016/j.prro.2011.11.012 |
| [2] |
Moore KL, Schmidt R, Moiseenko V, et al. Quantifying unnecessary normal tissue complication risks due to suboptimal planning: a secondary study of RTOG 0126[J]. Int J Radiat Oncol Biol Phys, 2015, 92(2): 228-235. DOI:10.1016/j.ijrobp.2015.01.046 |
| [3] |
Ruan D, Shao W, Demarco J, et al. Evolving treatment plan quality criteria from institution-specific experience[J]. Med Phys, 2012, 39(5): 2708-2712. DOI:10.1118/1.4704497 |
| [4] |
Hoopes DJ, Johnstone PA, Chapin PS, et al. Practice patterns for peer review in radiation oncology[J]. Pract Radiat Oncol, 2015, 5(1): 32-38. DOI:10.1016/j.prro.2014.04.004 |
| [5] |
Hizam DA, Jong WL, Zin HM, et al. Evaluation of treatment plan quality for head and neck IMRT: a multicenter study[J]. Med Dosim, 2021, 46(3): 310-317. DOI:10.1016/j.meddos.2021.03.003 |
| [6] |
Clarke S, Goodworth J, Westhuyzen J, et al. Software-based evaluation of a class solution for prostate IMRT planning[J]. Rep Pract Oncol Radiother, 2017, 22(6): 441-449. DOI:10.1016/j.rpor.2017.08.001 |
| [7] |
Ventura T, Lopes MD, Ferreira BC, et al. SPIDERplan: a tool to support decision-making in radiation therapy treatment plan assessment[J]. Rep Pract Oncol Radiother, 2016, 21(6): 508-516. DOI:10.1016/j.rpor.2016.07.002 |
| [8] |
Zhang Q, Li X, Wu H, et al. Development of DL-based automatic multi-organ segmentation feature in a new TPS, DeepPlan[J]. Med Phys, 2019, 46(6): E123. |
| [9] |
Ren Q, Pan Y, Xu Y, et al. Development of GPU-based collapsed cone dose calculation in a new TPS, DeepPlan[J]. Med Phys, 2019, 46(6): E159. |
| [10] |
霍万里. 基于笔形束算法的质子剂量计算方法研究及其在放疗计划系统DeepPlan中的应用[D]. 合肥: 中国科学技术大学, 2019. Huo WL. Study and application of proton dose calculation of pencil-beam algorithms for the DeepPlan treatment planning system[D]. Hefei: University of Science and Technology of China, 2019. |
| [11] |
皮一飞. 数字化人体模型开发及其在CT图像自动分割中的应用[D]. 合肥: 中国科学技术大学, 2018. Pi YF. Development of computational human phantoms and applications to automated CT image segmentation[D]. Hefei: University of Science and Technology of China, 2018. |
| [12] |
国家食品药品监督管理局. YY/T 0889-2013调强放射治疗计划系统性能和试验方法[S]. 北京: 中国标准出版社, 2013. China Food and Drug Administration. YY/T 0889-2013 Intensity-modulated radiation treatment planning system-functional performance characteristic and test methods[S]. Beijing: Standards Press of China, 2013. |
| [13] |
闫永恒, 潘茂云, 周解平, 等. 基于三维预测剂量的自调节调强放疗自动计划方法[J]. 中华放射医学与防护杂志, 2021, 41(6): 444-449. Yan YH, Pan MY, Zhou JP, et al. Self-adjustable automatic planning method of intensity modulated radiotherapy based on 3D predicted dose[J]. Chin J Radiol Med Prot, 2021, 41(6): 444-449. DOI:10.3760/cma.j.issn.0254-5098.2021.06.008 |
| [14] |
Zhou J, Peng Z, Song Y, et al. A method of using deep learning to predict three-dimensional dose distributions for intensity‐modulated radiotherapy of rectal cancer[J]. J Appl Clin Med Phys, 2020, 21(5): 26-37. DOI:10.1002/acm2.12849 |
| [15] |
Van't Riet A, Mak AC, Moerland MA, et al. A conformation number to quantify the degree of conformality in brachytherapy and external beam irradiation: application to the prostate[J]. Int J Radiat Oncol Biol Phys, 1997, 37(3): 731-736. DOI:10.1016/S0360-3016(96)00601-3 |
| [16] |
Hodapp N. The ICRU Report 83: prescribing, recording and reporting photon-beam intensity-modulated radiation therapy (IMRT)[J]. Strahlenther Onkol, 2012, 188(1): 97-99. DOI:10.1007/s00066-011-0015-x |
| [17] |
程博, 方诗杰, 任强, 等. DeepPlan系统中快速直接子野优化在临床中的应用研究[J]. 中华放射医学与防护杂志, 2020, 40(12): 938-944. Chen B, Fang SJ, Ren Q, et al. Study on clinical application of the fast direct apeture optimization of DeepPlan treatment planning system[J]. Chin J Radiol Med Prot, 2020, 40(12): 938-944. DOI:10.3760/cma.j.issn.0254-5098.2020.12.008 |
| [18] |
Kearney V, Chan J W, Haaf S, et al. DoseNet: a volumetric dose prediction algorithm using 3D fully-convolutional neural networks[J]. Phys Med Biol, 2018, 63(23): 235022. DOI:10.1088/1361-6560/aaef74 |
 2022, Vol. 42
2022, Vol. 42


