2. 解放军总医院京西医疗区综合内科,北京 100144
2. Jing Xi Medical District PLA Genera Hospital, Beijing 100144, China
结直肠癌是全球第三大癌症,是癌症死亡的第四大原因[1]。术前放化疗是提高结直肠癌患者5年生存率的有效手段,但约有三分之一的结直肠癌患者表现出放射抗性[2]。放射治疗中放射抗性是影响治疗效果的主要原因,探究如何降低肿瘤细胞的放射抗性具有重要意义。miRNAs是一类长度为18~22 bps的非编码RNA, 在细胞增殖、凋亡和肿瘤生长中起调节作用[3]。已有研究表明,miRNA密切参与调控结直肠癌的放射抗性,如miR-885-3p、miR-93-5p分别通过调节DNA损伤修复及细胞凋亡通路调控结直肠癌的放射抗性[4-5],但miRNA参与结直肠癌的放射敏感性调控网络尚未完全揭示。前期研究发现,miR-375-3p已被证明可抑制肿瘤生长、转移和上皮间质转化,从而控制各种癌症的肿瘤进展,包括胃癌[6]、肝癌[7]和食管鳞状细胞癌[8]。然而,关于miR-375在结直肠癌细胞放射抗性调控作用和机制的研究仍然十分缺乏。因此,本研究探讨miR-375-3p表达对结直肠癌细胞放射抗性的调控作用和分子机制,以期探明miR-375-3p在结直肠癌细胞放射抗性中的作用,为增强结直肠癌的放射敏感性提供潜在的分子靶点。
材料与方法1.主要试剂:人结直肠癌细胞系HCT116、HT29为本实验室保存。RPIM1640培养基、DMEM培养基、青霉素和链霉素均购自美国Hyclone公司,胎牛血清购自中国上海依科赛公司。CCK-8试剂盒、AnnexinV-FITC细胞凋亡试剂盒购自日本同仁化学有限公司。细胞周期试剂盒购自天津三箭生物技术公司。Lipofectamine 2000、TRIzol试剂购自美国Invitrogen公司。miRNA茎环法荧光定量试剂盒购自广州锐博生物技术公司。荧光定量PCR试剂盒购自北京聚合美生物科技公司。双荧光素酶报告基因试剂盒购自美国Promega公司。
2.细胞培养:HCT116细胞培养于RPIM1640培养基中,HT29细胞培养于DMEM培养基中。两种培养基均含有10%的胎牛血清和1%的青霉素和链霉素,置于37℃,5% CO2的培养箱中培养。待细胞浓度至80%时,胰酶消化、传代。
3.细胞转染:①miRNA模拟物(抑制剂)转染:将HCT116细胞和HT29细胞胰酶消化,制备单细胞悬液,接种于6孔板中,每孔30万个细胞,接种24 h后按照Lipofectamine 2000说明书要求,将mimics-miR-nc(或inhibitor-miR-nc)、mimics-miR-375-3p(或inhibitor-miR-375-3p)分别转染入结直肠癌细胞,作为miR-nc组(或抑制剂-miR-nc组)、miR-375-3p组(或抑制剂-miR-375-3p组)。于转染后8 h更换完全培养基,48 h后利用qPCR分别检测过表达及敲低情况。②质粒转染:将HCT116细胞胰酶消化,制备单细胞悬液,接种于6孔板中,每孔30万个细胞,每孔加入200 μl jetPRIME®缓冲液和2.5 μg质粒,室温静置10 min后将混合物滴加到6孔板,于转染后8 h更换完全培养基,48 h后收集样品用于后续实验。
4.细胞增殖:取待测的HCT116和HT29细胞,加入胰酶消化后,制备单细胞悬液,接种在96孔板中,1 000个细胞/孔100 μl,置于培养箱内培养。检测时按照CCK-8检测试剂盒说明每孔加入10 μl CCK-8试剂,孵育2 h后,利用酶标仪分别于0、1、2、3、4 d检测吸光度(A450)值。
5.克隆形成实验:分别将转染模拟物或抑制剂48 h后的结直肠癌HCT116细胞经胰酶消化,制备单细胞悬液,接种于6孔板中,每孔1 500个细胞,24 h后以剂量率65.3 cGy/min的60Co γ射线照射,剂量分别为0、1、2、4、6 Gy,待培养12 d后,经甲醇固定30 min以及姬姆萨染液染色2 h,分别计算克隆形成率(PE),即克隆数/接种细胞数×100%,存活分数(SF)即受照细胞PE/对照细胞PE,再根据单击多靶模型拟合细胞存活曲线,并计算SER值。
6.细胞凋亡实验:经胰酶消化收集HCT116和HT29细胞,PBS洗涤,分别用FITC标记的Annexin-V和PI各5 μl对细胞进行双染,室温孵育15 min,经流式细胞仪检测各组细胞的凋亡比例。
7.细胞周期实验:收集待测的HCT116细胞和HT29细胞,PBS洗涤,于70%的乙醇中固定并于-20℃过夜。待16 h后取出样品,按细胞周期试剂盒要求加入PI/RNase染色溶液,经流式细胞仪检测细胞周期分布比例。
8.γ-H2AX焦点(foci)形成点检测:为了明确miR-375-3p对DSBs损伤的影响,用FITC标记的IgG抗体间接标记γ-H2AX分子,并用DAPI对细胞核DNA进行染色,每组样本随机分析200个细胞核计算γ-H2AX foci平均数量。向待测的HCT116细胞和HT29细胞中加入4%多聚甲醛固定10 min,室温破膜30 min,将鼠抗人γ-H2AX单克隆抗体用5% BSA稀释,在4 ℃饱和湿度下孵育过夜。FITC标记的山羊抗小鼠IgG抗体,室温避光孵育2 h。细胞核用DAPI染色8 min,用10 %的甘油进行封片,用共聚焦显微镜拍摄并统计γ-H2AX foci形成点数目。
9.荧光定量PCR:收集待测细胞,PBS洗涤,用TRIzol法提取细胞总RNA,使用茎环法试剂盒合成cDNA, 反应程序为42℃ 60 min,70℃ 10 min。以cDNA为模板,U6为内参,使用2X SYBR Green Mix进行荧光定量PCR检测。PCR反应条件如下:95℃ 10 min(1个循环),95℃ 2 s(40个循环),60℃ 20 s(40个循环),70℃ 10 s(40个循环)。计算Ct值,利用2-△△Ct法计算基因的相对表达量。
10.蛋白质印迹分析(Western blot):收集待测的HCT116细胞和HT29细胞,PBS洗涤,加入RIPA裂解液裂解30 min,用BCA法测定蛋白质浓度。40 μg总蛋白用于SDS-PAGE进行上样,随后将其转移至硝酸纤维素膜上,5%脱脂牛奶封闭1 h,加入相应一抗,4℃孵育过夜,加入二抗,孵育2 h后,曝光、显影,分析蛋白质的相对表达量。
11.双荧光素酶报告基因:通过StarBase v2.0生物信息学网站[9]预测miR-375-3p与RAD51的3′-端非编码区域(3′-UTR)结合位点,分别构建表达RAD51-3′UTR-wt和结合位点突变的RAD51-3′UTR-mu的双荧光素酶报告pmir-GLO载体,分别转入HCT116细胞,8 h后再转染mimics-miR-375-3p,48 h后加入50 μl LAR Ⅱ反应液,加入50 μl终止反应液,在多功能酶标仪SYNERGY-H1检测双荧光素酶的荧光强度,并计算萤火虫荧光素酶荧光强度和海肾荧光素酶荧光强度比值。
12.同源重组(homologous recombination,HR)修复效率检测和非同源末端链接(non-homologous end joining,NHEJ)修复检测:①HR修复效率检测:将DR-GFP报告质粒和与表达核酸内切酶的I-SceI质粒共转染入细胞,转染后16 h转染mimics-miR-375-3p, 转染后60 h GFP+细胞数达到峰值,胰酶消化细胞,流式细胞仪检测GFP+细胞比例。②NHEJ修复效率检测:转染Hind Ⅲ处理的NHEJ-GFP质粒以及p-cherry内参质粒,转染后观察GFP+细胞比例,于转染后48 h达到峰值并收获细胞,流式细胞仪检测GFP+细胞比例,计算GFP荧光强度和p-cherry荧光强度的比值。
13.统计学处理:采用SPSS 22.0软件分析。计量资料符合正态分布,数据以x±s表示,至少重复3次,两组间比较采用独立样本t检验。P < 0.05为差异有统计学意义。
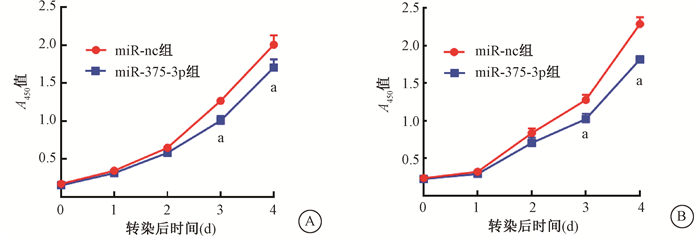
结果1.过表达miR-375-3p抑制结直肠癌细胞的增殖和克隆形成:HCT116细胞和HT29细胞miR-nc组及miR-375-3p组在各时间点A450值均呈上升趋势,但转染后1和2 d两组之间A450值比较,差异无统计学意义(P>0.05),在第3天和第4天miR-375-3p组A450值显著低于miR-nc组,差异有统计学意义(t=8.823、5.632、4.521、13.990,P < 0.05),见图 1,表明过表达miR-375-3p能显著抑制结直肠癌细胞系HCT116、HT29的增殖。克隆形成实验结果显示,结直肠癌细胞HCT116、HT29过表达miR-375-3p后,miR-375-3p组分别为(138±18)和(225 ± 7)个,较miR-nc组(314±17)和(307±24)个显著减少,差异有统计学意义(t=15.129、6.993,P < 0.05)。表明过表达miR-375-3p后结直肠癌细胞克隆形成能力显著下降,见图 2。
|
注:a与同时间miR-nc组比较,t=8.823、5.632、4.521、13.990,P < 0.05 A.HCT116细胞;B. HT29细胞 图 1 两组细胞转染后增殖能力的表达 A. HCT116 cells; B. HT29 cells Figure 1 Expression of proliferative capacity of two groups of cells after transfection |
|
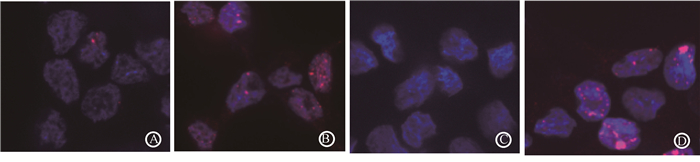
间接免疫荧光染色 ×100 A. HCT116 miR-nc组;B. HCT116 miR-375-3p组;C. HT29 miR-nc组;D. HT29 miR375-3p组 图 2 HCT116及HT29细胞过表达miR-375-3pγ-H2AX foci检测 A.HCT116 miR-nc group; B.HCT116 miR-375-3p group; C. HT29 miR-nc group; D.HT29 miR375-3p group Figure 2 Immunofluorescence staining(×100) of γ-H2AX foci in HCT116 and HT29 cells with or without miR-375-3p overexpression |
2.过表达miR-375-3p诱发细胞凋亡、周期阻滞以及DNA双链断裂(DSBs):结直肠癌细胞Hct116和HT29细胞内过表达miR-375-3p后48 h,miR-375-3p组凋亡率分别为(13.49 ± 0.97)%和(8.92 ± 1.14)%,较miR-nc组(7.85 ± 0.32)%和(5.62± 0.85)%显著增加,差异有统计学意义(t=11.780、4.923,P<0.05)。细胞周期检测结果显示,两种细胞miR-375-3p组G1期较miR-nc组明显增加,差异有统计学意义(t=3.359、3.969,P < 0.05),见表 1。结直肠癌细胞系Hct116、HT29转染miR-375-3p模拟物后48 h,细胞核内γ-H2AX foci平均数量较miR-nc组明显增多,Hct116细胞中分别为(27±3)/200和(11±3)/200个细胞核,HT29细胞中分别为(22±3)/200和(13 ± 2)/200个细胞核,差异有统计学意义(t=13.294、6.867,P<0.05),见图 2。
|
|
表 1 两组不同细胞周期的变化(x±s) Table 1 Changes in the different cell cycles of both groups(x±s) |
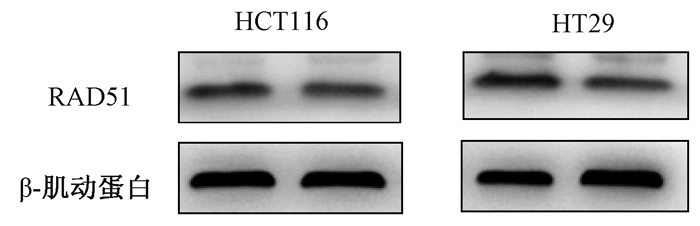
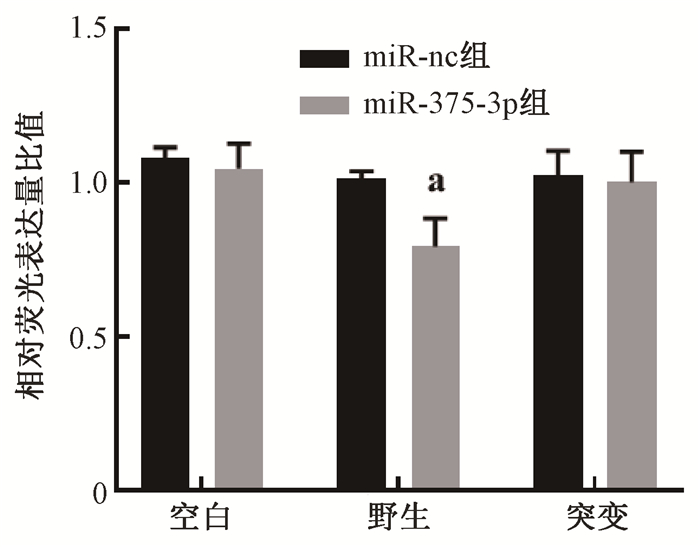
3.miR-375-3p对HR修复效率及RAD51表达的影响:共转染miR-375-3p和DR-GFP/I-SceI后48 h,GFP阳性细胞率较miR-nc组显著降低[miR-375-3p(3.55 ± 0.30)%,miR-nc(1.97 ± 0.15)%,t=10.055,P<0.05],阳性对照组(siRNA-RAD51)低至2.42%;而miR-375-3p对NHEJ修复效率无明显影响。进一步研究发现,过表达miR-375-3p后修复因子RAD51表达水平均出现了显著下调,见图 3。通过公共数据库检索,分析了miR-375-3p分子基因序列和RAD51 mRNA 3'-UTR区存在潜在结合位点。转染入HCT116细胞后,能抑制pmir-GLO-RAD513'-UTR-wt转染组荧光素酶活性(t=5.013, P<0.05),见图 4,而miR-375-3p结合位点突变后[即pmir-GLO-RAD51 3′UTR-mu(miR-375-3p)转染组],能逆转结直肠癌细胞中荧光强度。
|
图 3 过表达miR-375-3p后HCT116细胞及HT29细胞RAD51蛋白变化 Figure 3 Changes in RAD51 protein in HCT116 cells and HT29 overexpression of miR-375-3p |
|
注:a与miR-nc组比较,t=5.013,P<0.05 图 4 两组HCT116细胞过表达miR-375-3p后荧光强度表达 Figure 4 Fluorescence intensity of fireflies and sea kidneys after overexpression of miR-375-3p in HCT116 cells |
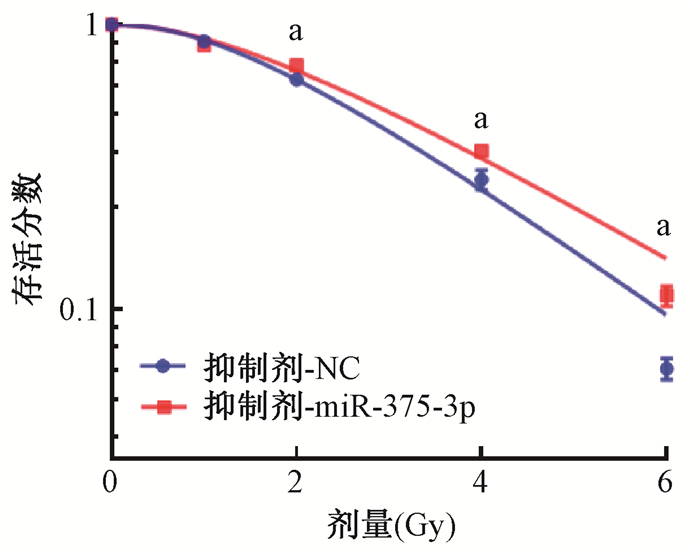
4. 辐射诱导miR-375-3p表达对结直肠癌细胞放射抗性的影响:miR-375-3p在2、6 Gy照射后48 h,表达水平分别为0 Gy时的2.8和3.8倍(t=9.714、8.886,P < 0.05);采用miR-375-3p抑制剂转染细胞后对细胞进行1、2、4、6 Gy不同剂量照射,抑制剂-miR-375-3p组较抑制剂-nc组克隆形成率明显增加,表明抑制miR-375-3p表达的结直肠癌细胞克隆形成能力显著增强,差异有统计学意义(t=6.460、5.619、10.150,P<0.05)。根据单击多靶模型拟合细胞存活曲线,并计算增敏比SER值为1.036,见图 5,表明抑制miR-375-3p表达后增强了结直肠癌细胞的辐射抗性。
|
注:a与抑制剂-nc组比较,t=6.460、5.619、10.150,P<0.05 图 5 抑制miR-375-3p增强HCT116细胞照射后存活分数 Figure 5 Inhibition of miR-375-3p enhances the survival fraction of HCT116 cells after irradiation |
讨论
相当多的结直肠癌患者在确诊时已为中晚期,导致手术受限或预后极差[10]。目前,手术辅助放疗可有效提高保肛率,降低局部复发的风险和肿瘤转移,提高患者的生活质量,延长生存期[11]。但放疗抵抗一直是结直肠癌治疗过程中的主要困难,如何增强结直肠癌患者的放疗敏感性是目前结直肠癌治疗面临的难题,因此,其放射敏感性的机制研究尤为重要。
microRNA(miRNA)是一类内源性调控功能的非编码RNA,越来越多的研究表明,miRNA密切参与调控结直肠癌细胞的放射敏感性,如miR-145通过负向调节上皮间质转化,拮抗SNAI1介导的结直肠癌放射抗性[12];miR-149能够直接抑制人类附睾蛋白4的表达促使结直肠癌对放射敏感[13]。miR-375在人结直肠癌组织中与正常人结直肠组织(包括几种结直肠癌细胞系)相比显著下调,其表达可以抑制结直肠癌细胞的增殖能力[14],抑制迁移和侵袭[15]。最近对45例放射治疗前结直肠肿瘤进行了miRNA和mRNA表达谱的综合分析发现,miR-375和靶向c-Myc有作为局部晚期结直肠癌患者对辅助放疗反应的预测性生物标志物的潜质[16]。可见,miR-375在结直肠癌生长中发挥着重要作用,但关于miR-375对结直肠癌细胞放射抗性调控及其机制尚不十分清楚。
本研究通过miR-375-3p在结直肠癌HCT116和HT29中的过表达,探讨了miR-375-3p表达对结直肠癌细胞凋亡、增殖、周期的影响,发现其表达显著抑制了结直肠癌细胞的增殖及克隆形成能力,并能诱发结直肠癌细胞的G1期周期阻滞,这与Mao等[14]的研究报道一致,miR-375可以通过调节KLF4 mRNA的3′UTR区域,从而抑制结直肠癌细胞的增殖。表明miR-375-3p在结直肠癌细胞生长、增殖及存活中发挥着重要的调控作用。
|
|
表 2 两组不同剂量照射后克隆形率的变化(x±s) Table 2 Expression of clonogenic ability after irradiation at different doses in both groups(x±s) |
在探究miR-375-3p表达与放射抗性的关系时,本研究发现,在利用60Co γ射线2、6 Gy照射结直肠癌细胞系HCT116后,miR-375-3p表达水平均出现显著上调。在不同剂量(1、2、4、6 Gy)照射结直肠癌细胞系HCT116后,抑制miR-375-3p表达结直肠癌细胞的克隆形成率被显著增加,表明miR-375-3p表达下调能够显著增强结直肠癌细胞的放射抗性。DNA双链断裂是电离辐射诱发的重要生物学效应,DNA损伤修复是影响癌细胞放射敏感性的重要因素[17],对miR-375-3p与DSBs及DNA损伤修复通路关系开展研究,发现在结直肠癌细胞系HCT116、HT29中过表达miR-375-3p,DSBs损伤标志分子γ-H2AX表达显著增加,γ-H2AX foci位点数量也显著增多,通过生物信息学预测以及双荧光素酶报告基因实验证实miR-375-3p能够通过靶向RAD51的3′UTR区域,抑制RAD51的表达,显著下调HR修复通路。RAD51是一种在HR修复通路中执行关键步骤的重组酶,密切参与调控包括结直肠癌等多种癌症细胞的辐射抗性[18-19]。miR-375-3p可能通过抑制Rad51表达降低HR修复效率来增加结直肠癌细胞放射敏感性。
综上所述,本实验结果发现miR-375-3p密切参与结直肠癌细胞生长、增殖及存活的调控,并在结直肠癌的放射抵抗机制中发挥着重要作用,其在结直肠癌细胞放射过程中被上调,可能通过抑制Rad51表达降低HR修复效率来增加结直肠癌细胞放射敏感性,为临床提高结直肠癌放射治疗提供了一个重要的线索和靶点。
利益冲突 所有作者共同认可文章内容,不涉及相关利益冲突
作者贡献声明 李长泳负责实验实施、数据汇总、论文撰写;贾萌参与实验实施;王琪、彦林军协助数据分析整理;王治东协助论文修改;戚振华负责实验设计及论文修改
| [1] |
Mármol I, Sánchez-de-Diego C, Pradilla Dieste A, et al. Colorectal carcinoma: a general overview and future perspectives in colorectal cancer[J]. Int J Mol Sci, 2017, 18(1): 197. DOI:10.3390/ijms18010197 |
| [2] |
Wang D, Jiao C, Zhu Y, et al. Activation of CXCL12/CXCR4 renders colorectal cancer cells less sensitive to radiotherapy via up-regulating the expression of survivin[J]. Exp Biol Med (Maywood), 2017, 242(4): 429-435. DOI:10.1177/1535370216675068 |
| [3] |
Thomson DW, Dinger ME. Endogenous microRNA sponges: evidence and controversy[J]. Nat Rev Genet, 2016, 17(5): 272-283. DOI:10.1038/nrg.2016.20 |
| [4] |
李全营, 吴大鹏, 顾浩, 等. miR-885-3p靶向AKT1对结直肠癌细胞HT-29放射敏感性的影响[J]. 中华放射医学与防护杂志, 2018, 38(12): 899-906. Li QY, Wu DP, Gu H, et al. miR-885-3p targeting AKT1 on colorectal cancer cells HT-29 radiosensitivity shadow[J]. Chin J Radiat Med Prot, 2018, 38(12): 899-906. DOI:10.3760/cma.j.issn.0254-5098.2018.12.003 |
| [5] |
张艳. miR-93-5p对直肠癌细胞增殖、克隆能力的影响及与放疗敏感性关系的研究[D]. 合肥: 安徽医科大学, 2019. Zhang Y. Effect of miR-93-5p on the proliferation and clonogenic ability of rectal cancercells and the relationship with radiotherapy sensitivity[D]. Hefei: Anhui Medical University, 2019. |
| [6] |
Ding L, Xu Y, Zhang W, et al. MiR-375 frequently downregulated in gastric cancer inhibits cell proliferation by targeting JAK2[J]. Cell Res, 2010, 20(7): 784-793. DOI:10.1038/cr.2010.79 |
| [7] |
Chang Y, Yan W, He X, et al. miR-375 inhibits autophagy and reduces viability of hepatocellular carcinoma cells under hypoxic conditions[J]. Gastroenterology, 2012, 143(1): 177-187. DOI:10.1053/j.gastro.2012.04.009 |
| [8] |
Kong KL, Kwong DL, Chan TH, et al. MicroRNA-375 inhibits tumour growth and metastasis in oesophageal squamous cell carcinoma through repressing insulin-like growth factor 1 receptor[J]. Gut, 2012, 61(1): 33-42. DOI:10.1136/gutjnl-2011-300178 |
| [9] |
Li JH, Liu S, Zhou H, et al. StarBase v2.0: decoding miRNA-ceRNA, miRNA-ncRNA and protein-RNA interaction networks from large-scale CLIP-Seq data[J]. Nucleic Acids Res, 2014, 42(Database issue): D92-97. DOI:10.1093/nar/gkt1248 |
| [10] |
Ji D, Zhan T, Li M, et al. Enhancement of sensitivity to chemo/radiation therapy by using miR-15b against DCLK1 in colorectal cancer[J]. Stem Cell Reports, 2018, 11(6): 1506-1522. DOI:10.1016/j.stemcr.2018.10.015 |
| [11] |
Guan X, Jiang Z, Ma T, et al. Radiotherapy dose led to a substantial prolongation of survival in patients with locally advanced rectosigmoid junction cancer: a large population based study[J]. Oncotarget, 2016, 7(19): 28408-28419. DOI:10.18632/oncotarget.8630 |
| [12] |
Zhu Y, Wang C, Becker SA, et al. miR-145 antagonizes SNAI1-mediated stemness and radiation resistance in colorectal cancer[J]. Mol Ther, 2018, 26(3): 744-754. DOI:10.1016/j.ymthe.2017.12.023 |
| [13] |
Shi LP, Guo HL, Su YB, et al. MicroRNA-149 sensitizes colorectal cancer to radiotherapy by downregulating human epididymis protein 4[J]. Am J Cancer Res, 2018, 8(1): 30-38. |
| [14] |
Mao Q, Quan T, Luo B, et al. MiR-375 targets KLF4 and impacts the proliferation of colorectal carcinoma[J]. Tumour Biol, 2016, 37(1): 463-471. DOI:10.1007/s13277-015-3809-0 |
| [15] |
Cui F, Wang S, Lao I, et al. miR-375 inhibits the invasion and metastasis of colorectal cancer via targeting SP1 and regulating EMT-associated genes[J]. Oncol Rep, 2016, 36(1): 487-493. DOI:10.3892/or.2016.4834 |
| [16] |
Conde-Muiño R, Cano C, Sánchez-Martín V, et al. Preoperative chemoradiotherapy for rectal cancer: the sensitizer role of the association between miR-375 and c-Myc[J]. Oncotarget, 2017, 8(47): 82294-82302. DOI:10.18632/oncotarget.19393 |
| [17] |
Huang RX, Zhou PK. DNA damage response signaling pathways and targets for radiotherapy sensitization in cancer[J]. Signal Transduct Target Ther, 2020, 5(1): 60. DOI:10.1038/s41392-020-0150-x |
| [18] |
Zhao Y, Chen S. Targeting DNA double-strand break (DSB) repair to counteract tumor radioresistance[J]. Curr Drug Targets, 2019, 20(9): 891-902. DOI:10.2174/1389450120666190222181857 |
| [19] |
Zhong X, Luo G, Zhou X, et al. Rad51 in regulating the radiosensitivity of non-small cell lung cancer with different epidermal growth factor receptor mutation status[J]. Thorac Cancer, 2016, 7(1): 50-60. DOI:10.1111/1759-7714.12274 |
 2022, Vol. 42
2022, Vol. 42


