铀(Uranium, U)是一种天然存在于地壳中的放射性重金属,作为核工业中重要原料广泛用于核燃料的生产,其副产物贫铀在军事和工业领域亦有广泛应用,一旦发生意外事故或造成环境污染,进入人体可造成健康危害[1-2]。天然铀和贫铀主要以化学毒性为主,肾脏是铀毒性的主要靶器官,肾近端小管上皮细胞是铀致肾毒性的主要靶细胞[3]。研究已证实,铀诱导不同类型细胞包括肾细胞线粒体氧化呼吸链紊乱致氧自由基(Reactive Oxygen Species,ROS)爆发是其主要的毒性机制[4-5],因此邻近线粒体的溶酶体成为ROS攻击的直接靶标,而且溶酶体对ROS高度敏感,易于遭受氧化应激损伤而导致溶酶体膜通透性增高即溶酶体膜通透化(lysosomal membrane permeability, LMP),但铀诱导的ROS能否引起肾近端小管上皮细胞LMP及其在铀诱导细胞死亡如溶酶体依赖性细胞死亡(lysosome-dependent cell death, LDCD)及凋亡中的作用尚不清楚。本研究拟采用体外试验探究铀暴露对人肾近端小管上皮HK-2细胞溶酶体膜损伤及其所致细胞死亡的作用及机制,以期阐明铀暴露诱导肾近端小管上皮细胞死亡的新方式,为铀解毒促排剂的研发提供新的启示。
材料与方法1.主要试剂:DMEM/F12培养基购自美国Hyclone公司,胎牛血清、青-链霉素溶液及含乙二胺四乙酸(EDTA)的0.25%胰酶均购自美国GIBCO公司,醋酸铀酰购自美国Chem-Impex公司,ROS试剂盒购自上海碧云天公司,MitoSOX荧光探针试剂盒购自上海翌圣生物科技公司,兔源Galectin-1抗体、鼠源LAMP-1抗体和兔源Cleaved-caspase-3抗体均购自美国CST公司,兔源Cathepsin B抗体购自杭州华安生物公司,Alexa fluor 488/555驴抗兔IgG和Alexa fluor 488驴抗鼠IgG购自美国Invitrogen公司,4, 6-二脒基-2-苯基吲哚(DAPI)购自美国Sigma公司,钙黄绿素(Calcein-AM)-碘化丙啶(PI)细胞双染试剂盒购自上海东仁化学科技有限公司,N-乙酰半胱氨酸(NAC)和CA-074 Me均购自美国Selleck公司。
2.细胞培养和实验分组:人肾近端小管上皮细胞(HK-2)购自上海麦莎生物科技有限公司。HK-2细胞用含10%胎牛血清和1%青-链霉素的DMEM/F12培养液,于37 ℃、饱和湿度、5% CO2的培养箱中培养和传代。不同实验设置不同的实验分组:空白对照组、单纯NAC或CA-074 Me组、单纯铀染毒组和铀联合NAC或CA-074 Me组。铀染毒浓度为100、300或600 μmol/L、染毒时间24 h;NAC作用浓度为2 mmol/L、作用时间9 h;CA-074 Me作用浓度为100 nmol/L、作用时间2 h。
3. DCFH-DA荧光探针法检测细胞内ROS生成:取对数生长期的HK-2细胞接种于96孔板中37 ℃培养过夜后,按实验分组处理:空白对照组加入溶媒作对照,不同浓度铀染毒组分别加入100、300、600 μmol/L铀染毒24 h;之后弃培养液加入含10 μmol/LDCFH-DA荧光探针的无血清培养液37 ℃培养箱内孵育20 min,用磷酸盐缓冲液(PBS)漂洗3次后,采用多功能酶标仪检测荧光强度(激发波长为488 nm,发射波长为525 nm),细胞内ROS相对水平= (实验孔荧光强度-空白孔荧光强度) / (对照孔荧光强度-空白孔荧光强度)×100%。
4. MitoSOX红色线粒体超氧化物荧光探针法检测线粒体内超氧化物水平:取对数生长期的HK-2细胞接种于8孔腔室载玻片中,37℃培养过夜后,按实验分组处理:空白对照组加入溶媒作对照,不同浓度铀染毒组分别加入100、300、600 μmol/L铀染毒24 h;之后弃培养液加入含5 μmol/L MitoSOX荧光探针的培养液37℃培养箱内孵育10 min,用磷酸盐缓冲液(PBS)漂洗3次后,加入含DAPI的封片剂后封片,荧光显微镜下观察及拍照,用ImageJ软件分析各组1 000个细胞的平均荧光强度,再换算成每个细胞的平均荧光强度。
5.双色免疫荧光法检测溶酶体膜通透性(LMP)及Cathepsin B与溶酶体膜蛋白LAMP-1非共定位表达情况:取对数生长期的HK-2细胞接种于8孔腔室载玻片中,37 ℃培养过夜后,按实验分组处理:空白对照组为加入溶媒作对照,单纯NAC组为加入2 mmol/L NAC培养9 h,单纯铀染毒组为加入600 μmol/L铀染毒24 h,铀联合NAC组为加600 μmol/L铀染毒15 h后加入2 mmol/L NAC继续培养至24 h,处理结束后将腔室载玻片放在冰上,用4℃PBS清洗两次,室温下用4%多聚甲醛固定15 min,PBS清洗两次,0.5% Triton X-100通透15 min,PBS清洗两次,10%小牛血清37 ℃封闭1 h,加入兔源Galectin-1和鼠源LAMP-1抗体或兔源Cathepsin B抗体和鼠源LAMP-1抗体4 ℃孵育过夜,PBS清洗两次,加入Alexa Fluor 488标记的驴抗鼠IgG抗体和Alexa Fluor 555标记的驴抗兔IgG抗体室温避光孵育1 h,PBS清洗两次,加入含DAPI的封片剂后封片,荧光显微镜下观察及拍照,用ImageJ软件分析各组600~1 000个细胞的红色/绿色、黄色的荧光强度,Galectin-1和LAMP-1共定位百分率=Galectin-1和LAMP-1共定位的黄色荧光强度/LAMP-1的绿色荧光强度,Cathepsin B与LAMP-1非共定位百分率=1-Cathepsin B与LAMP-1共定位的黄色荧光强度/Cathepsin B的红色荧光强度
6.钙黄绿素(Calcein-AM)-碘化丙啶(PI)双染色法检测细胞死亡情况:取对数生长期的HK-2细胞接种于12孔板中37 ℃培养过夜后,按实验分组处理:空白对照组为加入溶媒作对照,单纯CA-074 Me组为加入100 nmol/L CA-074 Me培养2 h,单纯铀染毒组为加入600 μmol/L铀染毒24 h,铀联合CA-074 Me组为加600 μmol/L铀染毒22 h后加入100 nmol/L CA-074 Me继续培养至24 h。处理结束后,每孔加入200 μl Calcein-AM和PI的染色工作液,37℃孵育20 min,倒置荧光显微镜下观察拍照,绿色为活细胞,红色为死细胞,每组计数大约1 000个细胞,计算细胞死亡率。
7.单色免疫荧光法检测cleaved-caspase-3表达:取对数生长期的HK-2细胞接种于8孔腔室载玻片中,37 ℃培养过夜后,进行实验分组与处理。处理结束后,进行细胞固定、通透及封闭,加入兔源Cleaved-caspase-3抗体4 ℃孵育过夜,PBS清洗两次,加入Alexa Fluor 488标记的驴抗兔IgG抗体室温避光孵育1 h,PBS清洗两次,加入含DAPI的封片剂后封片,荧光显微镜下观察及拍照,用Image J软件分析各组大约1 000个细胞的平均荧光强度,再换算成每个细胞的平均荧光强度。
8. 统计学处理:采用SPSS 20.0统计软件进行数据分析, 经检验数据符合正态分布,两组间比较经方差齐性检验采用独立样本t检验,数据用x±s表示。多组间比较采用单因素方差分析, 两两比较采用LSD法检验。P < 0.05为差异有统计学意义。
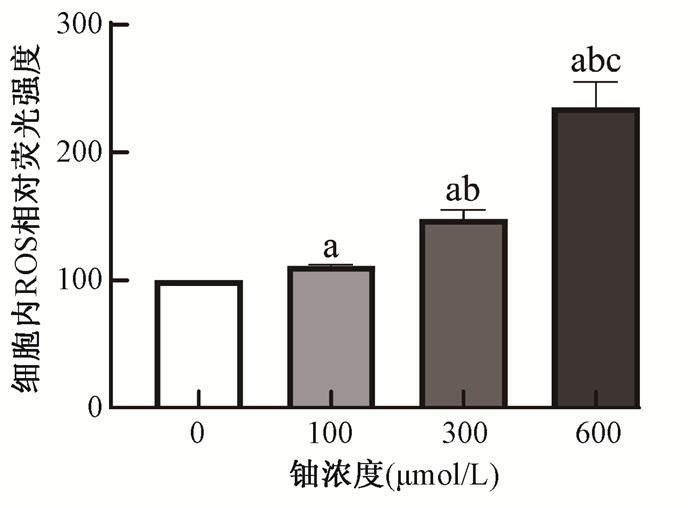
结果1. 铀暴露诱导HK-2细胞内氧自由基(ROS)生成:由图 1所示,与0 μmol/L铀对照组比较,100、300、600 μmol/L铀染毒24 h后细胞内ROS显著增加(t=17.98、11.84、11.75,P < 0.05),而且300、600 μmol/L铀染毒的细胞内ROS水平显著高于100 μmol/L铀染毒细胞(t=10.10、10.37,P < 0.05),600 μmol/L铀染毒的细胞内ROS水平又显著高于300 μmol/L铀染毒细胞(t=5.59,P < 0.05),表明铀暴露明显诱导了HK-2细胞内ROS产生,且随铀浓度增加而显著增加。
|
注:a与0 μmol/L铀对照组比较,t=17.98、11.84、11.75,P < 0.05;b与100 μmol/L铀染毒组比较,t=10.10、10.37,P < 0.05;c与300 μmol/L铀染毒组比较,t=5.59,P < 0.05 图 1 不同浓度铀暴露后诱导HK-2细胞中ROS的变化 Figure 1 The changes of ROS in HK-2 cells induced by exposure to different concentrations of uranyl acetate |
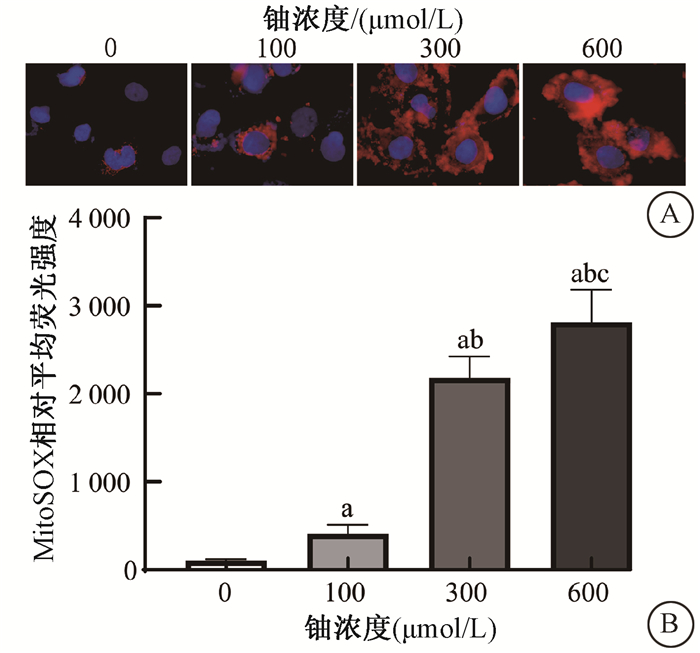
2. 铀暴露诱导HK-2细胞线粒体超氧化物生成:由图 2所示,与0 μmol/L铀对照组比较,100、300、600 μmol/L铀染毒24 h后反映线粒体ROS变化的MitoSOX平均荧光强度显著增加(t=6.14、16.02、13.06,P < 0.05),而且300、600 μmol/L铀染毒细胞的MitoSOX平均荧光强度显著高于100 μmol/L铀染毒细胞(t=21.50、15.16,P < 0.05),600 μmol/L铀染毒细胞的MitoSOX平均荧光强度又显著高于300 μmol/L铀染毒细胞(t=5.93,P < 0.05),表明铀暴露明显诱导了HK-2细胞线粒体超氧化物的产生,且随铀浓度增加而显著增加。
|
注:a与0 μmol/L铀对照组比较,t=6.14、16.02、13.06,P < 0.05;b与100 μmol/L铀染毒组比较,t=21.50、15.16,P < 0.05;c与300 μmol/L铀染毒组比较,t=5.93,P < 0.05 A. MitoSOX荧光染色图×10 000; B. 各组MitoSOX相对平均荧光强度统计柱状图 图 2 不同浓度铀暴露诱导HK-2细胞线粒体超氧化物的表达 A.Fluorescence images of MitoSOX immunofluorescence staining ×10 000; B.Statistical histogram of the relative mean fluorescence intensity of MitoSOX in each group Figure 2 The changes of the mitochondrial superoxide in HK-2 cells induced by exposure to different concentrations of uranyl acetate |
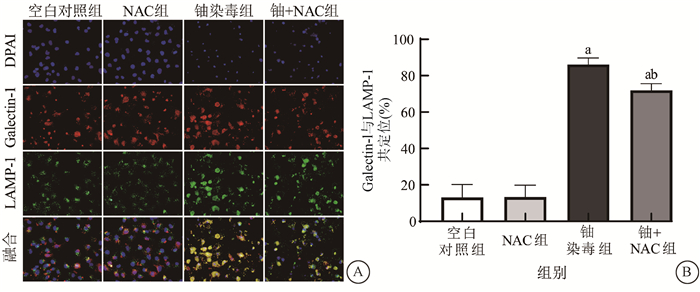
3.ROS生成抑制剂NAC减轻了铀暴露诱导的HK-2细胞溶酶体膜通透性(LMP):溶酶体Galectin斑点检测是检测LMP高度敏感的方法[6],为了保证Galectin特异地标记了损伤的溶酶体,本试验采用其与溶酶体标志物LAMP-1共定位作为检测指标。结果显示,空白对照组与单纯NAC组HK-2细胞的Galectin-1和LAMP-1共定位率无明显差异,而600 μmol/L铀染毒24 h使HK-2细胞Galectin-1和LAMP-1共定位率较空白对照组明显增多(t=15.85、12.70,P < 0.05),NAC处理则能明显降低600 μmol/L铀染毒HK-2细胞中Galectin-1和LAMP-1共定位(t=4.74,P < 0.05),表明600 μmol/L铀染毒24 h显著提高了HK-2细胞LMP,但NAC能明显减轻铀暴露对溶酶体膜的损伤。见图 3。
|
注:a与空白对照组比较,t=15.85、12.70,P < 0.05;b与铀染毒组(600 μmol/L)比较,t= 4.74,P < 0.05 A.免疫荧光染色Galectin-1与LAMP-1的荧光图像×4 000; B.各组Galectin-1与LAMP-1共定位百分率的统计柱状图 图 3 不同处理组中HK-2细胞LMP的变化 A. Fluorescence images of galectin-1 and LAMP-1 detected by immunofluorescence staining ×4 000; B. Statistical histogram of the co-localization percentage of galectin-1 and LAMP-1 in each group Figure 3 The changes of LMP in HK-2 cells in different treatment groups |
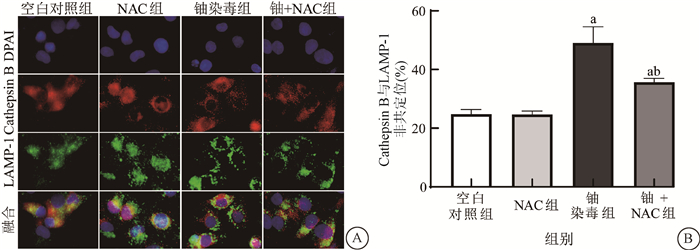
4.ROS生成抑制剂NAC抑制了铀暴露诱导的HK-2细胞溶酶体内Cathepsin B释放:本实验采用双色免疫荧光标记法检测非溶酶体定位的Cathepsin B水平来判定铀暴露引发LMP导致Cathepsin B泄露的情况。如图 4所示,空白对照组与单纯NAC组HK-2细胞的Cathepsin B和LAMP-1非共定位率差异无统计学意义(P>0.05),而600 μmol/L铀染毒24 h使HK-2细胞Cathepsin B和LAMP-1非共定位率较空白对照组明显增加(t=5.95、6.69,P < 0.05),NAC处理则能明显降低600 μmol/L铀染毒HK-2细胞中Cathepsin B和LAMP-1非共定位率(t=4.51,P < 0.05),表明600 μmol/L铀染毒24 h显著提高了HK-2细胞溶酶体内Cathepsin B泄露至胞质中,但NAC能明显减轻铀暴露对溶酶体膜的损伤,从而降低了溶酶体内容物的泄露。
|
注:a与空白对照组比较,t=5.95、6.69,P < 0.05;b与铀染毒组(600 μmol/L)比较,t=4.51,P < 0.05 A. 免疫荧光染色Cathepsin B与LAMP-1的荧光图像 ×10 000; B. 各组Cathepsin B与LAMP-1非共定位百分率的统计柱状图 图 4 不同处理组中HK-2细胞溶酶体内Cathepsin B的释放情况 A. Fluorescence images of cathepsin B and LAMP-1 detected by immunofluorescence staining ×10 000; B. Statistical histogram of the non-co-localization percentage of cathepsin B and LAMP-1 in each group Figure 4 The release changes of cathepsin B in lysosomes in HK-2 cells in different treatment groups |
5.Cathepsin B抑制剂CA-074 Me降低了铀暴露诱导的HK-2细胞死亡情况:有研究表明,溶酶体腔内组织蛋白酶释放至胞质中可介导溶酶体依赖性细胞死亡(LDCD)[7]。本实验采用Cathepsin B抑制剂CA-074 Me抑制其活性,采用Calcein-AM/PI双染色检测细胞死亡和存活情况,如图 5所示,相较于空白对照组,600 μmol/L铀染毒24 h使细胞死亡率显著增高(t=30.40、10.34,P < 0.05);给予CA-074 Me处理则使铀染毒的HK-2细胞的死亡率明显低于单纯铀染毒组(t=6.76,P < 0.05),而单纯CA-074 Me处理组的细胞死亡和存活情况与空白对照组无明显差异,表明无细胞毒浓度的CA-074 Me处理能明显减少铀暴露后HK-2细胞的死亡。
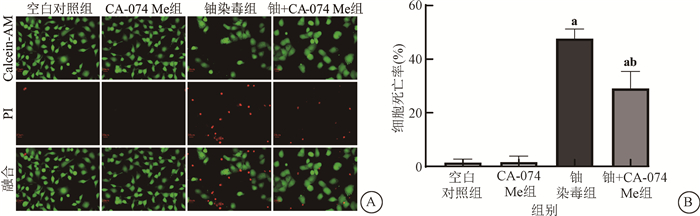
|
注:a与空白对照组比较,t=30.40、10.34,P < 0.05;b与铀染毒组(600 μmol/L)比较,t=6.76,P < 0.05;Calcein-AM.钙黄绿素;PI.碘化丙啶 A.Calcein-AM/PI双染色法检测活/死细胞的荧光图像×4 000; B.各组细胞死亡率统计柱状图 图 5 不同处理组中HK-2细胞死亡情况 A.Fluorescence images of dead and live cells detected by Calcein-AM/PI staining ×4 000; B. Statistical histogram of cell death rate in each group Figure 5 The changes of HK-2 cell death in different treatment groups |
6.Cathepsin B抑制剂CA-074 Me降低了铀暴露诱导的HK-2细胞凋亡情况:已有研究表明,组织蛋白酶从溶酶体腔内释放至细胞质还能激活凋亡效应器如线粒体释放细胞色素C或直接激活Caspases以触发凋亡性细胞死亡[7]。为了探究LMP是否参与了铀诱导的HK-2细胞凋亡,本试验以线粒体凋亡通路的关键执行者Caspase-3的活化形式Cleaved-caspase-3表达变化作为凋亡检测指标,观察CA-074 Me对铀染毒的HK-2细胞Caspase-3活化的影响。由图 6可见,600 μmol/L铀染毒24 h使HK-2细胞的Cleaved-caspase-3蛋白表达水平较空白对照细胞明显增高(t=18.49、9.527,P < 0.05),给予CA-074 Me处理则使铀染毒HK-2细胞的Cleaved-caspase-3表达水平明显低于单纯铀染毒组(t=13.47,P < 0.05),而单纯CA-074 Me处理组的Cleaved-caspase-3表达水平与空白对照组无明显差异,表明无细胞毒浓度的CA-074 Me处理能显著抑制铀暴露诱导的HK-2细胞凋亡。
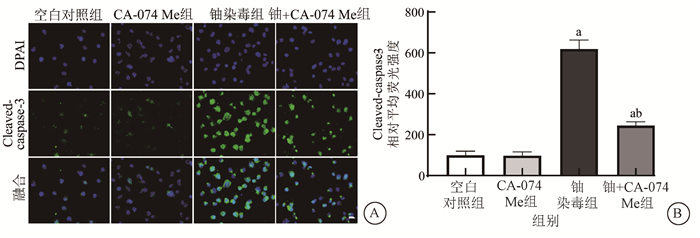
|
注:a与空白对照组比较,t=18.49、9.527,P < 0.05;b与铀染毒组(600 μmol/L)比较,t= 13.47,P < 0.05 A.免疫荧光染色Cleaved-caspase-3的荧光图像 ×4 000; B.各组Cleaved-caspase-3蛋白相对平均荧光强度统计柱状图 图 6 不同处理组中HK-2细胞凋亡情况 A. Fluorescence images of cleaved-caspase-3 level detected by immunofluorescence staining ×4 000; B. Statistical histogram of the relative mean fluorescence intensity of Cleaved-caspase-3 protein in each group Figure 6 The changes of HK-2 cell apoptosis in different treatment groups |
讨论
溶酶体为单层膜包裹的囊泡状细胞器,其主要功能是降解由胞吞/吞噬摄入的细胞外物质以及将来自细胞自噬的细胞内成分降解后再利用,以维持细胞的代谢稳态及调控细胞的基本功能如细胞生长和死亡[8]。由于溶酶体内含有60多种降解各类生物大分子的酸性水解酶,因而溶酶体膜的稳定性对于细胞生存至关重要。溶酶体膜损伤会使膜通透性增强,发生LMP,引起溶酶体酶释放至细胞质中,进而触发一系列细胞死亡通路,严重威胁细胞生存[7, 9]。研究发现,ROS是LMP的主要诱导剂[7],在氧化应激状态下,细胞内过量的H2O2(包括线粒体来源的)弥散进入溶酶体,通过铁离子介导的芬顿反应将H2O2转化为羟自由基,进而通过脂质过氧化作用及损伤溶酶体膜蛋白致溶酶体膜不稳定而导致各种溶酶体酶释放至细胞质中[10-11]。组织蛋白酶释放至胞质中的后果不仅能诱导LDCD这种死亡方式,还能直接激活Caspase或诱导线粒体膜通透性增加激活线粒体凋亡通路、诱导铁死亡和焦亡等[7],LMP诱导各类细胞死亡方式在生理和病理情况下的意义越来越受到关注。
近年来研究已证实,铀诱导不同细胞包括肾细胞的氧化应激损伤是其主要的毒性机制[4-5]。本实验采用DCFH-DA荧光探针法检测到,铀诱导HK-2细胞内ROS生成呈浓度依赖性增加,并与反映线粒体ROS变化的MitoSOX荧光探针法检测线粒体超氧化物生成的结果相一致,而且不同浓度铀诱导线粒体ROS的生成量是铀诱导细胞内ROS生成量的4~15倍,表明线粒体是铀诱导ROS生成的主要场所[5];重要的是,采用细胞毒性浓度的铀[12]暴露能显著诱导HK-2细胞的LMP从而导致溶酶体内Cathepsin B释放至胞质中,ROS清除剂NAC处理则能明显减轻铀暴露引起的LMP和溶酶体内Cathepsin B的泄露,表明铀暴露诱导的细胞内ROS及线粒体ROS水平升高导致了LMP和Cathepsin B的释放。Pourahmad等[13]亦观察到铀暴露诱导体外培养的大鼠肝细胞ROS生成增加、溶酶体膜通透性增高及抗氧化物的保护作用。LDCD的一个关键特征是LMP,Cathepsin B则是这种细胞死亡形式的主要执行者,因此这种死亡方式通常采用药理或基因手段靶向抑制组织蛋白酶活性以阻断细胞死亡的方法来加以判定[14]。本试验进一步采用Cathepsin B抑制剂CA-074 Me观察LMP在铀诱导细胞死亡中的作用,结果显示Cathepsin B抑制剂CA-074 Me能显著降低铀诱导的HK-2细胞死亡,而且显著降低了铀诱导的凋亡执行分子Cleaved-caspase-3表达,表明铀暴露不仅诱导了HK-2细胞LDCD,而且激活了其线粒体凋亡途径。
综上所述,本研究证实铀暴露诱导的ROS爆发介导了HK-2细胞LMP,进而导致溶酶体内Cathepsin B释放至胞质中,触发了LDCD和线粒体凋亡通路,这可能是铀暴露致肾损伤的重要病理机制之一。本研究期望以溶酶体为切入点,探寻更为有效的铀解毒促排治疗的新途径、新策略。
利益冲突 全体作者无任何利益冲突
作者贡献声明 钟登琴负责实验操作、数据处理及撰写论文;李强、张旭霞、王梦梦、王睿云协助实验进行;陈红红指导实验和论文修改
| [1] |
Ma M, Wang R, Xu L, et al. Emerging health risks and underlying toxicological mechanisms of uranium contamination: Lessons from the past two decades[J]. Environ Int, 2020, 145(106107). DOI:10.1016/j.envint.2020.106107 |
| [2] |
Arzuaga X, Rieth SH, Bathija A, et al. Renal effects of exposure to natural and depleted uranium: a review of the epidemiologic and experimental data[J]. J Toxicol Environ Health B Crit Rev, 2010, 13(7-8): 527-545. DOI:10.1080/10937404.2010.509015 |
| [3] |
Homma-Takeda S, Kitahara K, Suzuki K, et al. Cellular localization of uranium in the renal proximal tubules during acute renal uranium toxicity[J]. J Appl Toxicol, 2015, 35(12): 1594-1600. DOI:10.1002/jat.3126 |
| [4] |
Daraie B, Pourahmad J, Hamidi-Pour N, et al. Uranyl acetate induces oxidative stress and mitochondrial membrane potential collapse in the human dermal fibroblast primary cells[J]. Iran J Pharm Res, 2012, 11(2): 495-501. |
| [5] |
Shaki F, Hosseini MJ, Ghazi-Khansari M, et al. Toxicity of depleted uranium on isolated rat kidney mitochondria[J]. Biochim Biophys Acta, 2012, 1820(12): 1940-1950. DOI:10.1016/j.bbagen.2012.08.015 |
| [6] |
Aits S, Kricker J, Liu B, et al. Sensitive detection of lysosomal membrane permeabilization by lysosomal galectin puncta assay[J]. Autophagy, 2015, 11(8): 1408-1424. DOI:10.1080/15548627.2015.1063871 |
| [7] |
Wang F, Gómez-Sintes R, Boya P. Lysosomal membrane permeabilization and cell death[J]. Traffic, 2018, 19(12): 918-931. DOI:10.1111/tra.12613 |
| [8] |
Xu H, Ren D. Lysosomal physiology[J]. Annu Rev Physiol, 2015, 77: 57-80. DOI:10.1146/annurev-physiol-021014-071649 |
| [9] |
Serrano-Puebla A, Boya P. Lysosomal membrane permeabilization in cell death: new evidence and implications for health and disease[J]. Ann N Y Acad Sci, 2016, 1371(1): 30-44. DOI:10.1111/nyas.12966 |
| [10] |
Kurz T, Terman A, Gustafsson B, et al. Lysosomes and oxidative stress in aging and apoptosis[J]. Biochim Biophys Acta, 2008, 1780(11): 1291-1303. DOI:10.1016/j.bbagen.2008.01.009 |
| [11] |
Kurz T, Terman A, Gustafsson B, et al. Lysosomes in iron metabolism, ageing and apoptosis[J]. Histochem Cell Biol, 2008, 129(4): 389-406. DOI:10.1007/s00418-008-0394-y |
| [12] |
暴一众, 王丹, 胡昱兴, 等. 螯合剂BPCBG对轴的促排效果和防护轴致人肾小管细胞损伤的作用[J]. 药学学报, 2011, 46(11): 1308-1313. Bao YZ, Wang D, Hu YX, et al. Effect of the chelator BPCBG on the decorporation of uranium in vivo and uranium-induced damage of human renal tubular epithelial cells in vitro[J]. Acts Pharm Sin, 2011, 46(11): 1308-1313. DOI:10.16438/j.0513-4870.2011.11.015 |
| [13] |
Pourahmad J, Ghashang M, Ettehadi HA, et al. A search for cellular and molecular mechanisms involved in depleted uranium (DU) toxicity[J]. Environ Toxicol, 2006, 21(4): 349-354. DOI:10.1002/tox.20196 |
| [14] |
Gómez-Sintes R, Ledesma MD, Boya P. Lysosomal cell death mechanisms in aging[J]. Ageing Res Rev, 2016, 32: 150-168. DOI:10.1016/j.arr.2016.02.009 |
 2022, Vol. 42
2022, Vol. 42


