2. 江南大学附属医院影像科, 无锡 214122
2. Department of Radiology, Affiliated Hospital of Jiangnan University, Wuxi 214122, China
放射性肺炎(radiation pneumonitis, RP)是胸部肿瘤放射治疗中较为常见的并发症,在接受胸部放疗的患者中,15%~40%的患者会发生症状性放射性肺炎[1]。RP的发生是提高靶区放射剂量的限制性因素,严重影响治疗效果。
放射性肺炎的发生与正常肺组织受照射剂量体积以及患者的年龄、基础肺功能、吸烟史、同步化疗等因素密切相关[2]。然而RP的发生机制尚未明确,还没有有效手段来准确预测RP的发生。近年来,通过医学影像特征提取与分析,开展放疗疗效和不良反应预测的研究越来越受到关注[3-4]。CT是放疗前必查项目,放疗前CT影像特征能准确预测RP的发生风险,将对胸部肿瘤放疗剂量个体化及RP早诊早治具有重要意义。本研究针对肺癌放疗患者,提取放疗前CT影像特征,并结合临床信息、放疗剂量参数等进行影像组学分析,采用机器学习模型筛选与发生RP密切相关的特征参数,建立RP预测模型。
资料与方法1. 研究对象:回顾性收集2018年11月至2020年4月期间在江南大学附属医院接受放射治疗的103例肺癌患者。纳入标准:①病理证实为肺癌,接受胸部常规分割调强放疗。②放疗前美国东部肿瘤协作组(ECOG)评分≤2分,无间质性肺疾病,无严重心、肝、肾功能障碍。③放疗前肺功能:1 s用力呼气量(FEV1)>1.5 L、FEV1%和一氧化碳弥散量%(DLCO%)占预计值的60%以上。④放疗结束后随访6个月以上。患者一般资料见表 1。
|
|
表 1 103例肺癌放疗患者一般资料及与放射性肺炎发生相关性的单因素分析 Table 1 Characteristics of 103 lung cancer patients underwent radiotherapy and univariate analysis of factors related with radiation pneumonitis |
2. CT图像采集、勾画和放疗实施:CT图像采用放疗定位时的平扫图像,CT机型号为LightSpeed Ultra(美国GE公司),扫描参数为扫描层厚5 mm,管电压120 kVP,管电流自动,矩阵512×512像素。图像传输至Xio计划系统,并在医科达(瑞典Elekta公司)的医生工作站上勾画放疗靶区和正常组织等。后进行放疗计划设计,放疗靶区PTV总剂量范围45~66 Gy (中位剂量60 Gy),所有计划设计完成后经过放疗科医生和物理师审核后执行。
3. RP评级:以放疗前的CT图像作为基准,将放疗后的随访胸部CT作为参考,结合美国肿瘤放射治疗协作组(RTOG)急性RP分级标准进行RP的分类判定:0级:无变化;1级:轻微的干咳或用力的时候呼吸困难;2级:持续性咳嗽,需要麻醉性镇咳药,轻微用力时呼吸困难,X射线无变化或者有轻微的棉絮状或片状影;3级:严重咳嗽,麻醉性镇咳药无效,安静时呼吸困难,X射线呈致密性,需要间断性吸氧或者激素治疗;4级:呼吸功能不全,需要持续性吸氧或辅助机械通气;5级:致命性呼吸困难。当分类2级以上则判定为症状性放射性肺炎发生。
4. 影像组学特征提取:设置提取参数的感兴趣区(ROI)为双侧正常肺组织,排除计划靶区(planned target volume, PTV)、肺门、肺不张和增厚的胸膜。使用Matlab软件编写,对原始图像先做滤波处理,去除噪声干扰,然后提取ROI的影像组学特征,包括灰度共生矩阵特征(GLCM)、灰度行程长度特征(GLRLM)、直方图特征(Histogram)[5],小波变换后的这3类特征(wavelet-GLCM、wavelet-GLRLM、wavelet-Histogram),以及几何特征(Geometry)和分形特征(Fractal)[6],共250个特征。
5. 临床与剂量学资料分析:收集患者性别、年龄、吸烟史、病理类型、T分期、N分期、手术/化疗/分子靶向治疗情况等临床资料,放疗剂量学参数从计划系统中获取,包括总放疗剂量,平均肺剂量(mean lung dose, MLD)和接受5、10、20和30 Gy剂量照射时正常肺组织的体积百分数(V5 Gy、V10 Gy、V20 Gy、V30 Gy),利用单因素分析临床、剂量学参数与RP发生的相关性,初步筛选肺炎预测的潜在因子。
6. 特征选择与建模:本研究采用最小绝对值收敛和选择算子(the least absolute shrinkage and selection operator, LASSO)回归机器学习模型[7]。该方法通过L1正则化稀疏模型,避免过拟合,可有效提高模型预测的准确性和可解释性。进行单因素分析以后,开展LASSO回归时,纳入所有的临床、剂量学资料以及影像组学特征进行总体筛选。对总样本随机分割,用3/4的数据进行训练,1/4的数据用于测试。在训练集队列中通过五折交叉验证求得一系列LASSO模型的正则化参数λ,选择最小的λ确定特征选择。然后,在测试集中计算得到预测模型的受试者工作特征曲线(ROC)下的面积(AUC)、敏感性和特异性。最后用筛选的特征构造列线图(Nomogram)以描述预测,便于临床使用。
7. 内部验证:分别在训练集、测试集及总样本中采用五折交叉验证和Bootstrap的方法进行预测模型的验证与评价,两种方法各重复2 000次,得到稳定的AUC、敏感性和特异性的点估计和95%置信区间估计。
8. 统计学处理:采用R软件进行数据的统计分析,双侧检验。对于分类资料行χ2检验;定量资料符合正态分布做独立样本t检验。特征的选择、建模和内部验证也在R软件中实现。列线图的绘制采用R软件的RMS包。P < 0.05为差异有统计学意义。
结果1. 临床与剂量学资料分析:患者一般资料见表 1。在收集的103例患者中,有28例(27%)发生了2级以上症状性放射性肺炎。单因素分析结果显示,临床特征中未发现在RP发生与否的组间差异存在统计学意义(P>0.05);而剂量学特征中,患者双侧正常肺组织的平均受照剂量(MLD)、V20 Gy和V30 Gy在RP发生与否的组间差异有统计学意义(t=2.20、2.34、2.93,P < 0.05),表明这些剂量学特征为RP发生的相关因素。
2. 特征选择与建模:采用最小绝对值收敛和选择算子(LASSO)方法综合筛选临床、剂量学特征及影像组学特征,共筛选得到4个特征,分别为双侧正常肺组织的V30 Gy和3个影像组学特征,包括灰度共生矩阵熵特征(GLCM.Entropy)和小波变换的直方图均值特征(LH_HIST.mean.scaled)和中位数特征(HH_HIST.median.scaled)。利用五折交叉验证和Bootstrap方法进行模型内部验证和评价,其结果见表 2。样本总体内部验证的AUC值为0.757,敏感性为61.0%,特异性为84.0%。
|
|
表 2 预测模型的内部验证结果 Table 2 Internal validation results of the prediction model |
为了便于临床医生直观的从参数直接预测RP发生的概率,利用筛选的特征建立了RP发生风险的列线图,如图 1所示。利用列线图可快速预测针对个体化患者的RP发生率情况,首先找到该患者的临床或者影像组学特征所对应的位置,画垂线与得分线相交记录得分,各因素得分相加在总分上找到总得分,画垂线与RP线段相交即可得到相应的RP发生概率。由图 1可见,GLCM的熵特征值越大,不同小波变换的直方图的均值和中位数特征值越小,肺组织剂量V30 Gy越大,RP发生的风险越大,并且V30 Gy的线段最长,即该因素在RP发生风险预测中贡献最大。
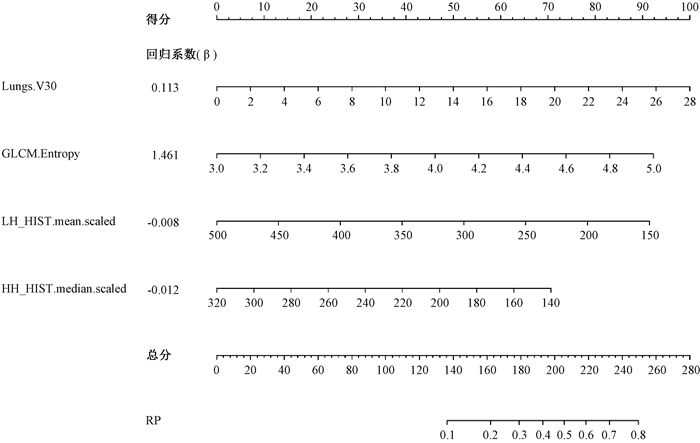
|
注:Lungs.V30. 肺的剂量体积百分数V30 Gy; GLCM.Entropy. 灰度共生矩阵类别的熵特征; LH_HIST.mean.scaled. 小波变换直方图类别的均值; HH_HIST.median.scaled.小波变换直方图类别的中位数特征; RP. 放射性肺炎 图 1 预测放射性肺炎发生风险的列线图 Figure 1 Nomogram for predictive risk of radiation pneumonitis |
讨论
在胸部肿瘤放疗临床中,患者发生RP的预测可有效指导相应的临床干预措施。研究者尝试通过血液细胞因子和肺功能检测等方式来探讨RP的预测方法[8],而这些方法需额外检查,并受多种因素影响导致结果不一。研究者也发现放疗计划中肺组织的剂量学参数与RP的发生存在一定相关性[9-10]。因而,为了降低RP发生的风险,放疗计划中严格控制正常肺组织所受剂量是临床实践中的标准做法,但单纯应用剂量学因子预测RP的准确性仅为60%~70%,而多个剂量学参数联用后,预测准确性有一定的提高[11],但临床上仍有许多患者发生的RP难以通过肺组织的物理剂量来得到有效预测。
随着医学影像技术的进步,影像组学方法在医学诊断中得到应用广泛[12]。放疗前,患者行CT影像检查是常规,因而基于CT图像开展预测RP的影像组学研究,具有非常好的应用价值。Cunliffe等[9]针对食管癌放疗患者的研究发现,肺组织内随机选择的32 × 32像素矩阵内的CT影像组学特征在放疗前后的差异与RP的发生,甚至RP的严重程度等均具有相关性。路玉昆等[13]的研究发现,肺癌患者放疗前与中期健侧与患侧肺的CT影像组学特征发生显著变化。张臻等[14]针对Ⅲ期非小细胞肺癌,通过方差分析及LASSO方法,筛选出5个影像组学特征,构建发生等级≥1的RP预测模型,AUC为0.71。Krafft等[15]用十折交叉验证得到非小细胞肺癌放疗患者发生等级≥3的RP预测模型,加入影像组学特征后的模型AUC达到0.68。这些研究都证实了影像组学方法预测RP的可能性。
本研究针对胸部放疗常见的肺癌行常规分割放疗的患者,开展发生症状性RP预测的CT影像组学研究,结合临床与剂量学参数,构建RP的预测模型。首先从单因素分析结果发现,RP的发生与肺的平均剂量MLD、剂量体积百分数V20 Gy和V30 Gy的相关性具有统计学意义,这与已有研究结果一致[16]。并且,V30 Gy的P值更小,提示了RP的发生与偏大剂量的体积更相关的趋势。
本研究为提取更全面完整的影像组学特征,将双侧的正常肺组织都作为感兴趣区,包含的肺组织CT图像信息更全面。CT图像在采集、数字化及传输中带有的噪声,会影响成像质量,降低对比度空间分辨率等。因而本研究在提取影像组学特征前,进行了滤波处理,去除噪声影响,提取的特征更能反应组织成像的本质内容。在进行特征选择与建模时,本研究选择用LASSO回归机器学习的方法,该方法特别适合样本量比自变量少的情况,可有效避免过拟合问题。将肺癌患者正常肺组织的CT影像组学、临床及剂量学特征都作为潜在预测因子,纳入LASSO进行特征选择,并建立了RP的预测模型,测试集中预测的AUC较为理想,样本内部验证的AUC为0.757,说明该模型对症状性RP提供了良好的预测能力。本研究共筛选的GLCM类别特征属于纹理特征,而小波变换由于考虑了时频变化,能更加精确的描述局部,进行信号特征的分离,因而可能更容易被筛选出来。虽然与其他研究筛选的特征不一,但与张臻等[14]的结果一样,也同样大部分是小波变换后的特征。本研究选择的特征与文献报道的不完全相同,可能由于研究对象和提取特征的感兴趣区域、特征种类等因素存在差异。最后,本研究基于选择的特征构建了预测RP风险的列线图,从该图可方便临床医生根据每个患者的特征值估算RP发生的风险,从而给与个体化的风险预测与提前干预。
本研究存在的主要缺陷:首先,有研究者通过不同批次的扫描和图像分割,进行test-retest、contour-recontour研究以降低扫描与勾画的不确定性[17],从而选择可重复性较高的影像组学特征。本研究为回顾性研究,采用的是单次CT扫描图像及单次正常肺组织勾画的方法,在获得稳定影像组学特征方面有一定欠缺。然而,有文献报道,勾画因素对影像组学特征可重复性的影响相对较小[17],而且本研究采用半自动勾画的方法,准确性相对较高。其次,本研究样本量较小,预测模型的稳定性还有待提高,模型的泛化能力仍需要进一步通过外部验证来证实。
综上所述,本研究发现CT影像组学特征对预测放疗后症状性放射性肺炎的发生有重要价值,利用影像组学结合剂量学特征得到了RP预测模型。今后还需扩大样本量,并增加多中心的样本进行外部验证,以便得到稳定性和准确性更高的预测模型。
利益冲突 所有作者均声明不存在利益冲突
志谢 本研究受江苏省卫健委医学科研面上项目(M2020005),无锡市科技发展基金(N20192028),无锡市太湖人才计划“双百”中青年医疗卫生后备拔尖人才(肿瘤学)(HB2020054)项目资助
作者贡献声明 孔燕负责论文撰写、数据分析;吴佳负责临床数据收集与分析;魏贤顶、孔旭东负责剂量数据收集与分析;鲍而文负责临床数据收集与分析;孙宗琼参与研究;黄建锋负责临床数据收集分析、论文修改
| [1] |
Rodrigues G, Lock M, D'Souza D, et al. Prediction of radiation pneumonitis by dose-volume histogram parameters in lung cancer: a systematic review[J]. Radiother Oncol, 2004, 71(2): 127-138. DOI:10.1016/j.radonc.2004.02.015 |
| [2] |
杜峰, 王强, 王玮, 等. 胸段食管癌放疗后放射性肺炎相关因素分析[J]. 中华放射医学与防护杂志, 2020, 40(11): 832-839. Du F, Wang Q, Wang W, et al. Analysis of related factors of radiation pneumonitis after radiotherapy for thoracic segment esophageal cancer[J]. Chin J Radiol Med Prot, 2020, 40(11): 832-839. DOI:10.3760/cma.j.issn.0254-5098.2020.11.004 |
| [3] |
Huynh E, Coroller TP, Narayan V, et al. CT-based radiomic analysis of stereotactic body radiation therapy patients with lung cancer[J]. Radiother Oncol, 2016, 120(2): 258-266. DOI:10.1016/j.radonc.2016.05.024 |
| [4] |
贾田颖, 余雯, 傅小龙. 影像组学在非小细胞肺癌精准治疗中的应用进展[J]. 中华放射医学与防护杂志, 2016, 36(12): 947-950. Jia TY, Yu W, Fu XL. Progress on application of radiomics in precise treatment of non-small cell lung cancer[J]. Chin J Radiol Med Prot, 2016, 36(12): 947-950. DOI:10.3760/cma.j.issn.0254-5098.2016.12.015 |
| [5] |
Just N. Improving tumour heterogeneity MRI assessment with histograms[J]. Brit J Cancer, 2014, 111(12): 2205-2213. DOI:10.1038/bjc.2014.512 |
| [6] |
Lennon FE, Cianci GC, Cipriani NA, et al. Lung cancer-a fractal viewpoint[J]. Nat Rev Clin Oncol, 2015, 12(11): 664-675. DOI:10.1038/nrclinonc.2015.108 |
| [7] |
Tibshirani R. Regression shrinkage and selection via the LASSO[J]. J R Stat Soc Series B (Methodol), 1996, 58(1): 267-288. DOI:10.1111/j.2517-6161.1996.tb02080.x |
| [8] |
汪盛, 王彩莲. 放射性肺炎临床相关预测因素的研究进展[J]. 中华放射肿瘤学杂志, 2021, 30(3): 305-310. Wang S, Wang CL. Research progress on clinical factors for predicting radiation pneumonitis[J]. Chin J Radiat Oncol, 2021, 30(3): 305-310. DOI:10.3760/cma.j.cn113030-20200604-00292 |
| [9] |
Cunliffe A, Armato SG, Castillo R, et al. Lung texture in serial thoracic computed tomography scans: correlation of radiomics-based features with radiation therapy dose and radiation pneumonitis development[J]. Int J Radiat Oncol, 2015, 91(5): 1048-1056. DOI:10.1016/j.ijrobp.2014.11.030 |
| [10] |
Moran A, Daly ME, Yip SSF, et al. Radiomics-based assessment of radiation-induced lung injury after stereotactic body radiotherapy[J]. Clin Lung Cancer, 2017, 18(6): e425-e431. DOI:10.1016/j.cllc.2017.05.014 |
| [11] |
王谨, 庄婷婷, 何智纯, 等. 非小细胞肺癌同期放化疗后重度急性放射性肺炎的预测因素[J]. 中华放射肿瘤学杂志, 2012, 21(4): 326-329. Wang J, Zhuang TT, He ZC, et al. Severe acute radiation pneumonitis after concurrent chemoradiotherapy in non-small cell lung cancer[J]. Chin J Radiat Oncol, 2012, 21(4): 326-329. DOI:10.3760/cma.j.issn.1004-4221.2012.04.011 |
| [12] |
胡盼盼, 王佳舟, 胡伟刚, 等. 影像组学在精准放疗中的应用[J]. 中华放射肿瘤学杂志, 2017, 26(1): 103-106. Hu PP, Wang JZ, Hu WG, et al. Radiomics in precision radiotherapy[J]. Chin J Radiat Oncol, 2017, 26(1): 103-106. DOI:10.3760/cma.j.issn.1001-4221.2017.01.025 |
| [13] |
路玉昆, 巩贯忠, 陈进琥, 等. CT图像影像组学特征参数变化与放射性肺炎的相关性研究[J]. 中华放射肿瘤学杂志, 2018, 27(7): 643-648. Lu YK, Gong GZ, Chen JH, et al. The study of correlation between radiation pneumonitis and the variation of CT-based radiomics features[J]. Chin J Radiat Oncol, 2018, 27(7): 643-648. DOI:10.3760/cma.j.issn.1004-4221.2018.07.004 |
| [14] |
张臻, 赵路军, 王伟, 等. 基于放射组学预测放射性肺炎的初步研究[J]. 中华放射肿瘤学杂志, 2020, 29(6): 427-431. Zhang Z, Zhao LJ, Wang W, et al. Preliminary study of predicting radiation pneumonitis based on radiomics technology[J]. Chin J Radiat Oncol, 2020, 29(6): 427-431. DOI:10.3760/cma.j.cn113030-20190225-00063 |
| [15] |
Krafft SP, Rao A, Stingo F, et al. The utility of quantitative CT radiomics features for improved prediction of radiation pneumonitis[J]. Med Phys, 2018, 45(11): 5317-5324. DOI:10.1002/mp.13150 |
| [16] |
Schallenkamp JM, Miller RC, Brinkmann DH, et al. Incidence of radiation pneumonitis after thoracic irradiation: Dose-volume correlates[J]. Int J Radiat Oncol Biol Phys, 2007, 67(2): 410-416. DOI:10.1016/j.ijrobp.2006.09.030 |
| [17] |
Xue C, Yuan J, Lo GG, et al. Radiomics feature reliability assessed by intraclass correlation coefficient: a systematic review[J]. Quant Imaging Med Surg, 2021, 11(10): 4431-4460. DOI:10.21037/qims-21-86 |
 2022, Vol. 42
2022, Vol. 42


