交界性肿瘤是一种生物学行为介于良、恶性之间的肿瘤,发生在头颈部时多具局部侵袭性,因此有较高的局部复发率[1-3]。儿少期罹患时,其诊疗手段受年龄限制影响,手术创伤大,外放疗有效,但不良反应重[4-5],手术和放疗甚至可能严重影响生长发育,化疗、激素治疗等疗效不佳并伴有较重不良反应[1-2]。因此,对于儿少期头颈部交界瘤,提高治愈率,减少复发与治疗的不良反应,仍需进一步研究。125I放射性粒子植入近距离治疗作为一种高度适形的放疗手段,具有微创、不良作用低等优点[6-7]。本研究通过对儿少期头颈部交界性肿瘤粒子植入的术前、术后剂量学结果的比较,结合局部控制率及不良反应,分析剂量分布及参数的数值,为此类肿瘤选择125I放射性粒子植入近距离治疗方案提供参考。
资料与方法1.一般临床资料:回顾性分析2010年1月至2018年12月间于北京大学口腔医院就诊经单纯125I放射性粒子组织间植入近距离治疗或联合手术治疗的儿少期交界性肿瘤患者11例。其中男性7例,女性4例,中位年龄3岁(范围2~18岁),中位随访时间为48个月(33~131个月)。就诊时肿瘤最大径5 ~10 cm者7例,2.5~5 cm者4例;肿瘤位于颅底区4例,颌下区4例,腮腺区、口底区及上唇区各1例;手术联合粒子植入治疗4例,单纯粒子植入7例,行穿刺活检明确病理结果。病理结果为7例侵袭性纤维瘤,2例炎性肌纤维母细胞瘤,2例孤立性纤维瘤。
2. 125I放射性粒子植入前准备与治疗计划设计:治疗前行CT及核磁共振(MR)检查,明确肿瘤大体边界。其中,手术联合粒子植入病例术后再次行CT及MR检查以备近距离治疗设计。将CT检查结果以DICOM形式导入近距离治疗计划系统(brachytherapy treatment planning system, BTPS,北京天航科霖科技发展公司)中,结合肿瘤(包括手术前影像资料)的范围勾画肿瘤大体靶区(gross tumor volume, GTV),并且在避开头颈部危及器官的基础上,将GTV外扩0.5~1.0 cm作为计划靶区(planning target volume,PTV),设计粒子植入位置及插植针穿刺针道,使针道避开重要的血管、组织器官及骨遮挡。根据肿瘤位置及周围危及器官的分布,预先设置处方剂量(prescription dose, PD)范围为80~120 Gy,中位数为110 Gy,选择植入的放射性粒子活度为18.5 MBq(中国原子能院原子高科公司生产)。通过BTPS系统计算术前剂量学参数指标,包括D90(90%GTV接受的剂量)、V90(GTV接受90%处方剂量的百分比)、V100(GTV接受100%处方剂量的百分比)、V150(GTV接受150%处方剂量的百分比)、适形指数(conformal index,CI)、靶区外体积指数(external index,EI)。CI=(VTref/VT)×(VTref/Vref);EI=(Vref-VTref)/VT×100%。其中VT为GTV体积;VTref为GTV接受处方剂量的体积;Vref为处方剂量包含的总体积;VT1.5ref为GTV接受150%处方剂量的体积。
3.3D打印个性化穿刺引导模板制作与手术导航系统设计:将患者头颈部CT图像导入至Mimics 10.01(Materialise公司,比利时)软件中,根据患者头颈部解剖标志及治疗计划中插植针空间位置坐标设计3D个性化穿刺引导模型[8-9]。将3D个性化穿刺引导模型通过三维快速成形设备和医用半透明树脂材料打印制作个性化模板。另将所构建的模板模型与患者CT图像共同导入至iPlan CMF 3.0(BrainLAB公司,德国)软件中进行导航计划设计,构建穿刺针道并勾画颈动脉、颈静脉、眼球等危险区。
4.125I放射性粒子植入及植入后验证:患者行仰卧位,全身麻醉后,根据术前设计,在3D打印个性化穿刺模板及手术导航系统引导下,按粒子植入计划针道方向及深度插入穿刺针,完成粒子植入。粒子植入后次日行CT检查,将数据导入至BTPS系统中,核查实际粒子数目是否与计划相符及其空间分布情况,进行术后剂量验证,并进行术后剂量学参数计算。剂量学参数指标同术前。
5.随访及评估:125I放射性粒子植入后半年内每2个月复查随访1次,随后每3~6个月复查随访1次。复查包括临床检查与影像学检查(CT及MR)。根据美国肿瘤放射治疗协作组(RTOG)分级标准[10]进行不良反应的评估。急性和远期放疗反应定义为近距离治疗后半年内和半年后出现的反应。手术联合粒子植入病例无复发或新病灶形成为局部控制(local control,LC)。单纯粒子植入病例疗效评价根据实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1版[11]评估,分为完全缓解(complete response,CR),部分缓解(partial response,PR),疾病稳定(stable disease,SD),疾病进展(progressive disease,PD),CR、PR及SD为局部控制。
6.统计学处理:使用SPSS 20.0进行统计分析。局部控制率(local control rate,LCR)通过Kaplan-Meier方法计算,运用Wilcoxon符号秩检验评估粒子植入前、后剂量学参数间差异性,运用Spearman相关性检验评估不良反应RTOG分级与处方剂量间相关性。P<0.05为差异有统计学意义。
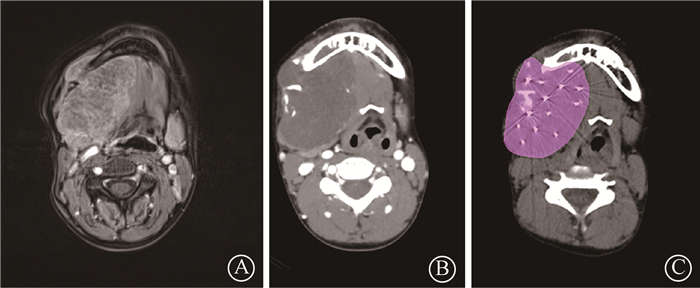
结果1.靶区范围:本组病例靶区分布包括颅底区4例,颌下区4例,腮腺区、口底区及上唇区各1例,粒子植入后验证显示全部实现计划靶区的基本覆盖,见图 1。
|
图 1 大体肿瘤范围与靶区范围示例 A.MR所示大体肿瘤范围;B.CT所示大体肿瘤范围;C.粒子植入后靶区覆盖范围 Figure 1 Example of gross tumor volume and target volume A. Preoperative gross tumor volume in MR; B. Preoperative gross tumor volume in CT; C. Postoperative actual target volume |
2.粒子植入前、后剂量学参数:粒子植入前、后剂量学参数如病灶体积、CI、EI、D90、V90、V100、V150等见表 1。粒子植入前、后相关参数均无统计学意义(P>0.05)。
|
|
表 1 粒子植入前、后剂量学参数对比 Table 1 Comparison between preoperative and postoperative dosimetric results |
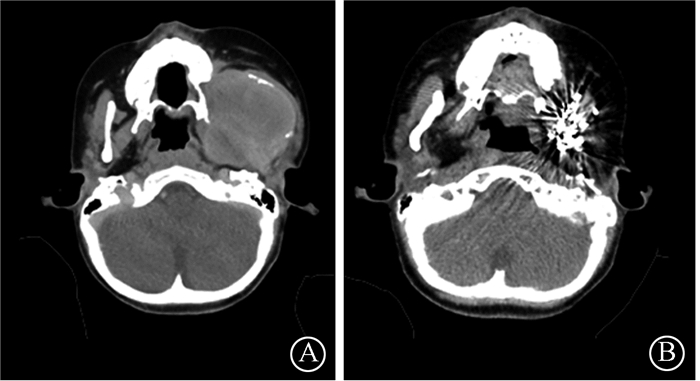
3.肿瘤控制情况及不良反应:本组病例随访时间内无复发或进展,局部控制率为100%,单纯粒子植入病例完全缓解率71.4%,见图 2,客观缓解率100%,未发现区域淋巴结及远处转移。急性不良反应率81.8%,主要发生在皮肤及黏膜,包括7例靶区表面皮肤干燥脱屑或黏膜水肿(RTOG1级),2例皮肤干燥脱屑伴明显红斑(RTOG2级),未观察到急性皮肤严重不良反应(RTOG3~4级)及舌、眼球、面部表情肌、吞咽运动等颅神经损伤反应。无远期不良反应。其中急性不良反应RTOG分级与处方剂量呈正相关(r=0.69,P=0.019)。
|
图 2 1例头颈部交界性肿瘤单纯粒子植入治疗前后CT图像 A.粒子植入前;B.粒子植入后3年 Figure 2 Preoperative and postoperative CT image of a case of borderline tumor in the head neck region after definitive brachytherapy A. Before treatment; B. 3 years after treatment |
讨论
以正常组织为边界的扩大切除仍是交界性肿瘤常用的治疗手段。但在头颈部,由于解剖结构的复杂性、周围较多的重要组织结构以及儿少期保留面型、功能的特殊性,往往难以实施扩大切除甚至无法手术,而阳性边缘是导致单纯手术治疗后局部复发的主要原因[1-3]。化疗、激素治疗、抗炎治疗等据报道未获得满意疗效,且有内分泌、血液等相关系统较严重的不良作用[1-2]。靶向治疗虽展现了良好的潜力[12-13],但受限于相应靶向基因的表达[14]。外放疗是无法手术或手术后减少局部复发率的有效治疗手段[4, 15],但需要较高的剂量并且有较大的不良作用[5, 16-17]。近距离治疗被认为是高度适形、微创且不良反应小的放疗手段。其能在局部靶区形成高辐射剂量的同时,对周围非靶区组织造成尽可能少的照射[6],产生较少远期不良反应。迄今为止,125I近距离放疗在儿少期头颈部肿瘤治疗中有其优势,并取得较满意的疗效[6, 18-19]。本文初步提出儿童头颈部交界性肿瘤近距离治疗的靶区及剂量学参数设计方案,并验证其疗效及不良反应。
科学严谨的剂量分布范围及剂量参数是近距离治疗达到满意的局部控制率并减少不良反应的关键。合适的剂量分布范围的确定,能够在保证肿瘤大体得到足够辐射剂量的同时保护周边正常组织。而合适的剂量参数的确定,能够提升肿瘤细胞杀伤率的同时减少不良反应的发生。因此剂量范围及剂量参数都是体现近距离治疗高度适形、不良作用小等特点的关键因素[6-7]。
确定近距离治疗儿少期头颈部交界瘤的剂量范围,亦即靶区,需要首先明确肿瘤大体边界。临床上确定肿瘤大体边界常常是借助影像学手段来进行的,肿瘤大体边界精准的剂量覆盖有重要的意义,这依赖于影像学检查上对肿瘤边界的显示。绝大多数交界性肿瘤均在MR上有较为清晰的肿瘤边界。炎性肌纤维母细胞瘤在MR的T1WIs和T2WIs均程低信号[20]。对于侵袭性纤维瘤,MR依靠更好的软组织间对比,能准确表现其边界及与周围正常肌肉、神经、血管等组织的关系[21]。因此,对于儿少期头颈部交界瘤,应以CT结合MR的形式确定范围。
交界性肿瘤的局部侵袭性导致其肉眼及影像学上难与周围正常组织区别,且有微小卫星病灶[3]。外放疗治疗交界性肿瘤时常以肿瘤外扩0.5~1.0 cm为靶区[22],故近距离治疗剂量分布范围亦需在保护头颈部危及器官前提下,在影像学上肿瘤大体的基础上扩大0.5~1.0 cm,以确保微小卫星病灶亦能得到足够的辐射剂量照射,减少复发率。
外放疗在治疗交界性肿瘤时,处方剂量一般为50~70 Gy,与头颈部恶性肿瘤的放疗剂量相似,5年无进展生存率或局部控制率为75%~88%,值得注意的是65%的复发发生在分布剂量 < 50 Gy的区域[17, 22-23]。亦有学者为了减少不良反应使用20 Gy低剂量放疗[16],但复发率高达83%。因而低剂量放疗被认为不适用于交界瘤治疗。本组病例的处方剂量为80~120 Gy,接近于既往报道近距离治疗头颈部恶性肿瘤的剂量[6, 24]。
在上述靶区及剂量设计下,本组病例随访期内局部控制率100%,单纯粒子植入病例完全缓解率71.4%。优于报道的手术联合外放疗或单纯外放疗的22%~25%的复发率[17, 23]。本组病例的急性不良反应全部为皮肤轻度反应(RTOG 1~2级),且均在随访期间逐渐减轻,1年内消失,未发现颅神经损伤反应。急性不良反应率为81.8%,略低于既往报道的100%,主要考虑为本组病例粒子活度18.5 MBq及处方剂量80~120 Gy较既往报道的应用于恶性肿瘤的18.5~25.9 MBq和90~120 Gy及18.5~33.3 MBq和140~160 Gy低[6, 25]。本研究急性不良反应RTOG分级与处方剂量间的Spearman相关性检验结果提示,急性不良反应与处方剂量呈正相关。
综上,125I粒子近距离治疗儿少期头颈部交界瘤,在良好的靶区及剂量学参数设计下,有满意的疗效及不良反应,是一种可行的单纯或辅助治疗手段。
利益冲突 所有研究者未因进行该研究而进行任何不正当的职务和财务利益,在此对研究的独立性和科学性予以保证
作者贡献声明 钟奕伟负责收集、分析数据和论文撰写;吕晓鸣、石妍协助完善数据及粒子计划的实施;刘树铭、张杰、郑磊负责审核患者粒子植入计划;郭传瑸负责论文写作的指导;张建国负责研究设计及论文写作的指导
| [1] |
Kasper B, Baumgarten C, Garcia J, et al. An update on the management of sporadic desmoid-type fibromatosis: A European consensus initiative between Sarcoma PAtients EuroNet (SPAEN) and European Organization for Research and Treatment of Cancer (EORTC)/Soft Tissue and Bone Sarcoma Group (STBSG)[J]. Ann Oncol, 2017, 28(10): 2399-2408. DOI:10.1093/annonc/mdx323 |
| [2] |
Dalton BG, Thomas PG, Sharp NE, et al. Inflammatory myofibroblastic tumors in children[J]. J Pediatr Surg, 2016, 51(4): 541-544. DOI:10.1016/j.jpedsurg.2015.11.015 |
| [3] |
Afifi MM, Elnouaem MI, Omar EM, et al. Oral and extraoral intermediate tumors: are MMP-9 and Ki-67 biomarkers correlated to their high recurrence rates?[J]. Appl Immuno Mol Morphol, 2020, 28(3): 229-236. DOI:10.1097/PAI.0000000000000703 |
| [4] |
Janssen ML, Van Broekhoven DL, Cates JM, et al. Meta-analysis of the influence of surgical margin and adjuvant radiotherapy on local recurrence after resection of sporadic desmoid-type fibromatosis[J]. Br J Surg, 2017, 104(4): 347-357. DOI:10.1002/bjs.10477 |
| [5] |
Paulino AC, Simon JH, Zhen W, et al. Long-term effects in children treated with radiotherapy for head and neck rhabdomyosarcoma[J]. Int J Radiat Oncol Biol Phys, 2000, 48(5): 1489-1495. DOI:10.1016/s0360-3016(00)00799-9 |
| [6] |
Chen P, Wu WJ, Yi ZQ, et al. 125I interstitial brachytherapy in management of pediatric skull base tumors[J]. Pediatr Blood Cancer, 2019, 66(5): e27622. DOI:10.1002/pbc.27622 |
| [7] |
Wu WJ, Huang MW, Zhang GH, et al. Mandibular growth in survivors of pediatric parotid gland carcinoma treated with interstitial brachytherapy[J]. Pediatr Blood Cancer, 2018, 65(9): e27223. DOI:10.1002/pbc.27223 |
| [8] |
Huang MW, Liu SM, Zheng L, et al. A digital model individual template and CT-guided 125I seed implants for malignant tumors of the head and neck[J]. J Radiat Res, 2012, 53(6): 973-977. DOI:10.1093/jrr/rrs046 |
| [9] |
赵一姣, 王勇, 黄明伟, 等. 近距离放射治疗用个性化导板的数字化设计方法[J]. 中华口腔医学杂志, 2014, 49(2): 115-118. Zhao YJ, Wang Y, Huang MW, et al. Digital design protocol of individual template for brachytherapy[J]. Chin J Stomatol, 2014, 49(2): 115-118. DOI:10.3760/cma.j.issn.1002-0098.2014.02.011 |
| [10] |
Cox JD, Stetz J, Pajak TF. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC)[J]. Int J Radiat Oncol Biol Phys, 1995, 31(5): 1341-1346. DOI:10.1016/0360-3016(95)00060-C |
| [11] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [12] |
Desmoid Tumor Working G. The management of desmoid tumours: a joint global consensus-based guideline approach for adult and paediatric patients[J]. Eur J Cancer, 2020, 127: 96-107. DOI:10.1016/j.ejca.2019.11.013 |
| [13] |
Theilen TM, Soerensen J, Bochennek K, et al. Crizotinib in ALK(+) inflammatory myofibroblastic tumors-current experience and future perspectives[J]. Pediatr Blood Cancer, 2018, 65(4): e26920. DOI:10.1002/pbc.26920 |
| [14] |
Butrynski JE, D'adamo DR, Hornick JL, et al. Crizotinib in ALK-rearranged inflammatory myofibroblastic tumor[J]. N Engl J Med, 2010, 363(18): 1727-1733. DOI:10.1056/NEJMoa1007056 |
| [15] |
Ding Y, Yang HY, Zhang D, et al. Diagnosis and treatment of inflammatory myofibroblastoma in children and adolescents[J]. Chin Med J (Engl), 2019, 132(9): 1110-1112. DOI:10.1097/CM9.0000000000000176 |
| [16] |
Lee DK, Cho YS, Hong SH, et al. Inflammatory pseudotumor involving the skull base: response to steroid and radiation therapy[J]. Otola Head Neck Surg, 2006, 135(1): 144-148. DOI:10.1016/j.otohns.2006.01.016 |
| [17] |
Baumert BG, Spahr MO, Von Hochstetter A, et al. The impact of radiotherapy in the treatment of desmoid tumours. An international survey of 110 patients. A study of the rare cancer network[J]. Radiat Oncol, 2007, 2: 12. DOI:10.1186/1748-717X-2-12 |
| [18] |
Hentz C, Barrett W. Efficacy and morbidity of temporary 125I brachytherapy in pediatric rhabdomyosarcomas[J]. Brachytherapy, 2014, 13(2): 196-202. DOI:10.1016/j.brachy.2013.09.011 |
| [19] |
Peraud A, Goetz C, Siefert A, et al. Interstitial iodine-125 radiosurgery alone or in combination with microsurgery for pediatric patients with eloquently located low-grade glioma: a pilot study[J]. Childs Nerv Syst, 2007, 23(1): 39-46. DOI:10.1007/s00381-006-0203-7 |
| [20] |
Patnana M, Sevrukov AB, Elsayes KM, et al. Inflammatory pseudotumor: the great mimicker[J]. AJR Am J Roentgenol, 2012, 198(3): W217-227. DOI:10.2214/AJR.11.7288 |
| [21] |
Otero S, Moskovic EC, Strauss DC, et al. Desmoid-type fibromatosis[J]. Clin Radiol, 2015, 70(9): 1038-1045. DOI:10.1016/j.crad.2015.04.015 |
| [22] |
Krengli M, Cena T, Zilli T, et al. Radiotherapy in the treatment of extracranial hemangiopericytoma/solitary fibrous tumor: study from the rare cancer network[J]. Radiat Oncol, 2020, 144: 114-120. DOI:10.1016/j.radonc.2019.11.011 |
| [23] |
Guadagnolo BA, Zagars GK, Ballo MT. Long-term outcomes for desmoid tumors treated with radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2008, 71(2): 441-447. DOI:10.1016/j.ijrobp.2007.10.013 |
| [24] |
Wu ZY, Wu WJ, Zheng L, et al. Efficacy of combined surgery and 125I seed brachytherapy for treatment of primary mucoepidermoid carcinoma of the parotid gland[J]. Head Neck, 2019, 41(9): 3219-3225. DOI:10.1002/hed.25813 |
| [25] |
Huang MW, Wu WJ, Lyu XM, et al. The role of 125I interstitial brachytherapy for inoperable parotid gland carcinoma[J]. Brachytherapy, 2018, 17(1): 244-249. DOI:10.1016/j.brachy.2017.09.017 |
 2022, Vol. 42
2022, Vol. 42


