2. 美中嘉和医学技术发展集团, 北京 100013;
3. 瓦里安医疗器械贸易(北京)有限公司, 北京 100176;
4. 海军军医大学卫生统计学教研室, 上海 200433
2. Concord Medical Group, Beijing 100013, China;
3. Varian Medical Systems, Beijing 100176, China;
4. Department of Health Statistics, Faculty of Medical Services, Naval Medical University, Shanghai 200433, China
外科手术是可切除胰腺癌的标准治疗方法,但多数胰腺癌患者在确诊时已发展为局部晚期或发生远处转移[1],无法进行根治性手术治疗。体部立体定向放射治疗(SBRT)是另一种可选择的局部治疗方法,它能在短时间内(通常为5 d)将高剂量的辐射能量传递到肿瘤组织,同时保护好肿瘤周边的正常组织[2-3]。与单纯化疗或联合传统常规分割外照射相比,SBRT的大分割放疗模式具有更好的疗效,已逐步成为胰腺癌治疗过程中非常重要的手段[4-7]。
目前,可应用于临床的SBRT设备较多,依托上海医学会肿瘤放射治疗分会立体定向放疗学组,前期已完成射波刀、Tomotherapy、Varian Edge、Varian Trilogy和伽玛刀在胰腺癌SBRT计划设计中的剂量学比较[8]。与光子治疗相比,质子放射治疗可以对肿瘤细胞造成更大的生物损伤,同时因为其物理学特性,可以更好地保护肿瘤后沿的正常组织[9-12]。近年来针对胰腺癌质子治疗的研究也逐渐增多,主要还是集中在不同分割模式[11]和剂量爬坡[13]带来的危及器官不良反应。本研究在前期5种不同光子治疗设备的研究基础上,进一步对10例患者的临床资料纳入质子调强治疗(intensity modulated proton therapy, IMPT)治疗计划与直线加速器的容积旋转调强治疗(volumetric modulated arc therapy, VMAT)治疗计划,并比较其在胰腺癌大分割放射治疗计划中的剂量学特性。
资料与方法1. 患者资料:回顾性分析海军军医大学第一附属医院2018年1月至10月期间使用射波刀进行立体定向放射治疗的10例胰腺癌患者临床资料。患者中位年龄64.5岁,治疗前通过超声内镜在胰腺肿瘤附近植入1~2枚金标用于治疗过程中的影像引导及追踪技术,待金标植入1周位置固定后进行CT定位(扫描条件为120 kVp、400 mAs、1.5 mm层厚无间隔螺旋扫描,扫描螺距为0.938)及计划设计评估和治疗。所有患者在接受定位和治疗前都被要求空腹4 h以上,尽可能保证其空腹状态,减小胃肠充盈不一致带来的位置差异。肿瘤区(GTV)的平均体积25.39 cm3,中位体积26.68 cm3;计划靶区(PTV)的平均体积37.89 cm3,中位体积38.51 cm3。
2. Varian Edge:Edge放射外科治疗系统是瓦里安公司专为放射外科治疗而设计的设备,在颅内和颅外治疗时都能实时跟踪患者的肿瘤,可以精确计算6个自由度的患者摆位误差并监测呼吸运动。Edge每10 ms执行一次精度检查,剂量率最高可达2 400 MU/min,高分辨率多叶准直器(HD MLC)中心叶片投影宽度仅2.5 mm,可实现高度聚焦的投照,保证了治疗剂量的精确实施。
Edge计划是跟瓦里安公司合作完成,计划系统采用瓦里安公司的Eclipse计划系统,版本号15.5。治疗计划采用6 MV X射线FFF模式,计划设计采用双弧共面VMAT技术,PO(photon optimizer)模块进行剂量优化,每个弧拥有178个控制点,最终剂量计算使用各向异性解析算法(anisotropic analytical algorithm, AAA)模型,计算网格为2.5 mm。
3. IBA Proteus® PLUS:Proteus® PLUS是比利时IBA公司推出的一款质子放疗解决方案。其通过360°旋转机架的束流传输、高精度的笔形束扫描(pencil beam scanning, PBS)专用机头(dedicated nozzle, DN)和基于锥形束计算机断层扫描(cone-beam computed tomography, CBCT)的影像引导实现了IMPT。IMPT通过对质子束精准度、深度、强度的调整,完成复杂肿瘤的高适形剂量分布,PBS支持的最大照射野为30 cm×40 cm。
Proteus® PLUS计划由美国弗罗里达质子中心设计,计划系统采用RaySearch公司的RayStation计划系统,版本号6.0 patch 1。治疗计划采用230 MeV质子束照射野,计划设计均采用2个后侧野(避开胃肠道)进行优化,束斑间隔为3.0 mm,最终剂量计算使用笔形束算法(pencil beam, PB)模型,计算网格为2.5 mm。
4. 治疗计划设计要求:本研究不考量质子和光子之间因摆位误差、机械误差以及质子不确定性对GTV外放的影响,统一对GTV均匀外放3 mm为PTV,若与胃和肠道过近则该方向减少外放或不予外放[4]。给予PTV 37.5 Gy/5次的处方剂量(质子计划为相对生物效应等效剂量),要求100%处方剂量覆盖90%以上的PTV[4-5]。
危及器官的勾画包括肝脏、脾脏、胃、十二指肠、空回肠、左肾脏、右肾脏和脊髓。其限制剂量标准与前期研究相同[7-8],均参照美国医学物理学家协会(AAPM)101号报告[14]。
5. 剂量评估:为尽可能减小两种不同计划系统造成的剂量体积体素统计误差,研究要求各平台输出患者计划的DICOM剂量文件,统一导入MIM软件平台后进行评估参数的提取。
靶区剂量评估参数包括PTV的最小剂量(Dmin)、平均剂量(Dmean)、最大剂量(Dmax)、98%的体积剂量(D98%)、2%的体积剂量(D2%)、适形指数(CI)、新适形指数(nCI)、均匀指数(HI)、梯度指数(GI)、PTV外各向2 cm处最大剂量(D2 cm)[15]、覆盖率(Coverage)、100%处方剂量包绕体积(100%_PD)、50%处方剂量包绕体积(50%_PD)、30%处方剂量包绕体积(30%_PD)、10%处方剂量包绕体积(10%_PD)。其中CI=PIV/TIV。式中,PIV为处方剂量所包绕的体积,cm3;TIV为处方剂量所包绕的靶区体积,cm3。nCI=CI/覆盖率。式中,覆盖率为靶区接受的超过处方剂量的体积占靶区总体积的百分比。HI=Dmax/RxDose。式中,Dmax为全局最大剂量,RxDose为处方剂量。GI=50%处方剂量包绕体积/100%处方剂量包绕体积[16]。
危及器官受量评估参数包括空回肠、胃、十二指肠、脊髓的最大点剂量和体积剂量以及左右肾脏的平均剂量和体积剂量,其中最大点剂量定义为0.035 cm3体积剂量。体积剂量方面,空回肠观察5 cm3体积剂量,胃观察10 cm3体积剂量,十二指肠观察5 cm3、10 cm3体积剂量,脊髓观察0.35 cm3体积剂量,肾脏观察2/3体积剂量。
6. 统计学处理:采用SPSS 21.0软件进行数据处理。数据服从正态分布的以x±s表示。使用配对t检验。不服从正态分布的数据以中位数(下四分位数、上四分位数)表示。使用Wilcoxon符号秩检验。所有评估指标中PTV D2%、CI、nCI、GI、D2 cm、100%_PD、50%_PD、30%_PD、10%_PD、空回肠Dmax、空回肠D5 cm3、胃Dmax、十二指肠Dmax、十二指肠D5 cm3、脊髓Dmax、脊髓D0.35 cm3以及左肾脏Dmean符合正态分布,PTV Dmin、PTV Dmean、PTV Dmax、PTV D98%、HI、覆盖率、胃D10 cm3、十二指肠D10 cm3、左肾脏D2/3、右肾脏Dmean及右肾脏D2/3不符合正态分布。P < 0.05为差异有统计学意义。
结果1. 两组计划靶区参数的剂量学差异:两组计划的剂量分布图见图 1。IMPT组和VMAT组的靶区参数的检验比较结果见于表 1。由表 1可知,两组的适形性方面(CI、nCI)差异没有统计学意义(P>0.05),VMAT组取得了更高的PTV Dmin、Dmax、D98%、D2%、HI和Coverage(t/Z=-4.63~-2.50, P < 0.05)以及更优的剂量梯度GI和D2 cm(t=2.83、5.32, P < 0.05)。剂量体积方面两组的100%_PD和50%_PD差异没有统计学意义(P>0.05),VMAT组获得了更低的30%_PD(t=2.38, P < 0.05),IMPT组则获得了更低的10%_PD(t=-7.47, P < 0.05)。
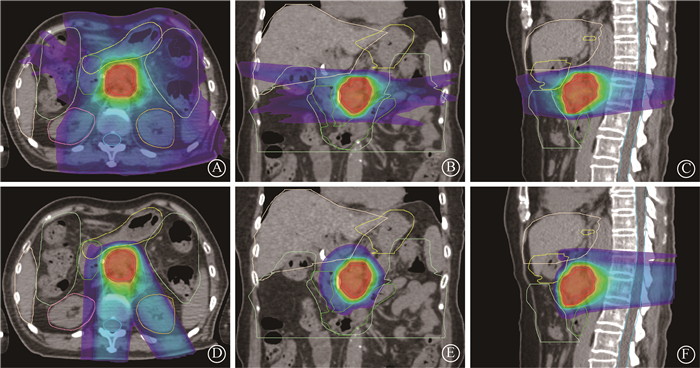
|
图 1 胰腺癌质子调强与光子容积旋转调强计划的剂量分布 A. VMAT计划横断面;B. VMAT计划冠状面;C. VMAT计划矢状面;D. IMPT计划横断面;E. IMPT计划冠状面;F. IMPT计划矢状面 Figure 1 Dose distributions of IMPT and VMAT for pancreatic cancer A. Transverse image of VMAT plan; B. Coronal image of VMAT plan; C. Sagittal image of VMAT plan; D. Transverse image of IMPT plan; E. Coronal image of IMPT plan; F. Sagittal image of IMPT plan |
|
|
表 1 IMPT组与VMAT组的靶区参数剂量学差异 Table 1 Dose differences in target areas informed by IMPT and VMAT group |
2. 两组计划危及器官参数的剂量学差异: IMPT组和VMAT组的危及器官参数的配对t检验比较结果见于表 2。由表 2可知,两组的空回肠、胃、十二指肠的最大剂量Dmax以及左肾的平均剂量Dmean差异没有统计学意义(P>0.05)。IMPT组在空回肠的体积剂量D5 cm3、胃的D10 cm3、十二指肠的D5 cm3及D10 cm3、左肾的D2/3、右肾的Dmean及D2/3上均低于VMAT组(t/Z=-8.12~-2.60, P < 0.05),但是IMPT组脊髓的Dmax和D0.35 cm3均高于VMAT组(t=7.30、6.77, P < 0.05)。在胃肠道的体积剂量保护方面,IMPT组均远远低于VMAT组(图 2)。
|
|
表 2 IMPT组与VMAT组的危及器官参数剂量学差异 Table 2 Dose differences in organs at risk (OARs) informed by IMPT and VMAT group |
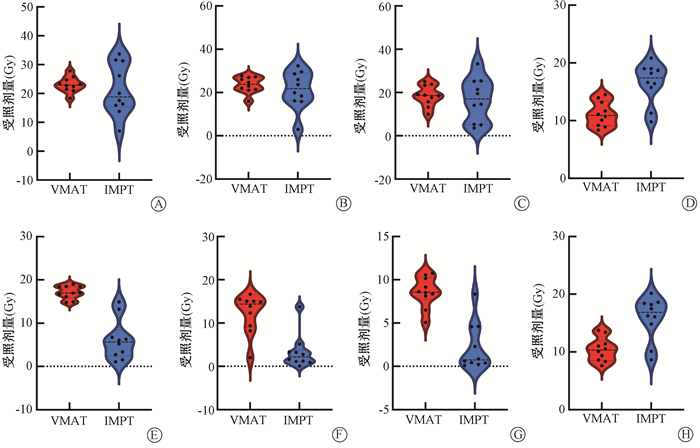
|
注:VMAT. 容积旋转调强治疗;IMPT. 质子调强治疗 图 2 空回肠、胃、十二指肠和脊髓的IMPT和VMAT计划受照剂量小提琴图 A.空回肠Dmax受照剂量;B. 胃Dmax受照剂量;C. 十二指肠Dmax受照剂量;D. 脊髓Dmax受照剂量;E. 空回肠D5 cm3受照剂量;F. 胃D10 cm3受照剂量;G. 十二指肠D10 cm3受照剂量;H. 脊髓D0.35 cm3受照剂量 Figure 2 Doses to the bowel, stomach, duodenum and spinal cord of IMPT and VMAT plans shown in violin plots A. Dmax of the bowel; B. Dmax of the stomach; C. Dmax of the duodenum; D. Dmax of the spinal cord; E. D5 cm3 of the bowel; F. D5 cm3 of the stomach; G. D5 cm3 of the duodenum; H. D5 cm3 of the spinal cord |
讨论
本研究是在前期已完成的五种光子放疗设备在胰腺癌立体定向放疗中剂量学比较基础上进行的进一步研究。前期研究依托五家不同单位完成,在Edge组与Trilogy组的结果可能存在部分经验差异而导致的设备间差异。故重新对这10例患者的临床资料基于Edge和VitalBeam在完全相同的射野布置下,仅变更了机器型号(Edge组使用FFF模式、HD MLC,VitalBeam组使用FF模式、Millennium 120 MLC),采用相同的优化条件设计治疗计划。VitalBeam组的CI优于Edge组,GI上则Edge组更低,同时Edge组的PTV Dmean和D2%更低,危及器官方面仅右肾Dmean有差异,其余方面二组差异没有统计学意义。因该结果与其他研究结果类似[17-19],且两组之间的差异较小,故不在此次文章中给予赘述,仅选取Edge组为代表的VMAT组和IMPT组进行光子和质子的剂量学比对。
质子治疗的优势主要源自其布拉格峰效应,PBS技术拥有非常良好的束流调制能力,可以实现非常好的剂量适形分布[20],故IMPT组的适形性与使用HDMLC的VMAT组差异没有统计学意义。IMPT组在PTV的Dmax、D2%、HI方面与VMAT组计划相比较均更低,说明IMPT在PTV内部的剂量分布更加均匀,与Trofimov等[21]研究结果一致。因为IMPT组的GI和D2 cm弱于VMAT组,为达到危及器官的最大点剂量限值,在贴近胃肠道方向上的PTV边缘剂量有所欠缺,导致PTV Dmin、D98%和覆盖率均低于VMAT组。IMPT组的覆盖率均值94.17%(93.24%~94.79%)略低于VMAT组的95.79%(93.40%~96.73%),但都满足计划设计提出的覆盖率>90%的要求[4-5]。另一方面,因IMPT采用的是质子笔形束扫描技术,在三维方向上主动扫描靶体积,考虑胃肠道内容物及其蠕动带来的不确定性对质子调强治疗可能带来的影响较大,IMPT的射野从患者后方及斜后方入射进行2个方向束流调制,所以本研究所采用的剂量梯度评估公式(GI和D2 cm)更多适用于多野聚焦的光子治疗,并不完全能体现质子在方向性上的剂量跌落梯度,可能需要寻找新的评估方法和指标。
危及器官保护方面,在空回肠、胃、十二指肠的最大剂量上,IMPT组和VMAT组差异无统计学意义,但是在其体积剂量方面,IMPT组均远远低于VMAT组。同时IMPT组的低剂量区域体积10%_PD均值641.75 cm3(369.93~840.23 cm3)远远低于VMAT组均值1 797.23 cm3(771.07~2 911.99 cm3),可见质子在保护胃肠道等危及器官和正常组织方面确实优于光子。但因为本次实验设计的IMPT组后野入射需要经过脊髓,所以脊髓受量Dmax和D0.35 cm3均高于VMAT组。
此外,质子射程及其治疗过程中存在较多不确定性。本研究所涉及的胰腺癌患者体内均存在1~2枚金标,同时为了避免束流与高对比不同介质交界面平行,以及避免束流通过横隔肌或可能在气体或液体之间变化的肠道等情况,本研究要求所有患者在接受定位和治疗前空腹4 h以上,尽可能保证其空腹状态时胃肠充盈的一致性,同时在IMPT计划设计时通过对束流入射角度的选择来减小治疗中的不确定性。本研究为量化比较IMPT和VMAT的剂量学差异,采用统一的PTV进行计划设计,但临床治疗中质子与光子计划不同,需要利用鲁棒性优化减小治疗中的不确定性,减小剂量扰动[22]。鲁棒性最优可以使用将CT图像中肠道设为气体或液体的不同图像集并同步做鲁棒最优,例如使用3.5%的射程不确定性和5 mm的摆位误差来解决问题,这也是后续进一步的研究需要考量的。
IMPT和VMAT均可实现满足临床要求的胰腺癌大分割放射治疗计划设计。IMPT在毗邻胰腺靶区的胃肠道组织最大受量上的保护与VMAT差异无统计学意义,但是在胃肠道的体积受量保护上和VMAT相比拥有极大优势,但是对射束肿瘤前缘的危及器官保护上可能弱于VMAT,所以在IMPT计划设计时需要考虑好入射方向。同时质子调强需要融入对其鲁棒性的优化以降低其不确定性。
利益冲突 无
作者贡献声明 曹洋森负责实验设计、数据收集和撰写论文;李左峰负责质子计划设计;徐宁负责VMAT计划设计;郭晓晶负责数据统计分析;张火俊负责指导实验和论文修改
| [1] |
Iacobuzio-Donahue CA, Fu B, Yachida S, et al. DPC4 gene status of the primary carcinoma correlates with patterns of failure in patients with pancreatic cancer[J]. J Clin Oncol, 2009, 27(11): 1806-1813. DOI:10.1200/JCO.2008.17.7188 |
| [2] |
Petrelli F, Comito T, Ghidini A, et al. Stereotactic body radiation therapy for locally advanced pancreatic cancer: A systematic review and pooled analysis of 19 trials[J]. Int J Radiat Oncol Biol Phys, 2017, 97(2): 313-322. DOI:10.1016/j.ijrobp.2016.10.030 |
| [3] |
Jung J, Yoon SM, Park JH, et al. Stereotactic body radiation therapy for locally advanced pancreatic cancer[J]. PLoS One, 2019, 14(4): e0214970. DOI:10.1371/journal.pone.0214970 |
| [4] |
Qing SW, Ju XP, Cao YS, et al. Dose escalation of stereotactic body radiotherapy (SBRT) for locally advanced unresectable pancreatic cancer patients with CyberKnife: Protocol of a phase I study[J]. Radiat Oncol, 2017, 12(1): 6. DOI:10.1186/s13014-016-0760-1 |
| [5] |
Zhu X, Li F, Ju X, et al. Prognostic role of stereotactic body radiation therapy for elderly patients with advanced and medically inoperable pancreatic cancer[J]. Cancer Med, 2017, 6(10): 2263-2270. DOI:10.1002/cam4.1164 |
| [6] |
de Geus S, Eskander MF, Kasumova GG, et al. Stereotactic body radiotherapy for unresected pancreatic cancer: A nationwide review[J]. Cancer, 2017, 123(21): 4158-4167. DOI:10.1002/cncr.30856 |
| [7] |
Zhu X, Cao Y, Liu W, et al. Stereotactic body radiotherapy plus pembrolizumab and trametinib versus stereotactic body radiotherapy plus gemcitabine for locally recurrent pancreatic cancer after surgical resection: An open-label, randomised, controlled, phase 2 trial[J]. Lancet Oncol, 2021, 22(8): 1093-1102. DOI:10.1016/S1470-2045(21)00286-2 |
| [8] |
上海医学会肿瘤放射治疗分会立体定向放疗学组, 曹洋森, 张建英, 等. 五种光子放疗设备在胰腺癌立体定向放疗中剂量学比较[J]. 中华放射肿瘤学杂志, 2021, 30(2): 156-163. SBRT Group of Radiation Oncology Committee of Shanghai Medical Association, Cao YS, Zhang JY, et al. Comparison of dose distributions among five radiotherapy apparatuses in stereotactic body radiation therapy for pancreatic cancer[J]. Chin J Radiat Oncol, 2021, 30(2): 156-163. DOI:10.3760/cma.j.cn113030-20190606-00214 |
| [9] |
Ng SP, Herman JM. Stereotactic radiotherapy and particle therapy for pancreatic cancer[J]. Cancers (Basel), 2018, 10(3): 75. DOI:10.3390/cancers10030075 |
| [10] |
Nichols RC, Huh S, Li Z, et al. Proton therapy for pancreatic cancer[J]. World J Gastrointest Oncol, 2015, 7(9): 141-147. DOI:10.4251/wjgo.v7.i9.141 |
| [11] |
Rutenberg MS, Nichols RC. Proton beam radiotherapy for pancreas cancer[J]. J Gastrointest Oncol, 2020, 11(1): 166-175. DOI:10.21037/jgo.2019.03.02 |
| [12] |
杨涛, 徐寿平, 解传滨, 等. 前列腺癌质子调强与光子容积旋转调强放疗计划质量评估[J]. 中华放射医学与防护杂志, 2020, 40(1): 19-25. Yang T, Xu SP, Xie CB, et al. Evaluation of plan quality for IMPT and VMAT in the treatment of patients with prostate cancer[J]. Chin J Radiol Med Prot, 2020, 40(1): 19-25. DOI:10.3760/cma.j.issn.0254-5098.2020.01.003 |
| [13] |
Yu Z, Hong Z, Zhang Q, et al. Proton and carbon ion radiation therapy for locally advanced pancreatic cancer: A phase I dose escalation study[J]. Pancreatology, 2020, 20(3): 470-476. DOI:10.1016/j.pan.2020.01.010 |
| [14] |
Benedict SH, Yenice KM, Followill D, et al. Stereotactic body radiation therapy: The report of AAPM Task Group 101[J]. Med Phys, 2010, 37(8): 4078-4101. DOI:10.1118/1.3438081 |
| [15] |
Li J, Galvin J, Harrison A, et al. Dosimetric verification using Monte Carlo calculations for tissue heterogeneity-corrected conformal treatment plans following RTOG 0813 dosimetric criteria for lung cancer stereotactic body radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2012, 84(2): 508-513. DOI:10.1016/j.ijrobp.2011.12.005 |
| [16] |
Li T, Ozhasoglu C, Burton S, et al. A method to improve dose gradient for robotic radiosurgery[J]. J Appl Clin Med Phys, 2015, 16(6): 333-339. DOI:10.1120/jacmp.v16i6.5748 |
| [17] |
Jia F, Xu D, Yue H, et al. Comparison of flattening filter and flattening filter-free volumetric modulated arc radiotherapy in patients with locally advanced nasopharyngeal carcinoma[J]. Med Sci Monit, 2018, 24: 8500-8505. DOI:10.12659/MSM.910218 |
| [18] |
Kumar L, Yadav G, Samuvel KR, et al. Dosimetric influence of filtered and flattening filter free photon beam on rapid arc (RA) radiotherapy planning in case of cervix carcinoma[J]. Rep Pract Oncol Radiother, 2017, 22(1): 10-18. DOI:10.1016/j.rpor.2016.09.010 |
| [19] |
Sun WZ, Chen L, Yang X, et al. Comparison of treatment plan quality of VMAT for esophageal carcinoma with: Flattening filter beam versus flattening filter free beam[J]. J Cancer, 2018, 9(18): 3263-3268. DOI:10.7150/jca.26044 |
| [20] |
Rana S, Cheng C, Zheng Y, et al. Dosimetric study of uniform scanning proton therapy planning for prostate cancer patients with a metal hip prosthesis, and comparison with volumetric-modulated arc therapy[J]. J Appl Clin Med Phys, 2014, 15(3): 4611. DOI:10.1120/jacmp.v15i3.4611 |
| [21] |
Trofimov A, Nguyen PL, Coen JJ, et al. Radiotherapy treatment of early-stage prostate cancer with IMRT and protons: A treatment planning comparison[J]. Int J Radiat Oncol Biol Phys, 2007, 69(2): 444-453. DOI:10.1016/j.ijrobp.2007.03.018 |
| [22] |
Albertini F, Hug EB, Lomax AJ. Is it necessary to plan with safety margins for actively scanned proton therapy?[J]. Phys Med Biol, 2011, 56(14): 4399-4413. DOI:10.1088/0031-9155/56/14/011 |
 2022, Vol. 42
2022, Vol. 42
