2. 山东第一医科大学(山东省医学科学院)预防医学科学学院(放射医学研究所), 济南 250062;
3. 山东大学齐鲁儿童医院, 济南 250022
2. College of Preventive Medical Sciences (Institute of Radiation Medicine), Shandong First Medical University (Shandong Academy of Medical Sciences), Jinan 250062, China;
3. Qilu Children's Hospital of Shandong University, Jinan 250022, China
脉管性疾病是一类由血管或淋巴管内皮细胞异常增生所引起的脉管肿瘤或畸形,是小儿常见的先天性软组织病变。脉管性疾病分为血管瘤(hemangioma)和脉管畸形(vascular malformations)两大类。婴幼儿血管瘤(infantile hemangioma,IH)是婴幼儿最常见的良性血管肿瘤,其发病率在婴幼儿为4%~5%。脉管畸形是一组先天性血管发育异常引起的疾病,青少年发病率较高(0.3%~1%)。过去,手术治疗是脉管性疾病的主要治疗方式,现在随着医学影像诊断技术和介入放射学的快速发展,介入治疗成为一线治疗方式。
相对于外科手术治疗方式,介入手术创伤小,不易损伤重要的血管、神经、肌肉组织和腺体,术中出血少,手术效果好,术后恢复快,无明显瘢痕,越来越多地应用于儿童脉管性疾病的治疗。然而,在治疗过程中暴露于低剂量电离辐射(IR)可能会产生长期的不利于健康的影响(随机和确定性)[1]。有调查表明,即使暴露于低剂量的IR也可能增加患癌症的风险[2-6],儿童对电离辐射相对敏感,尤其是处于生长发育期的幼儿,细胞分裂更新速度和范围明显高于成年人,对X射线的敏感性也远高于成年人[7]。外周血淋巴细胞中的染色体畸变是致癌的中间终点,也是癌症的长期预测因子[8-9]。
为了解脉管性疾病患儿在接受介入治疗的过程中接受的电离辐射是否对儿童造成染色体损伤,选取26名接受介入手术的脉管性疾病患儿,在知情同意的情况下,于术前和术后立刻采集外周血,观察外周血淋巴细胞dic+r率的表达情况,探讨血管介入术中接受的电离辐射对儿童染色体的影响,为介入手术个体化医疗照射提供临床依据。
资料与方法1. 研究对象:前瞻性收集26例接受介入治疗的良性脉管性疾病的患儿,其中10例男性,16例女性。年龄为2个月24天~18岁(中位年龄5岁),体重6.5~84 kg(中位体重18 kg)。临床诊断为脉管畸形22例,血管瘤3例及Klippel-Trenaunay综合征(K-T)1例,病灶部位主要在四肢及头面部。患儿的介入手术类型有影像引导经皮硬化术、经导管动脉硬化栓塞术、经导管动脉造影术、经导管动脉栓塞术,见表 1。排除过去6个月内的淋巴瘤或白血病,放疗或化疗史及过去3个月内的X射线检查。本研究使用的样本和医疗记录已获得山东第一医科大学伦理审查委员会批准(R202103030018)。所有患儿家属均书面知情同意对血液样本进行分析,方法按照国际医学组织理事会批准的指南进行[10]。
|
|
表 1 患儿基本信息 Table 1 The basic characteristic of the children |
2. 样本采集及培养:每个患者在介入术前和术后立刻采集外周静脉血1.2 ml,肝素钠抗凝,用无菌的1 ml注射器取0.5 ml肝素钠抗凝血加入含有10%胎牛血清、1%青霉素-链霉素、2%植物血凝素、预加秋水仙素的RPMI 1640培养基中(上海乐辰生物科技有限公司),37℃培养48 h。
3. 收获制片及染色:500 × g离心5 min,弃上清收获细胞,用37℃预热的0.075 mol/L KCl溶液低渗处理20 min,固定液(甲醇/冰醋酸=3 ∶1)1 ml预固定后500 × g离心5 min,弃上清后重复固定2次,每次固定20 min,最后,根据沉淀量将细胞悬浮在0.8~1 ml的固定液中。将悬浮液的3滴(约20 μl) 滴在预先用冰水浸泡过的载玻片上,过火。染色体玻片用5%的姬姆萨染液染色3 min,蒸馏水冲洗后晾干。
4. 图像捕捉和染色体分析:MetaSystems染色体自动扫描分析系统(德国Carl Zeiss公司)在AutoCapt模式下捕捉拍摄染色中期细胞图像。根据国际原子能机构(IAEA)手册(IAEA 2011)[11],由两名经验丰富的分析人员对染色体畸变情况进行分析。利用选定的中期图像,对所有满足分析条件(45~47条染色体,分散良好)可观察到的染色体图像进行分析,每个样本分析中期分裂像数为360~3 900个,计数双着丝粒染色体、三着丝粒染色体、着丝粒环,分析时将三着丝粒染色体换算成双着丝粒体,1个三着丝粒染色体记为2个双着丝粒体[12]。
5. 剂量资料收集:儿童的受照剂量资料均来自X射线血管造影机自动生成的剂量报告,采集的数据包括剂量面积乘积(DAP)值、累积剂量(CD)值等信息,并对收集的DAP值及CD值进行了剂量校正,根据Ubeda等[13]的方法,儿童介入术后估算有效剂量的方法估算有效剂量E。
6. 统计学处理:用SPSS 26.0软件进行分析。数据分析前对数据进行正态性及方差齐性检验,患儿的体重、染色体dic+r率、累积DAP值、CD值均不符合正态分布,用中位数(M)描述;各组间的比较采用非参数检验,两两比较采用LSD检验,采用Possion回归分析评价dic+r率与年龄、性别、体重、E之间的关系。P < 0.05为差异有统计学意义。
结果1. 儿童介入术中接受的电离辐射剂量及手术前后染色体畸变情况:患儿接受介入手术后均有不同程度的染色体畸变增加,部分患儿的外周血淋巴细胞中观察到含多个畸变的细胞,见图 1。介入手术前后染色体dic+r率、CD值、累积DAP值及E均有非常大的离散度。26名患儿中最大CD值和DAP值均为一名眉心静脉畸形的3岁男性患儿,分别为6 777 mGy和1 754.57 Gy·cm2,最小DAP值为1.92 Gy·cm2,是一名右胸静脉畸形的7个月的女性患儿,最小CD值为一名左下肢静脉畸形的1岁9个月的男性患儿,为9.06 mGy,这3名患儿的术前均未观察到染色体畸变,dic+r率为0,术后dic+r率分别为24.7×10-3、9.44×10-3、7.7×10-3。26例患儿术前的dic+r率为0~1.43×10-3,平均0.31×10-3;术后dic+r率显著增高,为0~95.83×10-3,平均20.23×10-3,与术前相比,差异有统计学意义(U=647, P < 0.01)。
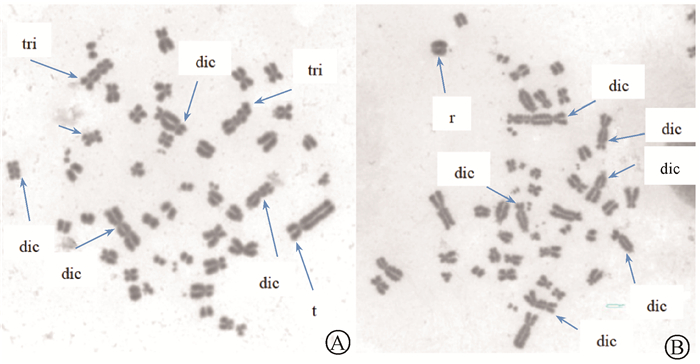
|
注:dic.双着丝粒体;tri.三着丝粒体;r.着丝粒环;t.易位 图 1 介入术后儿童外周血淋巴细胞中期分裂相中的染色体畸变 A.病例1;B.病例2 Figure 1 Chromosome aberrations in the metaphase phase of peripheral blood lymphocytes of children after interventional operation A. Case 1; B. Case 2 |
2. 不同性别患儿的染色体dic+r畸变情况分析:结果列于表 2,非参数检验显示术前和术后的dic+r率在男女性别间差异无统计学意义(P>0.05)。
|
|
表 2 不同性别患儿的染色体dic+r畸变情况比较(×10-3) Table 2 Comparison of dic+r rates in children with vascular disease of different genders(×10-3) |
3. 不同年龄患儿的染色体dic+r畸变情况分析:结果如表 3所示,非参数检验结果表明,不同年龄组儿童间术前术后dic+r率差异均无统计学意义(P>0.05)。
|
|
表 3 不同年龄组患儿染色体dic+r畸变情况比较(×10-3) Table 3 Comparison of dic+r rates in children with vascular disease of different ages(×10-3) |
4. 不同部位病灶患儿术后dic+r畸变情况分析:结列于表 4,非参数检验结果表明按不同病灶部位分组,各组间术前和术后染色体畸变差异无统计学意义(P>0.05)。
|
|
表 4 同病灶部位患儿介入术后染色体畸变情况(×10-3) Table 4 Chromosomal aberrations in children with different lesion sites after intereventional procedure(×10-3) |
5. 患儿术后染色体畸变明显增加及无明显变化的情况分析:介入术后外周血淋巴细胞dic+r率 < 3×10-3和>40×10-3的患儿基本情况列于表 5,26名患儿中术后染色体dic+r率高于40×10-3的有4名,4人中有3人为多发血管瘤,另外1例畸变率高达95.83×10-3的患儿是右大腿静脉畸形。染色体dic+r率低于3×10-3的6名患儿均为静脉畸形,其中有5例病灶部位均在四肢,另外1例为左面部静脉畸形,详见表 5。
|
|
表 5 患儿介入术后染色体畸变的变化情况 Table 5 Change in chromosomal aberrations in children after procedure |
6. 影响患儿介入术后的dic+r率的因素分析:以研究对象dic+r率为因变量,以性别、年龄、体重、E等因素为自变量,进行Possion回归分析。结果显示,年龄 < 5岁的患儿术后发生染色体dic+r的风险是年龄≥5岁患儿的1.455倍(Z=2.79,P < 0.05);体重 < 20 kg的患儿术后发生染色体dic+r风险是体重>20 kg患儿的2.275倍(Z=5.84,P < 0.05);E>50 mSv的患儿发生染色体dic+r的风险是E < 10 mSv的1.202倍(P> 0.05),是10 < E < 50 mSv患儿风险的85.6%(Z=-3.67,P < 0.05)。性别对术后染色体dic+r率未见明显影响(P>0.05),结果见表 6。
|
|
表 6 患儿术后dic+r率相关影响因素的Possion回归分析 Table 6 Possion regression analysis of influencing factors related to dic+r rate after interventional procedure |
讨论
介入治疗方式已经成为儿童脉管性疾病的一线治疗方式,术中射线对儿童的健康影响是医生和患者家属关注的焦点。本研究对接受介入治疗的脉管性疾病患儿进行了双着丝粒检测以确定在术中低剂量照射下是否会发生染色体畸变。白家瑢等[14]对496例先天性心脏病患儿介入术中接受的电离辐射剂量进行统计分析后,同样用Ubeda等[14]报道的方法估算出E为0.83~3.73 mSv。儿童CT检查中,0~5岁儿童平均E约5.5 mSv,心脏CT检查平均E为1.5~3.2 mSv[15-16],与白家瑢等[15]报道的先心病患儿介入术中接受的E相当。Abe等[17]对10例接受了CT扫描的儿童进行了dic畸变分析后发现,CT扫描后每2 000个中期分裂相中的dic数较扫描前增加,差异有统计学意义,CT扫描后平均dic率为4.5×10-3。Shi等[18]报道带有端粒和着丝粒PNA探针的FISH方法检测了CT扫描后外周血淋巴细胞中的dic+r,结果发现CT扫描后dic+r率较扫描前显著性增加并存在个体差异,平均dic+r率为7.2×10-3。而早在2006年就有学者报道过曾经接受过介入治疗的先天性心脏病患者多年后外周血淋巴细胞染色体畸变显著性高于对照组。Gao等[19]对70名接受介入治疗的先心病患儿和51名接受心内直视手术的先心病患儿进行了外周血淋巴细胞染色体畸变分析,发现暴露组患儿总染色体畸变率和所有染色体类型畸变均高于对照组。以上的研究对象都是接受了3 mSv左右剂量照射的人群,本研究中的26名接受介入手术的脉管性疾病患儿估算的E为1.5~1 561.57 mSv,中位E为16.48 mSv,平均107.02 mSv,远远超过3 mSv。
正常健康人群的双着丝粒染色体的自发畸变率很低,约为1/1 000~1/2 000[20],着丝粒环的自发畸变率更低,因此,通常把着丝粒环与双着丝粒结合起来进行染色体畸变分析。本研究观察了26例患儿术前和术后外周血淋巴细胞dic+r率,结果显示介入术前患儿的dic+r水平与正常人群的自发畸变率相当,术后dic+r率明显高于术前,有4例患儿的术后dic+r率甚至超过了40×10-3。男女性别之间、各年龄组之间以及不同的病灶部位患儿之间的术后dic+r率差异均无统计学意义,术后dic+r率与年龄、体重、DAP、CD及E值之间并无剂量效应关系。这与Abe等[17]报道的成人接受CT扫描后外周血淋巴细胞染色体DIC增加数与有效剂量之间无相关性一致。但是对术后染色体畸变率显著增高和无显著变化的患儿资料进行分析后发现,4例术后dic+r率超过40×10-3的患儿中,有3例均为多发的血管瘤或血管瘤伴脉管畸形,4例患者的E分别为14.86、3.1、100.53、36.72 mSv,1例患儿的E值与之前报道的CT扫描的剂量相当,其他几例的E值均较高,有1例超过了100 mSv。而6例dic+r率无明显变化的患儿均为脉管畸形患儿,其中5例患儿的病灶均在四肢。6例患儿中有5例的E值较低,与CT扫描的剂量相当,但是也有1例患儿的E值超过了100 mSv。分析这可能与单纯的四肢脉管畸形手术后过程比较简单,故接受的辐射剂量相对较低,多发病灶的手术过程相对复杂,故接受的辐射剂量相对较高。从回归分析的结果来看,年龄、体重和E值均与术后dic+r率有一定的相关性,年龄 < 5岁和体重 < 20 kg的患儿在接受介入手术后发生dic+r畸变的风险相对较高。Gomolka等[21]曾经报道过新生儿和年龄低于5岁的幼儿接触一定剂量照射后,发生DIC的风险是成人的1.5倍,E值范围在10~50 mSv的患儿发生dic+r畸变的风险要高于E < 10 mSv和E>50 mSv的患儿,但dic+r率与E值之间并无良好的量效关系,并存在E值同样是100 mSv,患儿dic+r率分别为95.83×10-3和0.91×10-3。畸变率相差巨大,故推测加大分析的样本量或许能观察到一定的剂量效应关系,但是同时可能也存在对电离辐射高度敏感的个体。
综上所述,脉管性疾病患儿在接受介入手术后外周血淋巴细胞染色体畸变增加,畸变增加的程度或许与手术的复杂程度有一定的关系,但是需要更多的样本来进行分析验证,不同的患儿之间存在对电离辐射敏感程度的差异。因此,儿童介入手术的正当化与防护工作需引起高度重视。在选择介入手术时应充分考虑手术的利弊,对于低年龄、低体重患儿更要充分评估介入手术的风险,并尽可能减少术中透视时间,同时加强儿童介入术时辐射敏感器官的屏蔽防护,将辐射损伤降低到尽量低的程度,这对于降低儿童接受医疗照射后远期癌症的发生率具有重要意义。
利益冲突 无
作者贡献声明 马娅负责数据整理与分析、论文撰写与修改,并参与整个实验过程;侯殿俊参与了染色体阅片工作;郭磊、宋丹负责样本采集工作;朱伟、李卫国、毛雪松、方连英参与了染色体制备工作;王仲文负责项目整体设计,指导论文撰写及修改
| [1] |
Ansari A, Kleinhans K, Boice JD. Potential health effects of low dose radiation and what it means to the practice of radiation protection[J]. J Radiol Prot, 2019, 39(4): E9-E13. DOI:10.1088/1361-6498/ab3fea |
| [2] |
Mathews JD, Forsythe AV, Brady Z, et al. Cancer risk in 680, 000 people exposed to computed tomography scans in childhood or adolescence: data linkage study of 11 million Australians[J]. BMJ, 2013, 346: f2360. DOI:10.1136/bmj.f2360 |
| [3] |
Pearce MS, Salotti JA, Little MP, et al. Radiation exposure from CT scans in childhood and subsequent risk of leukaemia and brain tumours: a retrospective cohort study[J]. Lancet, 2012, 380(9840): 499-505. DOI:10.1016/S0140-6736(12)60815-0 |
| [4] |
Piotrowski I, Kulcenty K, Suchorska WM, et al. Carcinogenesis induced by low-dose radiation[J]. Radiol Oncol, 2017, 51(4): 369-377. DOI:10.1515/raon-2017-0044 |
| [5] |
Suzuki K, Yamashita S. Low-dose radiation exposure and carcinogenesis[J]. Jpn J Clin Oncol, 2012, 42(7): 563-568. DOI:10.1093/jjco/hys078 |
| [6] |
Hauptmann M, Daniels RD, Cardis E, et al. Epidemiological studies of low-dose ionizing radiation and cancer: summary bias assessment and meta-analysis[J]. J Natl Cancer Inst Monogr, 2020, 2020(56): 188-200. DOI:10.1093/jncimonographs/lgaa010 |
| [7] |
牛亚婷, 苏垠平, 牛延涛, 等. 儿童CT扫描致白血病和脑瘤风险的队列研究meta分析[J]. 中国辐射卫生, 2020, 29(1): 31-36. Niu YT, Su YP, Niu YT, et al. Meta-analysis of cohort studies on radiation exposure from CT scans in childhood and subsequent cancer risk of leukaemia and brain tumors[J]. Chin J Radiol Health, 2020, 29(1): 31-36. DOI:10.13491/j.issn.1004-714X.2020.01.007 |
| [8] |
Bonassi S, Znaor A, Ceppi M, et al. An increased micronucleus frequency in peripheral blood lymphocytes predicts the risk of cancer in humans[J]. Carcinogenesis, 2007, 28(3): 625-631. DOI:10.1093/carcin/bgl177 |
| [9] |
Andreassi MG, Ait-Ali L, Botto N, et al. Cardiac catheterization and long-term chromosomal damage in children with congenital heart disease[J]. Eur Heart J, 2006, 27(22): 2703-2708. DOI:10.1093/eurheartj/ehl014 |
| [10] |
American Society of Law, Medicine and Ethics. International guidelines for ethical review of epidemiological studies[J]. Law Med Health Care, 1991, 19(3-4): 247-258. DOI:10.111/j.1748-720x.1991.tbol822.x |
| [11] |
International Atomic Energy Agency. Cytogenetic dosimetry: applications in preparedness for and response to radiation emergencies[M]. Vienna: IAEA, 2011.
|
| [12] |
国家卫生与计划生育委员会. GBZ/T 248-2014放射工作人员职业健康检查外周血淋巴细胞染色体畸变检测与评价[S]. 北京: 中国标准出版社, 2014. National Health and Family Planning Commission, China. GBZ/T 248-2014 Test and assessment of chromosomal aberrations on occupational health examinations for radiation workers[S]. Beijing: Standards Press of China, 2014. |
| [13] |
Ubeda C, Miranda P, Vano E, et al. Organ and effective doses from paediatric interventional cardiology procedures in Chile[J]. Phys Med, 2017, 40: 95-103. DOI:10.1016/j.ejmp.2017.07.015 |
| [14] |
白家瑢, 王凤, 吴琳, 等. 先天性心脏病患儿介入治疗的辐射剂量[J]. 中国介入心脏病学杂志, 2019, 27(8): 447-451. Bai JR, Wang F, Wu L, et al. Radiation dose in pediatric interventional therapy for congenital heart diseases[J]. Chin J Intervent Cardiol, 2019, 27(8): 447-451. DOI:10.3969/j.issn.1004-8812.2019.08.005 |
| [15] |
Obara H, Takahashi M, Kudou K, et al. Estimation of effective doses in pediatric X-ray computed tomography examination[J]. Exp Ther Med, 2017, 14(5): 4515-4520. DOI:10.3892/etm.2017.5102 |
| [16] |
Hui P, Goo HW, Du J, et al. Asian consortium on radiation dose of pediatric cardiac CT (ASCI-REDCARD)[J]. Pediatr Radiol, 2017, 47(8): 899-910. DOI:10.1007/s00247-017-3847-4 |
| [17] |
Abe Y, Miura T, Yoshida MA, et al. Increase in dicentric chromosome formation after a single CT scan in adults[J]. Sci Rep, 2015, 5: 13882. DOI:10.1038/srep13882 |
| [18] |
Shi L, Fujioka K, Sakurai-Ozato N, et al. Chromosomal abnormalities in human lymphocytes after computed tomography scan procedure[J]. Radiat Res, 2018, 190(4): 424-432. DOI:10.1667/RR14976.1 |
| [19] |
Gao Y, Wang P, Su Y, et al. Cardiac catheterization procedures in children with congenital heart disease: Increased chromosomal aberrations in peripheral lymphocytes[J]. Mutat Res Genet Toxicol Environ Mutagen, 2020, 852: 503163. DOI:10.1016/j.mrgentox.2020.503163 |
| [20] |
Ainsbury EA, Bakhanova E, Barquinero JF, et al. Review of retrospective dosimetry techniques for external ionising radiation exposures[J]. Radiat Prot Dosim, 2011, 147(4): 573-592. DOI:10.1093/rpd/ncq499 |
| [21] |
Gomolka M, Oestreicher U, Rößler U, et al. Age-dependent differences in DNA damage after in vitro CT exposure[J]. Int J Radiat Biol, 2018, 94(3): 272-281. DOI:10.1080/09553002.2018.1419302 |
 2022, Vol. 42
2022, Vol. 42


