放射肠损伤是腹盆腔肿瘤放疗以及放射事故受照患者的主要不良反应,限制了腹部恶性肿瘤根治性放疗,降低了放疗可以达到的肿瘤治愈率,也限制了放射事故受害者的生存[1-3]。小肠组织增殖迅速,对电离辐射高度敏感,但目前对放射肠损伤发病机制研究尚不深入,其发病机制等问题亟待解决。
肉碱棕榈酰转移酶I(carnitine palmitoyltransferase 1, CPT1)是脂肪酸β氧化(fatty acid β-oxidation,FAO)通路中的限速酶,催化长链酰基辅酶A酯向肉碱转移生成相应的酰基肉碱,从而将长链脂肪酸从细胞溶质运输到线粒体基质中用于脂肪酸β氧化,为细胞提供能量[4]。CPT1家族包括3个亚型:CPT1A、CPT1B和CPT1C。肝脏仅表达CPT1A,骨骼肌仅表达CPT1B,其他组织中广泛表达CPT1A和CPT1B。CPT1C是近年来在脑中新发现的亚型,但是该亚型不具有肉碱棕榈酰转移酶活性,通常不作为研究重点[5]。研究表明CPT1A和CPT1B这两个亚型在肿瘤细胞中呈高表达,在增殖、存活、迁移和放化疗抗性中发挥至关重要的作用,促进代谢应激下的癌症生存[6]。本课题组前期研究显示,60Co γ射线诱导大鼠肠损伤模型及小鼠小肠类器官模型中CPT1A和CPT1B的mRNA和蛋白水平显著增加(数据尚未发表)。为探讨CPT1A和CPT1B参与放射肠损伤中的调控,本研究拟探索60Co γ射线诱导大鼠小肠上皮细胞(IEC-6)中CPT1A和CPT1B蛋白表达变化,并进一步研究CPT1对受照细胞增殖的影响及相关分子机制。
材料与方法1. 试剂和仪器:高糖杜尔贝科改良伊格尔(DMEM)培养基购自美国HyClone公司,胎牛血清(FBS)购自美国GIBCO公司,重组人胰岛素购自中国索莱宝公司,Western blot蛋白提取液、二喹啉甲酸(BCA)蛋白定量试剂盒和增强化学发光液购自美国Thermo Fisher Scientific公司,5×蛋白上样缓冲液购自中国北京鼎国生物公司,磷酸酶抑制剂和蛋白酶抑制剂购自瑞士Roche公司,棕榈酸和乙莫克舍(ETO)购自美国Sigma公司,ERK1/2、JNK和β-肌动蛋白抗体购自美国Proteintech公司,p-ERK1/2(Thr202/Tyr204)、p-JNK(Thr183/Tyr185)抗体购自美国Cell Signaling Technologies公司,山羊抗兔和山羊抗小鼠抗体购自中国北京中杉金桥公司,Cell counting kit-8(CCK-8)试剂盒购自日本同仁化学研究所。Thermo Lab systems MK3酶标仪购自美国Thermo Fisher Scientific公司,发光检测成像系统ChemiDoc XRC+购自美国Bio-Rad公司。
2. 照射条件:北京辐照中心60Co γ射线源,源靶距为73 cm, 剂量率为1 Gy/min。用不同剂量对指数生长期的IEC-6细胞进行照射。
3. 细胞及细胞培养:大鼠小肠上皮细胞IEC-6由中国医学科学院放射医学研究所馈赠。用含5%FBS、0.01 mg/ml重组人胰岛素的高糖DMEM培养液于37℃、5% CO2恒温培养箱静置培养。
4. 棕榈酸及血清饥饿处理细胞:3.6 g牛血清白蛋白(BSA)加入9 ml 55℃预热磷酸缓冲盐溶液(PBS)溶液,配制40% BSA溶液;61.4 mg棕榈酸(PA)加入12 ml 0.1 mol/L NaOH溶液,置于75℃水浴锅中充分皂化,配制成20 mmol/L棕榈酸钠皂化液,分别使用0.22 μm细菌滤器过滤,按1∶1比例分装配制成10 mmol/L棕榈酸钠储存液。按如下所示配制并处理细胞:未处理组(含5% FBS的基础培养基)、棕榈酸处理组(含5% FBS的基础培养基+20 μmol/L棕榈酸)、血清饥饿处理组(含3% FBS的基础培养基)及血清饥饿联合棕榈酸处理组(含3% FBS的基础培养基+20 μmol/L棕榈酸)。
5. 蛋白提取及免疫印迹试验(Western blot)检测蛋白表达:用0、5、10或15 Gy 60Co γ射线照射指数生长期的IEC-6细胞,照射后24 h收集细胞,加入含磷酸酶抑制剂和蛋白酶抑制剂的细胞蛋白提取液,冰浴裂解10 min,14 000 × g、离心10 min,BCA法测定蛋白浓度,加入5×蛋白上样缓冲液混匀,于100℃金属浴中加热10 min,将蛋白变性。各组取等量蛋白(30~60 μg) 进行10%的聚丙烯酰胺凝胶垂直电泳,采用聚偏二氟乙烯(PVDF)转膜,5% 脱脂奶粉封闭1 h,ERK1/2、p-ERK1/2、JNK、p-JNK和β-肌动蛋白一抗4℃孵育过夜,二抗孵育1 h后,滴加增强化学发光液,使用ChemiDoc XRC+成像系统显影拍照。
6. 克隆形成实验:取指数生长期的IEC-6细胞制成单细胞悬液,以500个细胞/孔接种于6孔板中,每组设3个复孔,待贴壁后加入100 μmol/L ETO抑制剂,用0、1、2、4或8 Gy 60Co γ射线照射IEC-6细胞,继续培养14 d后终止培养,甲醇固定30 min,姬姆萨染液染色30 min,冲洗晾干,计数含有50个以上细胞的克隆。存活率=形成的克隆数/(接种细胞数×接种效率)。使用单击多靶模型拟合IEC-6细胞受到0、1、2、4或8 Gy照射后的存活曲线,计算ETO处理IEC-6细胞后的辐射增敏比(SER),SER>1表示辐射敏感性增加。
7. CCK-8检测细胞增殖:取指数生长期的IEC-6细胞,以2 000个细胞/孔接种于96孔板中,每组设5个复孔,待贴壁后加入200 μmol/L ETO抑制剂,用0或5 Gy 60Co γ射线照射IEC-6细胞,继续培养至48 h,加入10 μL -8试剂至每个孔中,在37℃下继续孵育2 h后,检测450 nm波长下吸光度(A450)值,计算细胞的相对增殖率。
8. 统计学处理:采用SPSS 28.0软件进行数据处理。计量资料经正态性检验符合正态分布用x±s表示,多组间数据比较经方差齐性检验采用单因素方差分析,组间比较采用最小显著差(LSD)方法;两组数据比较采用双尾t检验。P < 0.05为差异有统计学意义。
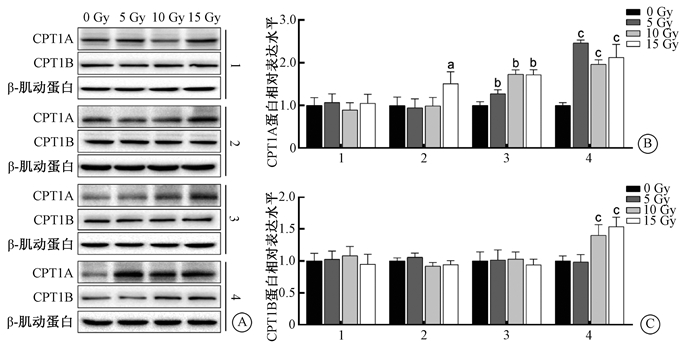
结果1. 60Co γ射线照射对IEC-6细胞CPT1A和CPT1B蛋白表达的影响:使用Western blot方法检测0、5、10、15 Gy 60Co γ射线照射IEC-6细胞24 h后CPT1A和CPT1B的蛋白表达水平。如图 1所示,未处理组中,CPT1A和CPT1B蛋白在照射后均未发生显著变化(F=0.51、0.45,P>0.05);棕榈酸处理组中,CPT1A蛋白在照射后发生显著变化(F=4.38, P < 0.05),与0 Gy相比,CPT1A蛋白在照射15 Gy后增加,差异具有统计学意义(t=-2.82,P < 0.05);血清饥饿处理组中,CPT1A蛋白在照射后发生显著变化(F=36.76, P < 0.05),与0 Gy相比,CPT1A蛋白在照射5、10或15 Gy后增加,差异具有统计学意义(t=-3.28、-8.72、-8.67,P < 0.05);血清饥饿联合棕榈酸处理组中,CPT1A蛋白和CPT1B蛋白在照射后发生显著变化(F=42.04、13.97,P < 0.05),与0 Gy相比,CPT1A蛋白在照射5、10或15 Gy后增加,CPT1B在照射10或15 Gy后增加,差异具有统计学意义(t=-10.69、-7.02、-8.23、-3.73、-5.05,P < 0.05)。该结果提示,60Co γ射线可诱导经棕榈酸、血清饥饿或两者联合处理后的IEC-6细胞中CPT1A和CPT1B蛋白表达水平增加。
|
注:1.未处理组;2.棕榈酸处理组;3.血清饥饿处理组;4.血清饥饿联合棕榈酸处理组。a与棕榈酸处理组0 Gy相比,t=-2.82,P < 0.05;b与血清饥饿组0 Gy相比,t=-3.28、-8.72、-8.67,P < 0.05;c与血清饥饿联合棕榈酸处理组0 Gy相比,t=-10.69、-7.02、-8.23、-3.73、-5.05,P < 0.05 图 1 60Co γ射线照射IEC-6细胞对CPT1A和CPT1B蛋白表达的影响 A. CPT1A和CPT1B的蛋白表达;B. CPT1A蛋白相对表达水平;C. CPT1B蛋白相对表达水平 Figure 1 The protein expression levels of CPT1A and CPT1B in IEC-6 cells after 60Co gamma-ray irradiation. A. Western blot assay of CPT1A and CPT1B proteins; B. The relative expression level of CPT1A protein; C. The relative expression level of CPT1B protein. |
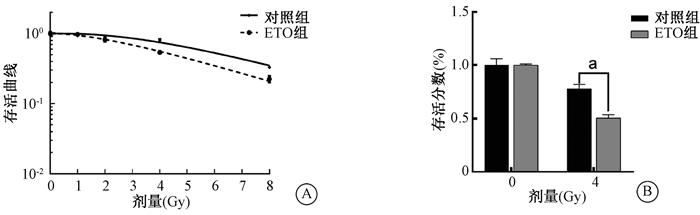
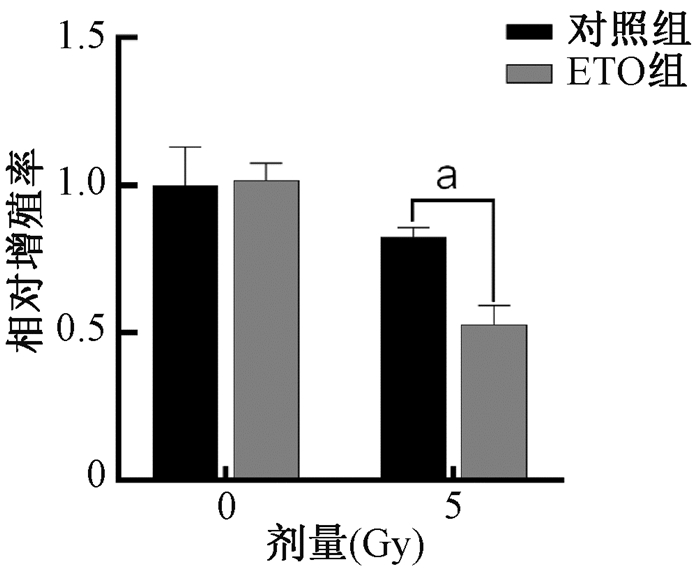
2. 抑制CPT1对60Co γ射线照射IEC-6细胞存活率及增殖的影响:与对照组相比,100 μmol/L ETO抑制IEC-6细胞CPT1酶活性后,在60Co γ射线照射各剂量点细胞存活分数皆下降,辐射增敏比(SER)为2.0(图 2A),其中4 Gy剂量点的存活分数显著降低,差异有统计学意义(图 2B,t=5.46,P < 0.05)。同时,经ETO处理后的IEC-6细胞在受照后相对增殖率也降低,差异具有统计学意义(图 3,t=13.22,P < 0.05)。表明CPT1抑制在一定程度上提高了IEC-6细胞的放射敏感性,降低该细胞放射后存活率及增殖。
|
注:ETO.乙莫克舍。a与相同剂量照射对照相比,t=5.464,P<0.05 图 2 抑制CPT1对60Co γ射线照射IEC-6细胞存活率的影响 A.存活曲线;B.存活分数 Figure 2 Influence of CPT1 inhibition on the survival of IEC-6 cells after 60Co gamma-ray irradiation A. Survival curves; B. Survival fractions after 4 Gy irradiation |
|
注:ETO.乙莫克舍。a与对照组5 Gy相比,t=13.22,P<0.05 图 3 抑制CPT1对60Co γ射线照射IEC-6细胞增殖的影响 Figure 3 Influence of CPT1 inhibition on the proliferation of IEC-6 cells after 60Co gamma-ray irradiation |
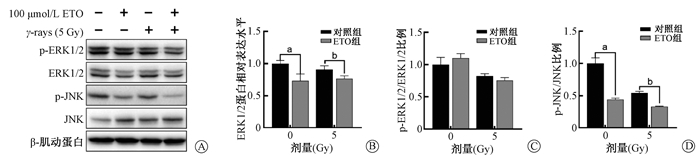
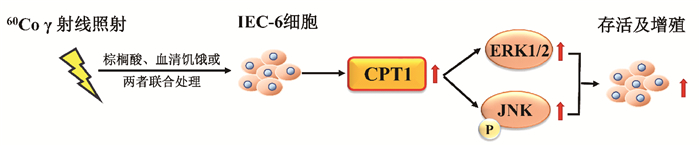
3. 抑制CPT1对60Co γ射线照射IEC-6细胞增殖通路的影响:为研究CPT1调控IEC-6细胞受照后存活率及增殖的分子机制,使用Western blot方法检测IEC-6细胞经100 μmol/L的ETO处理,受0或5 Gy 60Co γ射线照射后48 h增殖通路中细胞外信号调节激酶(ERK1/2),c-Jun氨基末端激酶(JNK)蛋白表达水平及其磷酸化水平。如图 4所示,与对照组相比,无论IEC-6细胞是否暴露于60Co γ射线,ETO处理组中的ERK1/2蛋白表达水平及JNK的磷酸化水平均发生下降,差异具有统计学意义(t=4.01、3.29、10.68、14.44,P < 0.05);ERK1/2的磷酸化水平差异无统计学意义。提示CPT1主要通过调控增殖通路ERK1/2的蛋白表达及JNK磷酸化水平,从而影响60Co γ射线照射后IEC-6细胞的增殖及存活(图 5)。
|
注:ETO.乙莫克舍。a与对照组0 Gy相比,t=4.01、10.68,P < 0.05;b与对照组5 Gy相比,t=3.29、14.44,P < 0.05 图 4 抑制CPT1对60Co γ射线照射IEC-6细胞增殖通路的影响 A.p-ERK1/2、ERK1/2、p-JNK和JNK的蛋白表达;B. ERK1/2蛋白相对表达水平;C. ERK1/2磷酸化比例;D. JNK磷酸化比例 Figure 4 Influence of CPT1 inhibition on the proliferation-related signaling proteins in IEC-6 cells after 60Co gamma-ray irradiation A. Western blot assay of p-ERK1/2, ERK1/2, p-JNK and JNK protein; B. The relative protein level of ERK1/2; C. The phosphorylation ratios of ERK1/2; D. The phosphorylation ratios of JNK |
|
图 5 60Co γ射线照射IEC-6细胞诱导CPT1表达增加,促进增殖示意图 Figure 5 The schematic diagram of 60Co gamma-rays increased CPT1 expression, which promoted the survival and proliferation of IEC-6 cells after irradiation |
讨论
小肠上皮细胞尤其是隐窝内的干细胞由于其迅速增殖更新的特点使其对电离辐射高度敏感,进而导致小肠上皮细胞供应不足,绒毛脱落,隐窝萎缩,黏膜结构破坏[7]。以往研究多关注电离辐射后肠道组织形态学变化[8]。本研究对60Co γ射线照射诱导IEC-6细胞损伤中CPT1A和CPT1B蛋白表达变化及其相关作用和分子机制进行了探讨,为放射肠损伤中分子生物学变化研究提供了理论基础。
CPT1A和CPT1B是调控长链脂肪酸氧化的限速酶,对细胞内酰基肉碱的水平发挥关键调控作用。如Wang等[9]研究发现CPT1激活后,棕榈酰肉碱合成增加。Zhao等[10]和Cheema等[11]研究发现,电离辐射可诱导机体内CPT1的代谢产物长链酰基肉碱显著增加,提示电离辐射诱导损伤中CPT1可能发挥重要作用。本课题组前期研究证实,电离辐射可以诱导大鼠肠损伤模型及小鼠小肠类器官模型中CPT1A和CPT1B的mRNA和蛋白水平显著增加。FAO通路位于生物调控系统的最下游,具有复杂的终末分化特征[12]。CPT1A和CPT1B调控FAO通路参与对电离辐射的响应,可能需要营养缺乏、CPT1的天然底物棕榈酸等联合作用。因此,本研究使用棕榈酸、血清饥饿或两者联合处理IEC-6细胞,结果表明,同体内研究不同,离体培养的IEC-6细胞中,60Co γ射线照射诱导CPT1A和CPT1B蛋白表达增加需要棕榈酸、血清饥饿或两者联合作用。已有研究表明,饥饿处理或棕榈酸刺激可诱导脂肪酸β氧化通路激活,进而成为细胞内重要的替代能源[13-14]。血清饥饿、棕榈酸或两者联合处理可能诱导IEC-6细胞中FAO通路激活,更加接近电离辐射诱导体内肠组织损伤中的真实反应。
CPT1A和CPT1B表达增加可促进肿瘤细胞的增殖、存活、迁移和放化疗抗性。如Schoors等[15]研究证实CPT1A可以促进FAO通路中脂肪酸为血管内皮细胞dNTP(脱氧核糖核苷三磷酸)的合成提供碳源,CPT1A的丢失导致内皮细胞增殖受损和血管萌芽缺陷。Camarda等[16]研究证实ETO抑制CPT1后,三阴性乳腺癌患者来源的异种移植物生长显著减慢。Han等[17]利用CPT1A基因敲除和CPT1特异性抑制剂ETO证实,CPT1在乳腺癌的抗放射性上发挥重要作用。此外,Mihaylova等[12]研究证实CPT1A的丢失会减少正常Lgr5+小鼠肠道干细胞数量,影响功能和增殖。本研究证实,抑制CPT1后,IEC-6细胞在受到60Co γ射线照射后存活及增殖也被抑制,对γ射线放射敏感性增加。上述研究共同表明,CPT1A和CPT1B不仅在肿瘤细胞的增殖中发挥重要作用,在60Co γ射线诱导正常IEC-6细胞损伤的增殖中同样发挥关键作用。
肠道细胞代偿性增殖潜能是影响辐射诱发肠损伤易感性的关键因素[18]。丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路中的ERK1/2和JNK与细胞增殖、分化、迁移、衰老和凋亡密切相关[19-20]。本研究证实,ETO抑制CPT1诱导60Co γ射线照射IEC-6细胞增殖通路中ERK1/2的蛋白表达,JNK磷酸化水平发生显著下降。类似Han等[17]研究,证实乳腺癌细胞中CPT1抑制导致ERK1/2和JNK的磷酸化水平下降,抑制乳腺癌辐射抗性细胞的增殖,重新使其对辐射致敏。提示60Co γ射线诱导正常肠细胞损伤中,CPT1主要通过调控增殖通路ERK1/2的蛋白表达及JNK磷酸化水平,从而影响60Co γ射线照射后IEC-6细胞的存活及增殖。
综上所述,棕榈酸、血清饥饿或两者联合处理时,60Co γ射线诱导IEC-6细胞中CPT1A和CPT1B表达增加,进而促进增殖通路中ERK1/2蛋白的表达和JNK的激活,最终调控IEC-6细胞的存活及增殖。本研究初步探索了CPT1A和CPT1B在放射性肠损伤中的作用及其机制,为放射性肠损伤的临床治疗和预防提供了理论基础和科学依据。
利益冲突 无
作者贡献声明 刘海翔负责实验操作和论文撰写;高玲、李爽、赵骅和田梅指导论文修改并协助实验操作;刘青杰指导整体研究方案与文章审校
| [1] |
Zhang H, Yan H, Zhou X, et al. The protective effects of resveratrol against radiation-induced intestinal injury[J]. BMC Complement Altern Med, 2017, 17(1): 410. DOI:10.1186/s12906-017-1915-9 |
| [2] |
Bhanja P, Norris A, Gupta-Saraf P, et al. BCN057 induces intestinal stem cell repair and mitigates radiation-induced intestinal injury[J]. Stem Cell Res Ther, 2018, 9(1): 26. DOI:10.1186/s13287-017-0763-3 |
| [3] |
Arnold M, Rutherford MJ, Bardot A, et al. Progress in cancer survival, mortality, and incidence in seven high-income countries 1995-2014(ICBP SURVMARK-2): a population-based study[J]. Lancet Oncol, 2019, 20(11): 1493-1505. DOI:10.1016/S1470-2045(19)30456-5 |
| [4] |
Shao H, Mohamed EM, Xu GG, et al. Carnitine palmitoyltransferase 1A functions to repress FoxO transcription factors to allow cell cycle progression in ovarian cancer[J]. Oncotarget, 2016, 7(4): 3832-3846. DOI:10.18632/oncotarget.6757 |
| [5] |
Virmani A, Pinto L, Bauermann O, et al. The carnitine palmitoyl transferase transferase (CPT) system and possible relevance for neuropsychiatric and neurological conditions[J]. Mol Neurobiol, 2015, 52(2): 826-836. DOI:10.1007/s12035-015-9238-7 |
| [6] |
Qu Q, Zeng F, Liu X, et al. Fatty acid oxidation and carnitine palmitoyltransferase I: emerging therapeutic targets in cancer[J]. Cell Death Dis, 2016, 7: e2226. DOI:10.1038/cddis.2016.132 |
| [7] |
赵文玉, 杨斯茗, 杨志敏, 等. 沉默Krüppel样因子5对电离辐射后大鼠小肠上皮IEC-6细胞生物学功能的影响[J]. 中华放射医学与防护杂志, 2020, 40(7): 500-506. W Y, Yang SM, Yang ZM, et al. Effects of Krüppel-like factor 5 gene silencing on biological functions of rat intestinal epithelial cells IEC-6 after radiation[J]. Chin J Radiol Med Prot, 2020, 40(7): 500-506. DOI:10.3760/cma.j.issn.0254-5098.2020.07.002 |
| [8] |
王津晗, 徐畅, 王彦, 等. 放射性肠损伤模型及其评价研究进展[J]. 国际放射医学核医学杂志, 2017, 41(1): 33-39, 44. Wang JH, Xu C, Wang Y, et al. Progress on the evaluating and establishing methods of radiation-induced intestinal injuries animal model[J]. Int J Radiat Med Nucl Med, 2017, 41(1): 33-39, 44. DOI:10.3760/cma.j.issn.1673-4114.2017.01.007 |
| [9] |
Wang T, Fahrmann JF, Lee H, et al. JAK/STAT3-regulated fatty acid beta-oxidation is critical for breast cancer stem cell self-renewal and chemoresistance[J]. Cell Metab, 2018, 27(1): 136-150. DOI:10.1016/j.cmet.2017.11.001 |
| [10] |
Zhao H, Xi C, Tian M, et al. Identification of potential radiation responsive metabolic biomarkers in plasma of rats exposed to different doses of cobalt-60 gamma rays[J]. Dose Response, 2020, 18(4): 1559325820979570. DOI:10.1177/1559325820979570 |
| [11] |
Cheema AK, Mehta KY, Rajagopal MU, et al. Metabolomic studies of tissue injury in nonhuman primates exposed to gamma-radiation[J]. Int J Mol Sci, 2019, 20(13): 3360. DOI:10.3390/ijms20133360 |
| [12] |
Mihaylova MM, Cheng CW, Cao AQ, et al. Fasting activates fatty acid oxidation to enhance intestinal stem cell function during homeostasis and aging[J]. Cell Stem Cell, 2018, 22(5): 769-778. DOI:10.1016/j.stem.2018.04.001 |
| [13] |
邓洁, 罗剑波, 彭聪, 等. CPT1A在能量应激时卵巢癌细胞生存中的调控作用[J]. 实用癌症杂志, 2021, 36(2): 191-194. Dend J, Luo JB, Peng C, et al. Regulation effect of CPT1A on survival of ovarian cancer cells during energy stress[J]. Pract J Cancer, 2021, 36(2): 191-194. DOI:10.3969/j.issn.1001-5930.2021.02.004 |
| [14] |
Sieber J, Weins A, Kampe K, et al. Susceptibility of podocytes to palmitic acid is regulated by stearoyl-CoA desaturases 1 and 2[J]. Am J Pathol, 2013, 183(3): 735-744. DOI:10.1016/j.ajpath.2013.05.023 |
| [15] |
Schoors S, Bruning U, Missiaen R, et al. Fatty acid carbon is essential for dNTP synthesis in endothelial cells[J]. Nature, 2015, 520(7546): 192-197. DOI:10.1038/nature14362 |
| [16] |
Camarda R, Zhou AY, Kohnz RA, et al. Inhibition of fatty acid oxidation as a therapy for MYC-overexpressing triple-negative breast cancer[J]. Nat Med, 2016, 22(4): 427-432. DOI:10.1038/nm.4055 |
| [17] |
Han S, Wei R, Zhang X, et al. CPT1A/2-mediated FAO enhancement-a metabolic target in radioresistant breast cancer[J]. Front Oncol, 2019, 9: 1201. DOI:10.3389/fonc.2019.01201 |
| [18] |
Chaves-Pérez A, Yilmaz M, Perna C, et al. URI is required to maintain intestinal architecture during ionizing radiation[J]. Science, 2019, 364(6443): eaaq1165. DOI:10.1126/science.aaq1165 |
| [19] |
Sun Y, Liu WZ, Liu T, et al. Signaling pathway of MAPK/ERK in cell proliferation, differentiation, migration, senescence and apoptosis[J]. J Recept Signal Transduct Res, 2015, 35(6): 600-604. DOI:10.3109/10799893.2015.1030412 |
| [20] |
Gkouveris I, Nikitakis N, Karanikou M, et al. JNK1/2 expression and modulation of STAT3 signaling in oral cancer[J]. Oncol Lett, 2016, 12(1): 699-706. DOI:10.3892/ol.2016.4614 |
 2022, Vol. 42
2022, Vol. 42


