2. 蚌埠医学院第一附属医院病理科 233000;
3. 蚌埠医学院第一附属医院分子诊断中心, 呼吸系病临床基础安徽省重点实验室 233000
2. Department of Pathology, the First Affiliated Hospital of Bengbu Medical College, Bengbu 233000, China;
3. Anhui Province Key Laboratory of Clinical and Preclinical Research in Respiratory Disease, Molecular Diagnosis Center, the First Affiliated Hospital of Bengbu Medical College, Bengbu 233000, China
宫颈癌的发病率和死亡率均居全球女性恶性肿瘤第4位[1],综合治疗模式下,放射治疗是宫颈癌的主要治疗手段之一,而远处转移是其治疗后的主要失败模式[2]。因此,探索宫颈癌放疗后远处转移的机制、寻找可能的治疗靶点是值得关注的科学问题。上皮间质转化(epithelial-mesenchymal transition, EMT)是指具有极性的上皮细胞向间质细胞表型转化的生物学过程[3]。研究已证实,EMT与肿瘤的远处转移密切相关[4]。然而,临床常规分割放疗模式下的电离辐射能否通过诱导EMT的发生,进而增加宫颈癌细胞的转移潜能,尚有待进一步确认。外泌体是由细胞通过外排作用释放出细胞外,具有脂质双分子层膜结构的纳米囊泡,直径为30~150 nm,携带有蛋白质、脂质、核酸等多种活性物质[5],这些活性物质作为外泌体作用的生物信息传递信号分子,与肿瘤的发生、进展、治疗抵抗等诸多进程密切相关[6]。有研究指出,电离辐射可通过诱导外泌体的分泌,从而调控辐射旁效应[7]。但外泌体是否参与了电离辐射诱导宫颈癌细胞EMT的过程,尚需进一步探索。本研究拟通过模拟宫颈癌临床常规分割的外照射过程,观察电离辐射诱导下,宫颈癌细胞EMT的发生情况,以及外泌体在此过程中的作用。
材料与方法1. 主要材料试剂:宫颈癌Siha细胞(上海富衡生物公司);DMEM培养基(以色列BI公司),胎牛血清(美国GIBCO公司),25 cm2培养瓶、10 cm培养皿、6孔板、Transwell培养体系、Matrigel胶(美国Corning公司);GW4869、外泌体浓缩液(ECS,中国宇玫博公司);E-cadherin、N-cadherin抗体,辣根过氧化酶(HRP)标记的山羊抗小鼠和山羊抗兔二抗(中国博士德公司)。
2. 细胞培养:Siha细胞培养在含10%胎牛血清和1%青链霉素双抗的DMEM培养基中,置于37℃、5% CO2条件下的细胞培养箱中。细胞融合度达到75%~85%时进行传代。
3. 辐射照射:Siha细胞均匀接种于25 cm2的培养瓶内,待细胞处于对数生长期时,模拟临床常规分割外照射过程。使用瑞典医科达公司Elekta Precise 1105直线加速器的6 MV X射线,467 cGy/min,源皮距100 cm,2 Gy/次隔日照射,共50 Gy/25次,将辐射照射后残存的细胞Siha-R用于后续实验。实验分组:对照组(Siha),辐照组(Siha-R),抑制剂组(Siha-R+GW4869)。
4. 形态学:在倒置显微镜下对生长融合度为50%左右的Siha和Siha-R细胞形态进行观察并拍照。
5. 蛋白印记实验:细胞融合度达80%左右提取总蛋白,蛋白浓度检测(BCA)法进行蛋白定量;总蛋白变性处理后,行SDS-PAGE电泳,蛋白电泳分离后转胶至聚偏二氟乙烯(PVDF)膜上,5% 脱脂牛奶封闭2 h,分别加入一抗E-cadherin(1 ∶ 1 000)、N-cadherin(1 ∶1 000)、CD63(1 ∶1 000)、TSG101(1 ∶1 000),4℃冰箱摇床孵育过夜;次日,二抗(1 ∶10 000)室温孵育2 h,曝光。
6. Transwell实验:侵袭实验用无血清的培养基按9 ∶1比例稀释Matrigel胶,取60 μl加到上室内铺胶,孵箱中过夜。将对数期生长期的细胞消化后用无血清的培养基重悬,向上室中加入200 μl细胞悬液,计2×104个细胞,下室中加入600 μl含血清的完全培养基。迁移实验不需要使用Matrigel胶,其余步骤均相同。间隔24 h取出小室,固定染色后拍照计数。
7. 外泌体分离提纯:细胞融合度达80%左右,收集上清并离心后以5 ∶1体积比例加入ECS试剂,涡旋振荡后离心弃上清,再取100 μl磷酸盐缓冲液(PBS)吹打重悬离心所得沉淀物,充分重悬后,再次离心保留上清液。
8. 透射电镜检测:将提取的外泌体溶于多聚甲醛溶液中,取5 μl外泌体悬液加到Formvar-carbon载样铜网上,PBS清洗后经戊二醛处理,后用双蒸水(ddH2O)清洗,再用草酸双氧铀液和甲基纤维素液处理,最后将干燥完全的铜网放在样品盒里,80 kV下拍摄。
9. 纳米粒径示踪分析(nanoparticle tracking analysis, NTA):用PBS稀释样本,采用德国Particle Metrix公司Zeta View PMX110仪器和ZetaView 8.04.02软件测量分析外泌体粒径大小和分布,使用110 nm聚苯乙烯颗粒进行校准,温度保持在26.20℃。
10. 统计学处理:所有实验独立重复3次,取均值。采用SPSS 25.0软件进行统计处理,数据经正态性检验符合正态分布,用x±s形式表示,两组间比较采用t检验。P < 0.05为差异有统计学意义。
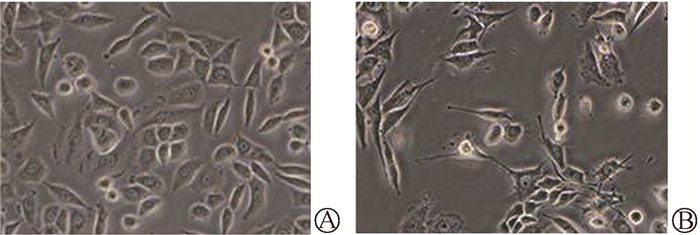
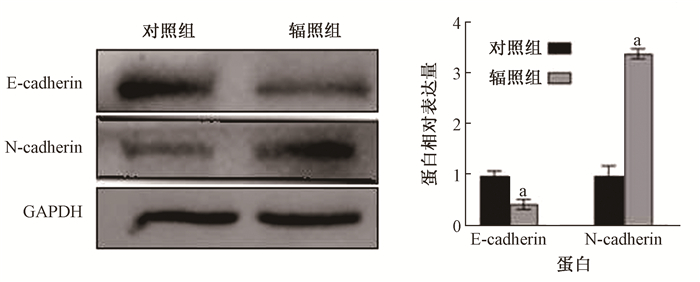
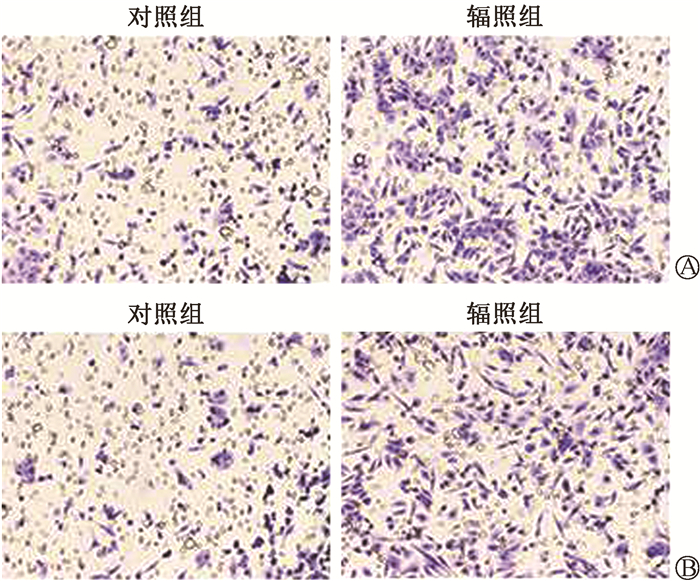
结果1. 电离辐射可诱导宫颈癌Siha细胞发生EMT:临床常规分割放疗模式的电离辐射诱导后,由图 1可见,Siha-R细胞伸出伪足,细胞间的间隙增大,部分细胞极性消失,发生类似于间质样细胞的改变。图 2显示,Siha-R细胞的E-cadherin蛋白表达减少,N-cadherin蛋白表达增加(t=9.66、41.61,P < 0.05)。另外,Siha-R细胞24 h后穿过Transwell膜和Matrigel基质胶的细胞数量增加(t=6.11、13.22,P < 0.05,图 3)。可见,临床常规分割放疗模式的电离辐射诱导宫颈癌Siha细胞发生了EMT相关事件。
|
图 1 50 Gy/25次X射线照射诱导Siha细胞发生形态学变化 ×200 A. 对照组;B. 辐照组 Figure 1 The morphological changes of Siha cells after X-rays irradiation of 50 Gy in 25 fractions ×200 A. Control group; B. Irradiation group |
|
注:a与对照组比较,t=9.66、41.61,P<0.05 图 2 蛋白印迹检测50 Gy/25次X射线照射后Siha细胞中E-cadherin和N-cadherin蛋白表达变化 Figure 2 Western blot assay of the protein expressions of E-cadherin and N-cadherin in Siha cells irradiated by 50 Gy X-rays in 25 fractions |
|
图 3 Transwell检测50 Gy/25次X射线照射诱导Siha细胞后迁移和侵袭能力变化 ×100 A. 迁移能力;B. 侵袭能力 Figure 3 Transwell assay of the migration and invasion of Siha cells irradiated by 50 Gy X-rays in 25 fractions ×100 A. Cell migration assay; B. Cell invasion assay |
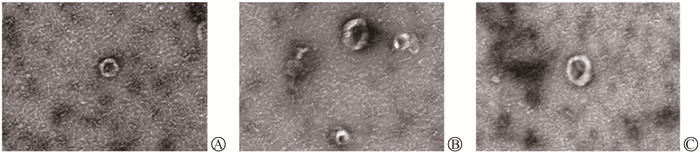
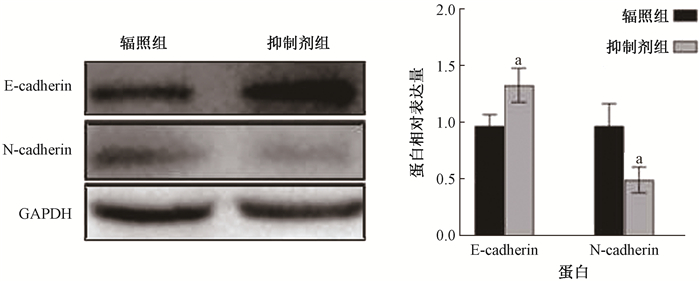
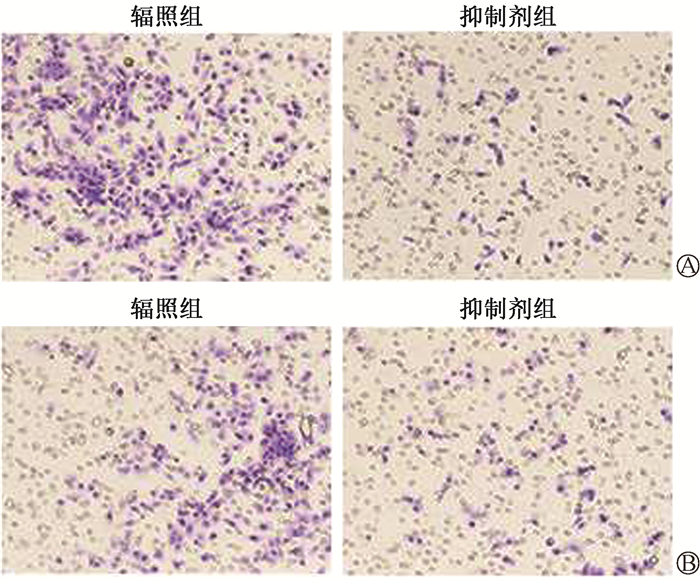
2. 外泌体参与了电离辐射促进宫颈癌Siha细胞EMT的调控过程:如图 4所示,分离提纯细胞上清液中的外泌体后通过透射电镜观察到外泌体盘状结构,提示成功分离提纯外泌体。纳米粒径示踪分析检测结果显示,电离辐射可诱导Siha细胞外泌体分泌量增加,加入外泌体抑制剂GW4869后,经辐照的Siha-R细胞外泌体分泌量降低(t=7.51、7.28,P < 0.05,表 1);细胞E-cadherin蛋白表达升高,N-cadherin蛋白表达降低(t=9.01、5.22,P < 0.05,图 5);Transwell迁移和侵袭能力均减弱(t=13.79、10.25,P < 0.05,图 6)。可见,外泌体参与了电离辐射促进宫颈癌Siha细胞EMT的调控过程。
|
A. 对照组;B. 50 Gy/25次X射线照射组;C. 50 Gy/25次X射线照射+抑制剂GW4869(10 μmol/L)处理组 图 4 电镜检测细胞上清液中外泌体形态检测 A. Control group; B. Irradiation group; C. GW4869 and irradiation treatment group Figure 4 Morphological characteristics of exosomes were observed by transmission electron microscopy |
|
|
表 1 纳米粒径示踪分析50 Gy/25次X射线照射或抑制剂GW4869(10 μmol/L)诱导Siha细胞后外泌体分泌量变化(×1010微粒/ml,x±s) Table 1 NTA measurement of the concentration of exosomes released from Siha cells with or without 50 Gy X-ray irradiation in 25 fractions and GW4869 treatment (×1010 particles/ml, x±s) |
|
注:a与抑制剂组比较,t=9.01、5.22,P<0.05 图 5 蛋白印迹检测GW4869诱导Siha-R细胞后E-cadherin和N-cadherin蛋白表达变化 Figure 5 Western blot assay of the expressions of E-cadherin and N-cadherin in Siha-R cells treated by GW4869 |
|
图 6 Transwell检测GW4869诱导Siha-R细胞后迁移和侵袭能力变化 ×100 A. 迁移能力;B. 侵袭能力 Figure 6 Transwell assay of the migration and invasion of Siha-R cells treated with GW4869 ×100 A. Migration assay; B. Invasion assay |
讨论
随着放疗技术的进步和多学科综合治疗理念的推进,宫颈癌的局部控制率得到了明显的提高,而放疗后远处转移则是目前临床上面临的主要挑战。既往研究提示,电离辐射可以通过触发细胞因子信号转导、影响免疫细胞募集等途径来改变肿瘤微环境,从而调控肿瘤复发、辐射抗性、多药耐药等恶性生物学行为[8-10],而电离辐射是否具有一定的诱导和刺激作用,促进放疗后肿瘤细胞发生远处转移,值得关注和研究。EMT涉及了细胞从分子到形态、功能等一系列的改变,而转移潜能正是肿瘤细胞EMT功能学变化的体现,因此,观察肿瘤细胞电离辐射后EMT的变化对探索电离辐射与肿瘤转移的关系具有重要的价值。本课题组前期研究发现,经2 Gy的γ射线单次诱导后,乳腺癌、肺癌、结肠癌肿瘤细胞EMT相关的侵袭和迁移能力明显增强,可见电离辐射能够通过诱导EMT的发生来增强多种肿瘤细胞的转移潜能[11]。本研究采用了临床常规分割放疗模式,进一步在宫颈癌细胞上证实了EMT现象的发生。
电离辐射产生的生物学效应与其辐射剂量、剂量率、细胞的类型等因素相关[12]。既往关于宫颈癌的研究证实,HeLa细胞在接受辐射诱导后其辐射抗性增加,细胞表型可随辐照剂量的增加和照射后时间的延长而变化[13]。当采用临床常规分割剂量2 Gy诱导至总剂量30 Gy后,宫颈鳞癌和腺癌细胞系的辐射抗性均明显增加[14]。为更加接近临床实际,本研究选取了病理类型最常见的宫颈鳞癌细胞系Siha为研究对象,模拟宫颈癌临床常规分割外照射模式(2 Gy/次, 共50 Gy/25次)进一步观察了电离辐射与肿瘤EMT发生的关系。与本团队前期关于肺癌的研究结果相一致的是,辐射诱导后,宫颈癌细胞呈现出了稳定的EMT表型,并伴有转移潜能的增加[15],这为解释宫颈癌患者放疗后发生远处转移提供了有力的数据支持。
外泌体是活细胞分泌的细胞外囊泡,携带的miRNAs、CircRNA、mRNA和蛋白质等生物活性物质可以在肿瘤细胞中差异表达,而这些分子在调节癌基因表达、激活相关信号通路、肿瘤相关成纤维细胞重塑、调节细胞转移潜能和免疫逃逸等生物进程中发挥着作用,能够从微环境角度揭示细胞互作与肿瘤发生发展的原因[16-19]。此外,多项研究结果提示,外泌体也参与了食管癌、肺癌、结肠癌等多种肿瘤细胞辐射敏感性的调控[20]。近期宫颈癌相关的研究也发现,肿瘤相关成纤维细胞可通过外泌体介导miR-1323的传递,靶向PABPN1并激活Wnt/β-catenin信号,从而增强宫颈癌C33A细胞的辐射抗性[21]。而本研究发现,常规分割放疗模式条件下的电离辐射,可能也是通过诱导外泌体的分泌促进细胞EMT的发生,从而增加宫颈癌的转移潜能。然而,电离辐射的这种效应诱发了外泌体中哪些生物信息发生了变化,其具体的调控机制和传递方式如何,值得进一步探索。
膜中性鞘磷脂酶可通过水解细胞膜脂鞘磷脂来产生有生物活性的脂神经酰胺诱导外泌体的形成,目前应用最为广泛的外泌体抑制剂GW4869正是一种典型的膜中性鞘磷脂酶抑制剂,它可通过抑制外泌体的释放来阻止外泌体传递生物信号,在一定范围内对外泌体分泌的抑制作用呈浓度依赖性[22-23]。本研究也应用GW4869进行干预,进一步明确了外泌体在辐射诱导宫颈癌EMT过程中的作用,提示以GW4869为代表的外泌体抑制剂在临床肿瘤治疗中具有潜在的应用价值。
综上所述,本研究通过模拟临床常规分割放疗模式,发现电离辐射可通过诱导外泌体的分泌促进宫颈癌Siha细胞EMT的发生,从而增加其转移潜能,为解释宫颈癌放疗后远处转移的机制提供了部分依据。
利益冲突 无
作者贡献声明 廖聆郦负责主体实验的实施和论文撰写;杨帆、马雨薇、王璐瑶、屈振负责细胞培养、外泌体收集、外泌体表征实验;王效静、江浩负责部分实验设计;周咏春负责整体实验设计、实验过程质控和论文修改
| [1] |
Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2022[J]. CA Cancer J Clin, 2022, 72(1): 7-33. DOI:10.3322/caac.21708 |
| [2] |
Liu X, Meng Q, Wang W, et al. Predictors of distant metastasis in patients with cervical cancer treated with definitive radiotherapy[J]. J Cancer, 2019, 10(17): 3967-3974. DOI:10.7150/jca.31538 |
| [3] |
Dongre A, Weinberg RA. New insights into the mechanisms of epithelial-mesenchymal transition and implications for cancer[J]. Nat Rev Mol Cell Biol, 2019, 20(2): 69-84. DOI:10.1038/s41580-018-0080-4 |
| [4] |
Gonzalez DM, Medici D. Signaling mechanisms of the epithelial-mesenchymal transition[J]. Sci Signal, 2014, 7(344): re8. DOI:10.1126/scisignal.2005189 |
| [5] |
Rai A, Fang H, Claridge B, et al. Proteomic dissection of large extracellular vesicle surfaceome unravels interactive surface platform[J]. J Extracell Vesicles, 2021, 10(13): e12164. DOI:10.1002/jev2.12164 |
| [6] |
Kim H, Lee S, Shin E, et al. The emerging roles of exosomes as EMT regulators in cancer[J]. Cells, 2020, 9(4). DOI:10.3390/cells9040861 |
| [7] |
Szatmári T, Persa E, Kis E, et al. Extracellular vesicles mediate low dose ionizing radiation-induced immune and inflammatory responses in the blood[J]. Int J Radiat Biol, 2019, 95(1): 12-22. DOI:10.1080/09553002.2018.1450533 |
| [8] |
Mueller AC, Piper M, Goodspeed A, et al. Induction of ADAM10 by radiation therapy drives fibrosis, resistance, and epithelial-to-mesenchyal transition in pancreatic cancer[J]. Cancer Res, 2021, 81(12): 3255-3269. DOI:10.1158/0008-5472.Can-20-3892 |
| [9] |
Nagarajan D, Melo T, Deng Z, et al. ERK/GSK3β/Snail signaling mediates radiation-induced alveolar epithelial-to-mesenchymal transition[J]. Free Radic Biol Med, 2012, 52(6): 983-992. DOI:10.1016/j.freeradbiomed.2011.11.024 |
| [10] |
Barker HE, Paget JT, Khan AA, et al. The tumour microenvironment after radiotherapy: mechanisms of resistance and recurrence[J]. Nat Rev Cancer, 2015, 15(7): 409-425. DOI:10.1038/nrc3958 |
| [11] |
Zhou YC, Liu JY, Li J, et al. Ionizing radiation promotes migration and invasion of cancer cells through transforming growth factor-beta-mediated epithelial-mesenchymal transition[J]. Int J Radiat Oncol Biol Phys, 2011, 81(5): 1530-1537. DOI:10.1016/j.ijrobp.2011.06.1956 |
| [12] |
Santivasi WL, Xia F. Ionizing radiation-induced DNA damage, response, and repair[J]. Antioxid Redox Signal, 2014, 21(2): 251-259. DOI:10.1089/ars.2013.5668 |
| [13] |
Saito Y, Miura H, Takahashi N, et al. Involvement of APOBEC3B in mutation induction by irradiation[J]. J Radiat Res, 2020, 61(6): 819-827. DOI:10.1093/jrr/rraa069 |
| [14] |
Li Z, Zhang Y, Sui S, et al. Targeting HMGB3/hTERT axis for radioresistance in cervical cancer[J]. J Exp Clin Cancer Res, 2020, 39(1): 243. DOI:10.1186/s13046-020-01737-1 |
| [15] |
Zhou YC, Liao LL, Su N, et al. TGF-β/Akt/Smad signaling regulates ionizing radiation-induced epithelial-mesenchymal transition in acquired radioresistant lung cancer cells[J]. Radiat Med Prot, 2022, 3(3): 139-145. DOI:10.1016/j.radmp.2022.05.003 |
| [16] |
Silva AM, Lázaro-Ibáñez E, Gunnarsson A, et al. Quantification of protein cargo loading into engineered extracellular vesicles at single-vesicle and single-molecule resolution[J]. J Extracell Vesicles, 2021, 10(10): e12130. DOI:10.1002/jev2.12130 |
| [17] |
Momenbeitollahi N, Aggarwal R, Strohle G, et al. Extracellular vesicle (EV) dot blotting for multiplexed EV protein detection in complex biofluids[J]. Anal Chem, 2022, 94(20): 7368-7374. DOI:10.1021/acs.analchem.2c00846 |
| [18] |
Jiang WJ, Xu CT, Du CL, et al. Tubular epithelial cell-to-macrophage communication forms a negative feedback loop via extracellular vesicle transfer to promote renal inflammation and apoptosis in diabetic nephropathy[J]. Theranostics, 2022, 12(1): 324-339. DOI:10.7150/thno.63735 |
| [19] |
Li P, Wang J, Gao M, et al. Membrane feature-inspired profiling of extracellular vesicles for pancreatic cancer diagnosis[J]. Anal Chem, 2021, 93(28): 9860-9868. DOI:10.1021/acs.analchem.1c01712 |
| [20] |
Sun H, Sun R, Song X, et al. Mechanism and clinical value of exosomes and exosomal contents in regulating solid tumor radiosensitivity[J]. J Transl Med, 2022, 20(1): 189. DOI:10.1186/s12967-022-03392-w |
| [21] |
Fang F, Guo C, Zheng W, et al. Exosome-mediated transfer of miR-1323 from cancer-associated fibroblasts confers radioresistance of C33A Cells by targeting PABPN1 and activating Wnt/β-catenin signaling pathway in cervical cancer[J]. Reprod Sci, 2022, 29(6): 1809-1821. DOI:10.1007/s43032-021-00820-y |
| [22] |
Luberto C, Hassler DF, Signorelli P, et al. Inhibition of tumor necrosis factor-induced cell death in MCF7 by a novel inhibitor of neutral sphingomyelinase[J]. J Biol Chem, 2002, 277(43): 41128-41139. DOI:10.1074/jbc.M206747200 |
| [23] |
Catalano M, O'Driscoll L. Inhibiting extracellular vesicles formation and release: a review of EV inhibitors[J]. J Extracell Vesicles, 2020, 9(1): 1703244. DOI:10.1080/20013078.2019.1703244 |
 2022, Vol. 42
2022, Vol. 42


