双侧原发性乳腺癌是指两侧乳腺同时或先后发生的独立原发病灶,其中两侧乳腺发现病灶时间间隔 < 6个月者称为同时性双侧乳腺癌(synchronous bilateral breast cancer,SBBC)[1]。SBBC占所有初诊乳腺癌的比例仅为0.4%~2.8%[2],但随着相关影像及病理检查手段的进步,SBBC的发现比例逐渐增加。与单侧乳腺癌相类似,SBBC改良根治术后也需要通过行放射治疗来降低患者的局部复发率[3];然而,相比单侧乳腺癌,SBBC由于靶区跨度范围广、体积大、相当靠近双肺和心脏,放疗难度会大大增加,因此对所采用的放疗技术及设备会有较高要求。螺旋断层放疗(helical tomotherapy,HT)是目前非常先进的调强放疗技术,其通过治疗床运动、多叶准直器(MLC)毫秒级的快速开合以及机架旋转,可以对整个靶区以CT扫描的方式行360°扇形射野螺旋照射,拥有卓越的高调制能力[4]。但由于SBBC发病率相对较低、国内HT系统配置许可难度大,目前鲜见有SBBC术后放疗与HT相关的研究报道。本研究对本中心引进的新一代螺旋断层放疗系统TOMO Radixact所开展的HT技术与应用多年的容积旋转调强放疗(volumetric modulated arc therapy,VMAT)技术在SBBC的改良根治术后放疗作回顾性分析比较,为HT的临床应用提供参考。
资料与方法1. 临床资料:回顾性分析并选取2017年2月至2022年5月于广西医科大学第四附属医院肿瘤科行改良根治术后放疗的9例SBBC患者为研究对象,年龄38~64岁,中位年龄50岁。纳入标准:①符合阚秀[5]提出的原发性SBBC诊断标准。②双乳均行改良根治手术。③行同时双侧胸壁术后放疗。④均需行锁骨上区预防照射。⑤双上肢活动正常,满足放疗体位要求。排除标准:①转移性SBBC。②严重心肺功能不全者。③既往胸部放疗史。④合并放疗禁忌证。治疗前所有患者均签署了放疗知情同意书,且均在本院的美国瓦里安Trilogy直线加速器上接受容积旋转调强放疗。本研究已获广西医科大学第四附属医院伦理委员会批准(KY2021142)。
2. 体位固定及CT扫描:患者取仰卧位,采用碳纤维乳腺托架及热塑膜固定,双侧上肢充分外展上举,在定位激光标记线3个交叉点处放置金属标记点,用铅丝在皮肤上标记出原乳房区的各边界及术后疤痕位。完成体位固定后使用德国西门子公司的大孔径CT模拟机(型号:SOMATOM Definition AS)对患者在自由平静呼吸状态下进行增强CT扫描,扫描层厚和层间距均为5 mm,扫描范围包括颈、胸和上腹部。所获得的CT图像最后以DICOM格式传输至瑞典RaySearch公司研发的RayStation放疗计划系统(版本:4.7.5)。
3. 靶区和危及器官(OAR)勾画:由同一组具有5年以上工作经验的肿瘤科放疗医师参照美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)的规则要求在RayStation计划系统依次勾画双侧临床靶体积(clinical target volume,CTV)、计划靶体积(planning target volume,PTV)和OAR。其中CTV包含胸壁CTV和锁骨上区CTV的勾画,前界均处在皮肤表面下0.3 cm。PTV(包含左侧PTV_L,右侧PTV_R) 是在两侧CTV的基础上外放0.5 cm生成,但前界仍位于皮肤表面下0.3 cm。危及器官的勾画包括双肺、心脏、肝脏、脊髓、肱骨头、甲状腺等。靶区和OAR画好后需由上级医师审核确认,之后将其和患者CT图像一并传输至安科锐(Accuray)公司的Precision(版本:1.1)放疗计划系统。PTV处方剂量为常规分割50 Gy/25次,要求100%的处方剂量至少覆盖95%的计划靶体积,靶区内的高剂量体积要求V107%≤10%,V110%≤1%(Vx%表示x%的处方剂量线面所包绕的靶体积占整个靶体积的百分比)。OAR的剂量限值如下:双肺V5≤65%,V20≤25%(Vx表示接受x Gy剂量照射的体积百分比),Dmean≤ 15 Gy;心脏V20≤20%,V30≤10%,Dmean≤15 Gy;肝脏V20≤20%,V30≤10%,Dmean≤15 Gy;脊髓最大剂量Dmax < 40 Gy;甲状腺V50≤10%;肱骨头V30≤5%。
4. 放疗计划设计:由同一组具有5年以上工作经验的放疗物理师对每例患者分别设计两种放疗计划,即采用Precision计划系统基于Radixact螺旋断层放疗系统设计HT计划,RayStation计划系统基于Trilogy直线加速器设计VMAT计划,均采用6 MV X射线,具体如下:①HT计划选用系统的调强放射治疗(IMRT)计划模式,均采用动态铅门(dynamic jaw),铅门宽度2.5 cm,螺距0.287,调制因子4.0,剂量计算算法为卷积叠加算法(convolution/Superposition,C/S),剂量计算网格选中等“Medium”;每例患者在优化计算前需由物理师手工勾画一定的辅助结构“Block”,用以避照双肺、心脏、肝脏、双侧上肢等危及器官和正常组织。②VMAT计划采用双等中心整体优化的设计理念,两等中心大致分别位于左右侧计划靶区的几何中心。根据本科室前期研究报道[6],射野均采用部分弧+固定铅门的方式,左侧靶区PTV_L射野设置为顺时针300°~55°,55°~150°(固定铅门),150°~179°,加反方向逆时针179°~150°,150°~55°(固定铅门),55°~0°;右侧靶区PTV_R布野则为逆时针60°~305°,305°~210°(固定铅门),210°~182°,加反方向顺时针182°~210°,210°~305°(固定铅门),305°~0°,其中固定铅门部分射野只对胸壁部分靶区适形并外放1 cm;剂量计算算法同样为C/S算法,剂量计算网格为3 mm,控制点间隔设为2°,每段弧的剂量率在100~600 MU/min的连续范围内由计划系统控制变化;所有VMAT计划均使用RayStation计划系统的多目标优化(multi criteria optimization,MCO)模块对双等中心计划进行整体优化。两种计划在计算时需反复调整优化函数直至达到理想的剂量分布,之后经由上级物理师审核确认方可通过。最终所得所有计划根据计划类型分为HT组和VMAT组。
5. 放疗计划评估:两种计划均通过剂量体积直方图(dose volume histogram,DVH)和等剂量分布曲线来评估,评估参数参照国际辐射单位和测量委员会(ICRU)83号报告[7]建议,评估靶区PTV的最大剂量D2%、最小剂量D98%、靶区覆盖度D95%、中位剂量D50%、平均剂量Dmean以及适形指数CI(conformity index)和均匀性指数HI(homogeneity index)。其中Dx%为x%靶体积接受的最低照射剂量。CI的计算公式为:CI=(Vt.ref/Vt) × (Vt.ref/Vref)。式中,Vt.ref为参考等剂量线面所包绕的靶体积,Vref为参考等剂量线面所包绕的所有区域的体积,Vt为靶体积,CI值越接近1,说明靶区的适形度越高。均匀性指数定义为HI=(D2%- D98%)/D50%,该值越接近0,说明靶区的均匀性越好。另外靶区还需评估表示靶区覆盖度的参数V100%以及靶区内的高剂量体积V107%和V110%。危及器官的评估参数包括:双肺的V5、V20、Dmean,心脏和肝脏的V20、V30、V40、Dmean,脊髓的Dmax,肱骨头的V30,甲状腺的V50,同时统计并评估两种计划的治疗出束时间T。
6. 统计学处理:应用SPSS 22.0软件进行统计学分析。符合正态分布的计量资料以x±s表示,采用配对样本t检验比较两种治疗方式的靶区和OAR的剂量学参数以及治疗出束时间T。P < 0.05为差异有统计学意义。
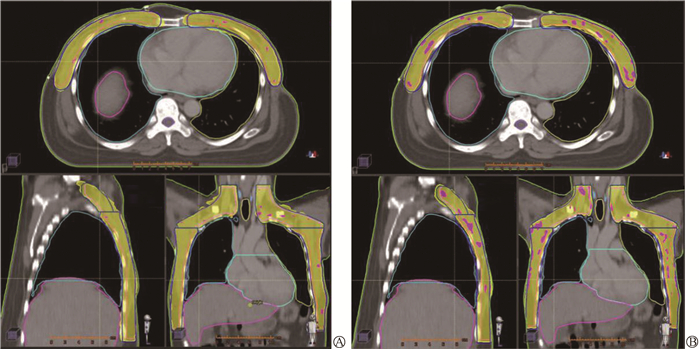
结果1. 靶区剂量分布比较:为方便两种计划的剂量分布比较,将所有HT计划传入RayStation计划系统读取,其中1例SBBC患者的HT计划和VMAT计划在某同一横断面、矢状面、冠状面的等剂量分布图如图 1所示。由图 1可以看出,相比VMAT计划,HT计划的处方剂量(5 000 cGy) 能更紧包饶靶区,特别是靠近双肺和心脏处对靶区的覆盖度更好,且靶区内5 350 cGy的高剂量体积很少。
|
注:HT. 螺旋断层放疗;VMAT. 容积旋转调强放疗;为便于剂量分布比较,将HT计划传入RayStation计划系统读取;黄色填充区域为靶区的处方剂量(5 000 cGy)覆盖区;红色填充区域为靶区的高剂量区(5 350 cGy) 图 1 某例SBBC患者HT计划(A)和VMAT计划(B)的靶区等剂量分布线比较 Figure 1 Comparison of the isodose distribution of the target volumes between the HT plan (A) and the VMAT plan (B) of a SBBC patient |
2. 靶区剂量学参数比较:由表 1可知,两组计划的靶区最大剂量D2%和靶区内的高剂量体积V110%相近,差异均无统计学意义(P > 0.05);HT组计划的最小剂量D98%、靶区内的高剂量体积V107%以及靶区均匀性指数HI要略好于VMAT组计划,但差异均无统计学意义(P > 0.05);HT组的D95%、V100%、D50%、Dmean以及CI均明显优于VMAT组,且差异均有统计学意义(t=-3.21、-3.39、4.97、3.76、-5.03,P < 0.05),表明HT组计划在提高靶区处方剂量覆盖的同时,还能兼顾改善靶区的平均剂量和适形度。
|
|
表 1 SBBC患者的靶区剂量学参数HT组和VMAT组的比较(x±s) Table 1 Comparison of dosimetric parameters of the target volumes of SBBC patients between the HT and VMAT groups (x±s) |
3. OAR受照剂量学参数及治疗出束时间T比较:由表 2可知,HT组双肺的V20、平均剂量Dmean均明显低于VMAT组,而低剂量区V5则明显高于VMAT组,但仍低于V5的剂量限值,差异均有统计学意义(t=-3.01、3.83、-2.81,P < 0.05);HT组在心脏的各项评估参数(V20、V30、V40、Dmean) 上均明显优于VMAT组,差异均有统计学意义(t=3.76、-2.83、-2.74、5.93,P < 0.05);HT组肝脏的V20、Dmean均明显优于VMAT组,差异均有统计学意义(t=4.57、4.48,P < 0.05),但肝脏V30、V40的差异无统计学意义(P > 0.05);其他OAR脊髓、甲状腺和肱骨头的受照剂量差异均无统计学意义(P > 0.05);VMAT组的治疗出束时间T远远低于HT组,差异有统计学意义(t=11.32,P < 0.05)。
|
|
表 2 SBBC患者的各危及器官剂量学参数及治疗出束时间HT组和VMAT组的比较(x±s) Table 2 Comparison of dosimetric parameters of the OARs and delivery time of SBBC patients between the HT and VMAT groups (x±s) |
讨论
SBBC患者的改良根治术后靶区体积大、跨度范围广,类似于开口向下的“C”形,并且相当贴近双肺、心脏、肝脏等重要OAR,因此其术后放疗在满足靶区处方剂量的同时,如何保护好OAR成为放疗计划设计的难题,面临着极大挑战。HT特有的技术特点以及其高强度的调制能力有助于解决这一难题,但由于SBBC发病率低、国内HT系统设备配置稀少,目前鲜见SBBC术后放疗与HT技术相关的文献研究。本研究通过比较HT和VMAT在SBBC改良根治术后放疗中的剂量学、治疗时间等的差异,为HT技术在临床的初步应用提供参考。
本研究结果显示,相比VMAT,HT在SBBC术后放疗的靶区覆盖度、适形度、平均剂量等方面均具备明显优势,从而使得横断面的处方剂量线更加紧紧包绕靶区,有助于提升SBBC的治疗增益比。此结果与Wadasadawala等[8]、Kaidar-person等[9]和Ekici等[10]应用HT于双侧乳腺癌的研究结果相类似,认为HT在提高靶区覆盖度的同时能兼顾改善靶区适形度;原因很可能与HT本身的技术优势有关,其能在360°范围以CT扫描方式对整个靶区行扇形野螺旋照射,其中每圈包含51个投射角,每个投射角通过二元气动MLC形成的大量子野进行投照,因而拥有很强的调制能力,能匹配各种复杂的靶区形状。但Wadasadawala等[8]、Ekici等[10]的研究还显示HT有效改善了靶区的剂量均匀性。而本研究中两种技术在靶区剂量均匀性以及靶区内的高剂量体积上的差异均不大,主要原因应来自本科室SBBC的VMAT计划均采用了双等中心整体优化的设计理念,相较于传统的双等中心左右两侧分别优化,不会存在因左右侧射野衔接引起的剂量叠加而导致的剂量热点;相较于单等中心计划,其叶片的调制能力则要明显增强[11-12]。因此双等中心整体优化实能有效降低计划设计难度,对于本研究中VMAT计划的靶区剂量均匀性改善和靶区内高剂量体积减少具有重大意义,使其能够获得等同于HT计划的靶区剂量均匀性。
大多数研究者认为乳腺癌术后放疗成败的关键在于是否对双肺、心脏进行了有效保护,因为放疗对其造成的远期副反应是乳腺癌术后10年、15年生存率降低的重要原因之一[13]。鉴于此,本研究中的HT计划均采用了新一代TOMO Radixact系统配置的动态铅门技术,因其能通过铅门的运动减少靶区边缘头脚方向的散射半影,即靶区边缘头脚方向的剂量跌落更快,减少散射线的影响,从而能够降低OAR的受照剂量[14]。最终本研究结果显示HT组双肺V20、Dmean均明显低于VMAT组,与Wadasadawala等[8]认为HT在双肺V20上有显著优势的研究结果相一致。胸部放疗中放射性肺炎的发生概率和严重程度与肺的V20、Dmean密切相关[15],因此,HT在双肺V20、Dmean的剂量学优势能有效降低SBBC患者放射性肺炎发生的可能性。另一方面肺的低剂量区照射体积V5也是放射性肺炎的重要风险因素[16],但本研究HT组的双肺低剂量区V5要明显高于VMAT组,不过仍处在剂量限值以下,其最主要的原因在于HT是在360°范围内的51个投射角方向连续旋转出束,虽已勾画“Block”区域对远离靶区的肺组织进行遮挡避照,但不可能做到对整个肺组织的全遮挡,不可避免地造成双肺低剂量区V5偏高。其次是本研究中的VMAT计划均采用了MCO功能进行优化计算,MCO的最大好处就是有助于大大降低OAR的受照剂量[17]。放射性心脏损伤是乳腺癌术后放疗中需要重点关注的另一不良反应,其与心脏的V30、Dmean密切相关[18]。相比VMAT组计划,本研究中HT组计划均较大程度降低了心脏V20、V30、V40、Dmean,对降低远期心脏损伤的发生具有关键意义,因而能够更好地保护心脏。
本研究中,HT组的治疗出束时间远远大于VMAT组,表明HT技术在治疗效率方面没有优势。由于SBBC的靶区很接近皮肤与空气的交界处,实际应用中治疗时间的增加可能会增大由SBBC患者呼吸运动引起的对靶区表面剂量的不确定性影响[19],但Ding等[20]、Zibold等[21]以及Moeckly等[22]的研究均表明HT的相关治疗中,呼吸运动对靶区覆盖率、剂量均匀性的影响很小,表面剂量的均匀性和可重复性很好,且HT系统中与加速器同源的兆伏级CT的图像引导功能具有更高的精度,可保证肿瘤位置每次治疗时的精确,从而减少照射风险。故认为HT虽大大增加了SBBC患者的治疗时间,但并不会由此加剧呼吸运动对表面剂量的变化,因此,HT技术应用于平静呼吸状态下SBBC患者的治疗完全可行。
综上,相比VMAT技术,HT技术具备更大的剂量学优势,能提供更好的靶区覆盖度和适形度,且可明显降低OAR双肺、心脏和肝脏的整体受照剂量,但双肺的低剂量区V5、治疗时间多于VMAT,不过仍满足临床治疗需求,故对于SBBC患者的改良根治术后放疗可考虑使用HT技术,能达到较好的治疗收益。由于本研究临床统计数据有限,所得结论后续还需收集更多样本作进一步的研究证实。
利益冲突 所有作者声明无利益冲突
作者贡献声明 贺先桃负责命题的设计、数据的收集整理与分析、论文的撰写;龙雨松负责研究方案的设计;谭军文负责病例的筛选、数据的整理;李钢、冯永富负责放疗计划的设计;杨慧、陆颖负责数据的核对、研究的实施;王占宇指导修改论文
| [1] |
徐佩佩, 孔令非. 双侧乳腺癌的研究进展[J]. 临床与实验病理学杂志, 2020, 36(5): 557-559. Xu PP, Kong LF. Research progress of bilateral breast cancer[J]. J Clin Exp Pathol, 2020, 36(5): 557-559. DOI:10.13315/j.cnki.cjcep.2020.05.012 |
| [2] |
Jobsen JJ, van der PaIen J, Ong F, et al. Synchronous bilateral breast cancer: prognostic value and incidence[J]. Breast, 2003, 12(2): 83-88. DOI:10.1016/S0960-9776(02)00278-3 |
| [3] |
Kim SJ, Lee MJ, Youn SM. Radiation therapy of synchronous bilateral breast carcinoma (SBBC) using multiple techniques[J]. Med Dosim, 2018, 43(1): 55-68. DOI:10.1016/j.meddos.2017.08.003 |
| [4] |
Jeraj R, Mackie TR, Balog J, et al. Radiation characteristics of helical tomotherapy[J]. Med Phys, 2004, 31(2): 396-404. DOI:10.1118/1.1639148 |
| [5] |
阚秀. 乳腺癌临床病理学[M]. 北京: 北京医科大学中国协和医科大学联合出版社, 1993: 98-102. Kan X. Clinical pathology of breast cancer[M]. Beijing: Beijing Medical University & China Union Medical University Press, 1993: 98-102. |
| [6] |
贺先桃, 王占宇, 谭军文, 等. 固定铅门模式下容积旋转调强放疗与动态调强放疗在乳腺癌根治术后放疗中的比较[J]. 中国医学物理学杂志, 2018, 35(8): 889-894. He XT, Wang ZY, Tan JW, et al. Comparison of VMAT vs dIMRT with fixed-jaw technique for postoperative radiotherapy of breast cancer[J]. Chin J Med Phys, 2018, 35(8): 889-894. DOI:10.3969/j.issn.1005-202X.2018.08.005 |
| [7] |
International Commission on Radiation Units and Measurements. ICRU Report 83. Prescribing, recording, and reporting photon-beam intensity-modulated radiation therapy (IMRT) [R]. ICRU: Oxford University Press, 2010.
|
| [8] |
Wadasadawala T, Visariya B, Sarin R, et al. Use of tomotherapy in treatment of synchronous bilateral breast cancer: dosimetric comparison study[J]. Br J Radiol, 2015, 88(1048): 20140612. DOI:10.1259/bjr.20140612 |
| [9] |
Kaidar-Person O, Kostich M, Zagar TM, et al. Helical tomotherapy for bilateral breast cancer: Clinical experience[J]. Breast, 2016, 28: 79-83. DOI:10.1016/j.breast.2016.05.004 |
| [10] |
Ekici K, Gokce T, Karadogan I, et al. Is helical tomotherapy-based intensity-modulated radiotherapy feasible and effective in bilateral synchronous breast cancer? A two-center experience[J]. J BUON, 2016, 21(1): 46-52. |
| [11] |
杨海芳, 刘建平, 王志武, 等. 多等中心调强计划在双侧乳腺癌放射治疗中的应用[J]. 中华肿瘤防治杂志, 2020, 27(19): 1548-1553. Yang HF, Liu JP, Wang ZW, et al. Application of intensity-modulated radiation therapy with Multi-ISO centers planning method for bilateral breast cancer[J]. Chin J Cancer Prev Treat, 2020, 27(19): 1548-1553. DOI:10.16073/j.cnki.cjcpt.2020.19.04 |
| [12] |
Boman E, Rossi M, Kapanen M. The robustness of dual isocenter VMAT radiation therapy for bilateral lymph node positive breast cancer[J]. Phys Med, 2017, 44: 11-17. DOI:10.1016/j.ejmp.2017.11.006 |
| [13] |
范雪梅, 侯鑫, 李亮, 等. 双侧乳腺癌dIMRT和VMAT计划的剂量学比较[J]. 中国辐射卫生, 2021, 30(3): 339-344+360. Fan XM, Hou X, Li L, et al. Dosimetric comparison between dIMRT and VMAT for bilateral breast cancer[J]. Chin J Radiol Health, 2021, 30(3): 339-344+360. DOI:10.13491/j.issn.1004-714x.2021.03.016 |
| [14] |
胡志辉, 张可, 黄鹏, 等. 螺旋断层放疗系统升级动态铅门技术的验收测试[J]. 中华放射肿瘤学杂志, 2019, 28(2): 125-130. Hu ZF, Zhang K, Huang P, et al. Commissioning of dynamic jaw delivery in tomotherapy[J]. Chin J Radiat Oncol, 2019, 28(2): 125-130. DOI:10.3760/cma.j.issn.1004-4221.2019.02.009 |
| [15] |
Graham MV, Purdy JA, Emami B, et al. Clinical dose-volume histogram analysis for pneumonitis after 3D treatment for non-small cell lung cancer (NSCLC)[J]. Int J Radiat Oncol BiolPhys, 1999, 45(2): 323-329. |
| [16] |
Krueger EA, Fraass BA, Mcshan DL, et al. Potential gains for irradiation of chest wall andregional nodes with intensity modulated radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2003, 56(4): 1023-1037. DOI:10.1016/S0360-3016(03)00183-4 |
| [17] |
Zieminski S, Khandekar M, Wang Y. Assessment of multi-criteria optimization (MCO) for volumetric modulated arc therapy (VMAT) in hippocampal avoidance whole brain radiation therapy (HA-WBRT)[J]. J Appl Clin Med Phys, 2018, 19(2): 184-190. DOI:10.1002/acm2.12277 |
| [18] |
Sardaro A, Petruzzelli MF, D'Errico MP, et al. Radiation-induced cardiac damage in early left breast cancer patients: risk factors, biological mechanisms, radiobiology, and dosimetric constraints[J]. Radiother Oncol, 2012, 103(2): 133-142. DOI:10.1016/j.radonc.2012.02.008 |
| [19] |
Lauche O, Kirova YM, Fenoglietto P, et al. Helical tomotherapy and volumetric modulated arc therapy: New therapeutic arms in the breast cancer radiotherapy[J]. World J Radiol, 2016, 8(8): 735-742. DOI:10.4329/wjr.v8.i8.735 |
| [20] |
Ding C, Li X, Huq MS, et al. The effect of respiratory cycle and radiation beam-on timing on the dose distribution of free-breathing breast treatment using dynamic IMRT[J]. Med Phys, 2007, 34(9): 3500-3509. DOI:10.1118/1.2760308 |
| [21] |
Zibold F, Sterzing F, Sroka-Perez G, et al. Surface dose in the treatment of breast cancer with helical tomotherapy[J]. Strahlenther Onkol, 2009, 185(9): 574-581. DOI:10.1007/s00066-009-1979-7 |
| [22] |
Moeckly SR, Lamba M, Elson HR. Respiratory motion effects on whole breast helical tomotherapy[J]. Med Phys, 2008, 35(4): 1464-1475. DOI:10.1118/1.2841936 |
 2022, Vol. 42
2022, Vol. 42


