头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)是由口腔、咽部和喉部的黏膜上皮发展而来的异质性肿瘤[1]。超过60%的HNSCC患者确诊时已属Ⅲ期或ⅣA/B期,其特征是伴有明显的局部浸润和区域淋巴结转移[2]。对于可切除的肿瘤,同步放化疗(concurrent chemoradiotherapy,CCRT)和手术后放化疗都是有效的,治疗方法的选择在很大程度上取决于肿瘤的位置和个人意愿。由于咽喉部解剖结构的特殊性,口咽及下咽喉鳞癌的治疗需要在肿瘤的根治、生存率的提高、功能的保护和生活质量的提高之间取得平衡。对于不能手术的或要求保留器官的患者,CCRT仍然是标准的,但诱导化疗(induction chemotherapy, IC)之后的手术和/或CCRT是一个强有力的选择。一些随机试验表明,诱导化疗序贯同步放化疗较单纯放化疗提高了无进展生存率[3]。包括大型荟萃分析在内的多项研究,奠定了多西他赛+顺铂+氟尿嘧啶(TPF)方案作为头颈部鳞癌诱导化疗的标准方法[4-5], 而由于顺铂的不良反应较大,患者难以耐受,故目前逐渐出现二代、三代铂类如卡铂、奈达铂等尝试替代顺铂化疗。纤维蛋白原(fibrinogen,FIB)参与了炎性反应及癌症的起始和进展[6],在凝血级联反应中被FIB激活的凝血酶转化为纤维蛋白,而肿瘤患者血液中的可溶性纤维蛋白水平的升高可能是一个预后不良的指标[7]。故本研究对局部晚期HNSCC患者的诱导化疗前纤维蛋白原水平以及临床病理因素进行回顾性分析,探讨纤维蛋白原在局部晚期HNSCC诱导化疗联合根治性放疗中的临床意义及预后价值。
资料与方法1. 患者一般临床资料:按照纳入和排除标准将2011年5月至2021年5月就诊于贵州医科大学附属肿瘤医院的局部晚期HNSCC患者114例作为研究对象。喉癌25例,下咽癌44例,口咽癌45例;临床分期Ⅲ~ⅣA期85例,ⅣB期29例;男性107例,女性7例;年龄29~83岁,平均年龄(60.7±9.0)岁;采用TPF方案诱导化疗91例,其他方案诱导化疗23例;同步放化疗110例,单纯放疗4例;低于4个化疗周期数的13例,不低于4个的101例。
2. 纳入和排除标准:纳入标准为经病理学确诊的口咽鳞癌、喉鳞癌、下咽鳞癌初治患者;依据美国癌症联合委员会(AJCC)第7版进行TNM分期,Ⅲ期或ⅣA/B期;年龄18岁以上,性别不限;卡氏评分(Karnofsky,KPS)≥70;至少完成诱导化疗2周期+放射治疗, 放疗达根治剂量;治疗前血液学检查结果数据完整,有完整临床随访资料(所有患者诱导化疗前需行外周静脉置入中心静脉导管以便完成化疗,置管前均需查凝血指标)。排除标准为伴第二原发肿瘤;治疗前短期内服用影响凝血指标的药物者;伴严重呼吸系统、循环系统、消化系统、泌尿系统等疾病,且难以控制;患有自身免疫性疾病及血液系统相关病症。
3. 化疗方案:诱导化疗是以铂类为主的联合化疗方案,使用的方案包括:多西他赛+顺铂+氟尿嘧啶、多西他赛+洛铂、紫杉醇+顺铂。同步化疗中使用的方案包括:顺铂、洛铂、紫杉醇。
4. 放射治疗:放疗采用调强放射治疗技术(IMRT)/容积旋转调强技术(VMAT)技术,予以诱导化疗后原发灶消退或缩小的患者,诱导化疗前区域给予处方剂量66 Gy,2 Gy/次,残留的原发灶病灶及淋巴结则给予处方剂量69.96 Gy,2.12 Gy/次,口咽、下咽、喉鳞癌的根治性放疗剂量66~70 Gy。高危淋巴引流区给予处方剂量60.06 Gy,1.82 Gy/次;低危淋巴引流区处方剂量50.96 Gy,1.82 Gy/次,5次/周。
5. 信息采集:通过医院病例系统收集患者资料,包括年龄、性别、吸烟史、治疗前BMI(体重与身高平方的比值)、治疗前FIB、中性粒细胞、淋巴细胞、血小板、NLR(中性粒细胞与淋巴细胞比值)、PLR(血小板与淋巴细胞比值)、病种、肿瘤分期、诱导化疗方案、化疗总周期数及是否同步放化疗等基本临床资料信息。
6. 疗效评估:诱导化疗后、放疗结束时均进行疗效评估。根据实体瘤疗效评估标准(RECIST)版本1.1[8]用于疗效评估,其结果包括完全缓解(complete remission, CR)、部分缓解(partial remission, PR)、疾病稳定(stable disease, SD)和疾病进展(progressive disease, PD)。
7. 随访情况:以患者第一次诱导化疗的日期作为观察点,对治疗后出院的患者采用门诊复诊、电话等方式进行随访,末次随访截止时间为2021年12月31日。随访终点: 疾病进展或患者死亡。随访的生存指标包括:总生存期(overall survival, OS)是指从诱导化疗开始至任何原因所致死亡的时间(失访患者截至末次随访日;研究结束时仍然存活的患者截至随访结束日),无进展生存期(progression-free survival, PFS), 是指从诱导化疗开始到第一次肿瘤进展或死亡的时间。
8. 统计学处理:采用SPSS 25.0软件处理,分类资料用例数和构成比(%)表示。FIB水平的中位数确定FIB临界值,应用受试者工作特征(ROC)曲线以确定中性粒细胞、淋巴细胞、血小板等其他血液学相关参数的最佳临界值, 以FIB高低为状态变量,曲线下面积(area under curve,AUC) 计算约登指数, 约登指数=敏感性+特异性-1,该指数的最大值即为最佳临界值。计数资料的比较用χ2检验或Fisher确切概率法,OS和PFS用Kalplan-Meier法绘制生存曲线,并Log-rank法检验,Cox比例风险回归模型评估预后因素。P<0.05为差异有统计学意义。
结果1. 患者临床特征:治疗前FIB按照中位数3.6 g/L作为研究截断值,分为低FIB组55例(FIB≤3.6 g/L),高FIB组(FIB>3.6 g/L)59例,详见表 1。在高FIB组中BMI<18.5及诱导化疗后淋巴结疗效(SD+PD)的比率明显高于低FIB组(32.2% vs.9.1%,P=0.001;40.7%vs.21.8%,P=0.030)。两组在年龄、性别、分期、病种、化疗方案、化疗周期数之间的临床特征差异无统计学意义(P>0.05)。
|
|
表 1 诱导化疗前外周血FIB与局部晚期HNSCC患者临床病理特征的关系 Table 1 Relationship between peripheral blood FIB and the clinical pathological characteristics of patients with locally advanced HNSCC |
2. 诱导化疗前FIB与血象关系:在114例局部晚期头颈部鳞癌患者中,治疗前高FIB组患者较低FIB组患者有更高的中性粒细胞、血小板、NLR及PLR(χ2= 7.84,P=0.005;χ2=12.80,P<0.001;χ2=15.04,P<0.001;χ2=9.14,P=0.003),差异具有统计学意义,详见表 2。
|
|
表 2 诱导化疗前FIB和血象的关系 Table 2 Relationship between fibrinogen and blood cells before induction chemotherapy |
3. 治疗前FIB对患者OS和PFS的影响: 从患者诱导化疗开始计算,中位随访时间19.5个月(1~112个月),全组患者的3、5年OS率分别为51.0%、35.3%,3、5年PFS率分别为51.6%、35.8%,中位OS为39个月,中位PFS为37个月。低FIB组患者的3、5年OS率分别为62.9%、46.9%,高FIB组患者的3、5年OS率分别为39.6%、25.8%,差异有统计学意义[HR(95%CI)=1.93(1.10~3.37),P=0.022],详见图 1。低FIB组患者的3、5年PFS率分别为63.3%、48.1%,高FIB组患者的3、5年PFS率分别为40.3%、26.2%,差异有统计学意义[HR(95%CI)=1.95(1.11~3.41),P=0.020],详见图 1。
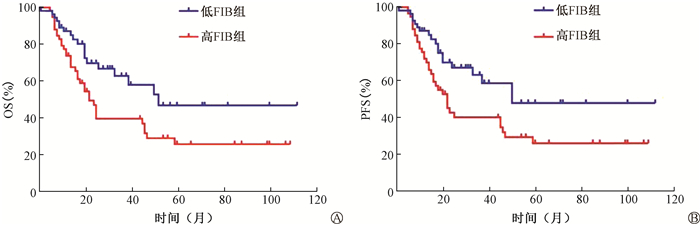
|
Survival curves of patients in the low-FIB group and the high-FIB group 图 1 低FIB组与高FIB组患者的生存曲线图 A.总生存率(OS);B.无进展生存率(PFS) A. Overall survival rate curves(OS); B. Progression-free survival rate curves(PFS) |
4. 单因素和多因素分析结果:单因素分析结果显示,FIB、放疗后淋巴结疗效、是否同步放化疗与局部晚期HNSCC患者OS相关[HR(95%CI)=1.93(1.10~3.37)、1.99(1.02~3.87)、3.64(1.10~12.07),P=0.022,0.043,0.035];FIB、放疗后淋巴结疗效与局部晚期HNSCC患者PFS相关[HR(95%CI)=1.95(1.11~3.41)、1.99(1.02~3.88),P=0.020,0.042],详见表 3。
|
|
表 3 影响114例局部晚期HNSCC患者的单因素分析 Table 3 Univariate analysis of 114 patients with locally advanced HNSCC |
将经单因素分析有意义的变量(FIB、放疗后淋巴结疗效、是否同步放化疗)进行COX多因素分析,结果显示FIB、放疗后淋巴结疗效和是否同步放化疗为局部晚期HNSCC患者OS[HR(95%CI)= 1.88(1.08~3.31)、2.14(1.09~4.21)、3.76(1.12~12.65),P=0.027、0.027、0.033] 和PFS [HR(95%CI)=1.92(1.09~3.36)、2.15(1.09~4.42)、3.39(1.01~11.34),P=0.023、0.027、0.048] 的独立预后因素,详见表 4。
|
|
表 4 影响114例局部晚期HNSCC患者预后的多因素分析 Table 4 Multivariate analysis of 114 patients with locally advanced HNSCC |
讨论
头颈部肿瘤解剖结构比较复杂,超过90%的头颈部鳞状细胞癌起源于口腔、咽部和喉部[9]。咽是呼吸与消化的共同通道,喉是呼吸道的重要组成部分,两者共同形成了呼吸功能、吞咽功能、防御保护功能、发声及构语等重要的生理功能,咽喉是否损害对患者的生活质量及心理创伤影响很大。局部晚期HNSCC存在手术治疗与非手术治疗两种方案,根据疾病特异型及患者自身选择,后者可以很好地保留咽喉功能,患者生活质量往往也更高。尽管同步放化疗在很大程度上已经成为标准治疗,但诱导化疗支持者进一步指出[10],TPF联合化疗方案的高应答率可显著降低远处转移风险,支持使用化疗进行初始治疗。尤其对于原发灶及淋巴结分期较晚且耐受性较好的患者通过诱导化疗以减少肿瘤负荷,同时有可能降低远处转移的风险,取得生存获益[10-11]。本研究回顾性分析了接受诱导化疗序贯放疗/放化疗的局部晚期口咽、下咽喉鳞癌患者,全组患者的3、5年OS率分别为51.0%、35.3%,3、5年PFS率分别为51.6%、35.8%,与报道结果相似[11]。其中79.8%的患者接受TPF方案的诱导化疗,而与非TPF方案比较,在OS与PFS上无差异。同步放化疗与化疗或单纯放疗相比,更有利于肿瘤局部控制、降低远处转移并提高患者生存率[12-13]。本研究中的单因素及多因素结果显示,比起单纯放疗的局部晚期HNSCC患者,采用同步放化疗的患者有更好的OS及PFS。
多种不同的炎症细胞和介质参与构成肿瘤微环境,其变化影响着肿瘤的增殖、侵袭、迁移等方面[14]。检测外周血中的中性粒细胞、淋巴细胞及血小板等可以反映许多恶性肿瘤状态,同时衍生的NLR与PLR在头颈部鳞癌中呈高表达[15-17]。Gentles等[18]分析了包括头颈部肿瘤在内的14种实体瘤,发现肿瘤内高密度中性粒细胞浸润的患者具有不良预后。淋巴细胞是机体免疫系统重要组成部分,其减少可能导致机体抗肿瘤能力减弱,容易使肿瘤发生扩散、侵袭、转移等[19]。血小板通过促进肿瘤细胞存活、促进新生血管形成及增强肿瘤细胞黏附等参与了肿瘤转移[20]。一项关于头颈部鳞癌的Meta分析表明,血小板计数越高,OS越差;PLR更高,OS更短[21]。头颈部鳞癌患者外周血NLR较高,说明中性粒细胞相对较高或淋巴细胞相对减少,研究显示治疗前NLR更高的头颈部鳞癌患者,其总生存率和无进展生存率更差[17]。另外,恶性消耗性疾病往往使得肝脏代偿性合成蛋白增加,间接引起FIB合成增多,进而缩短了头颈部肿瘤患者的无病生存期[22-23]。因此,当头颈部肿瘤患者外周血检测到中性粒细胞、血小板、NLR、PLR、FIB异常升高及淋巴细胞降低时,可能提示预后不良、生存期缩短。本研究结果显示,诱导化疗前局部晚期HNSCC患者在高FIB组中较低FIB组有更高的中性粒细胞、血小板、NLR及PLR,差异具有统计学意义。此外,生存分析结果显示,在高纤维蛋白原基础上合并外周血中性粒细胞、血小板升高及淋巴细胞降低时,高FIB组较低FIB组患者生存期缩短,但差异不具有统计学意义。
FIB是一种相对分子质量为340kD的糖蛋白,由α、β和γ三条不同的多肽链组成,它主要由肝细胞合成并通过凝血酶原活化为不可溶解的纤维蛋白[24]。
肿瘤发生发展过程中生长因子与纤维蛋白原息息相关,彼此作用有利于肿瘤细胞生长、增殖及侵袭。研究显示FIB与成纤维细胞生长因子2(fibroblast growth factors-2,FGF-2) 和血管内皮生长因子(vascular endothelial growth factor,VEGF) 相互作用,促进了肿瘤生长和所需血管的形成[25]。Witsch等[26]发现生长因子受体过表达时可能与生长因子高度反应,如HNSCC患者中的表皮生长因子受体(epidermal growth factor receptor,EGFR)等表达上调会增强FIB参与和促进肿瘤细胞增殖、局部侵袭及血管生成的功能。
肿瘤疾病晚期总体预后差,致死率高。现认为老龄、吸烟及饮酒、人乳头瘤病毒感染和TNM分期等均是HNSCC患者的预后因素[27]。对于FIB与肿瘤的不良预后关系,有研究显示FIB与胃癌、结直肠癌、食管癌、胰腺癌、肺癌、卵巢癌、乳腺癌等全身多种肿瘤皆有相关性[28-30]。FIB主要参与机体血液凝固及血栓形成等病理生理过程,除此之外,近年多项研究提示其与头颈部肿瘤关系密切。有研究显示,FIB水平与晚期喉癌患者中位生存期呈显著负相关,可将其作为评估患者预后及生存状况的指标[31]。由伟等[23]也发现FIB是影响头颈部肿瘤患者预后的独立因素。为探讨局部晚期HNSCC患者FIB水平与诱导化疗联合根治性放疗的治疗效果,本研究将114例患者分为高FIB组与低FIB组,对2组患者诱导化疗前的FIB水平进行比较分析,发现单因素及多因素分析结果都显示高FIB组患者比低FIB组患者OS率及PFS率更低,说明FIB异常升高者,生存状况往往越差。
综上所述,本研究结果提示诱导化疗前血浆中较高浓度的FIB是影响局部晚期HNSCC患者预后的一个独立危险因素,可用来评估局部晚期HNSCC预后。临床工作中可长期进行外周血FIB监测,重视FIB检查结果并结合其他临床参数来判断患者病情,从而为患者选择最佳治疗方案。故对于局部晚期HNSCC患者而言,可以考虑采用诱导化疗前的FIB血浆浓度来评估患者病情及非手术治疗效果。
利益冲突 无
作者贡献声明 王小艳负责实施研究、分析和论文撰写;李媛媛指导实验和论文修改;杨阳负责数据采集和处理;金风、吴伟莉材料支持;龙金华、罗秀玲协助数据处理;龚修云、陈潇潇指导实验
| [1] |
Marur S, Forastiere AA. Head and neck squamous cell carcinoma: Update on epidemiology, diagnosis, and treatment[J]. Mayo Clin Proc, 2016, 91(3): 386-396. DOI:10.1016/j.mayocp.2015.12.017 |
| [2] |
Chow L. Head and neck cancer[J]. N Engl J Med, 2020, 382(1): 60-72. DOI:10.1056/NEJMra1715715 |
| [3] |
Hitt R, Grau JJ, López-Pousa A, et al. A randomized phase Ⅲ trial comparing induction chemotherapy followed by emoradiotherapy versus chemoradiotherapy alone as treatment of unresectable head and neck cancer[J]. Ann Oncol, 2014, 25(1): 216-225. DOI:10.1093/annonc/mdt461 |
| [4] |
Blanchard P, Bourhis J, Lacas B, et al. Taxane-cisplatin-fluorouracil as induction chemotherapy in locally advanced head and neck cancers: an individual patient data meta-analysis of the meta-analysis of chemotherapy in head and neck cancer group[J]. J Clin Oncol, 2013, 31(23): 2854-2860. DOI:10.1200/JCO.2012.47.7802 |
| [5] |
Janoray G, Pointreau Y, Garaud P, et al. Long-term results of a multicenter randomized phase Ⅲ trial of induction chemotherapy with cisplatin, 5-fluorouracil, ±docetaxel for larynx preservation[J]. J Natl Cancer Inst, 2016, 108(4): djv368. DOI:10.1093/jnci/djv368 |
| [6] |
Zhang F, Wang Y, Sun P, et al. Fibrinogen promotes malignant biological tumor behavior involving epithelial-mesenchymal transition via the p-AKT/p-mTOR pathway in esophageal squamous cell carcinoma[J]. J Cancer Res Clin Oncol, 2017, 143(12): 2413-2424. DOI:10.1007/s00432-017-2493-4 |
| [7] |
Biggerstaff JP, Seth N, Amirkhosravi A, et al. Soluble fibrin augments platelet/tumor cell adherence in vitro and in vivo, and enhances experimental metastasis[J]. Clin Exp Metastasis, 1999, 17(8): 723-730. DOI:10.1023/a:1006763827882 |
| [8] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247. DOI:10.1016/j.ejca.2008.10.026 |
| [9] |
夏莉莉, 安常明. 口腔微生物菌群与头颈部鳞状细胞癌研究进展[J]. 国际耳鼻咽喉头颈外科杂志, 2021, 45(1): 27-31. Xia LL, An CM. Research progress on oral microbiota and head and neck squamous cell carcinoma[J]. Int J Otolaryngol-Head Neck Surg, 2021, 45(1): 27-31. DOI:10.3760/cma.j.issn.1673-4106.2021.01.007 |
| [10] |
Izawa N, Onozawa Y, Hikosaka T, et al. Efficacy and feasibility of docetaxel, cisplatin, and 5-fluorouracil induction chemotherapy for locally advanced head and neck squamous cell carcinoma classified as clinical nodal stage N2c, N3, or N2b with supraclavicular lymph node metastases[J]. Inter J Clin Oncol, 2015, 20(3): 455-462. DOI:10.1007/s10147-014-0749-4 |
| [11] |
Ghi MG, Paccagnella A, Ferrari D, et al. Induction TPF followed by concomitant treatment versus concomitant treatment alone in locally advanced head and neck cancer. A phase Ⅱ-Ⅲ trial[J]. Ann Oncol, 2017, 28(9): 2206-2212. DOI:10.1093/annonc/mdx299 |
| [12] |
Pignon JP, le Maître A, Maillard E, et al. Meta-analysis of chemotherapy in head and neck cancer (MACH-NC): an update on 93 randomised trials and 17, 346 patients[J]. Radiother Oncol, 2009, 92(1): 4-14. DOI:10.1016/j.radonc.2009.04.014 |
| [13] |
Argiris A, Lefebvre JL. Laryngeal preservation strategies in locally advanced laryngeal and hypopharyngeal cancers[J]. Front Oncol, 2019, 9: 419. DOI:10.3389/fonc.2019.00419 |
| [14] |
Crusz SM, Balkwill FR. Inflammation and cancer: advances and new agents[J]. Nat Rev Clin Oncol, 2015, 12(10): 584-596. DOI:10.1038/nrclinonc.2015.105 |
| [15] |
Mantovani A, Allavena P, Sica A, et al. Cancer-related inflammation[J]. Nature, 2008, 454(7203): 436-444. DOI:10.1038/nature07205 |
| [16] |
Kumarasamy C, Tiwary V, Sunil K, et al. Prognostic utility of platelet-lymphocyte ratio, neutrophil-lymphocyte ratio and monocyte-lymphocyte ratio in head and neck cancers: a detailed PRISMA compliant systematic review and meta-analysis[J]. Cancers (Basel), 2021, 13(16): 4166. DOI:10.3390/cancers13164166 |
| [17] |
吴峰, 吴立连, 朱立新. 外周血中性粒细胞与淋巴细胞比值与头颈部鳞状细胞癌预后的关系[J]. 中华肿瘤杂志, 2017, 39(1): 29-32. Wu F, Wu LL, Zhu LX. Relationship between neutrophil-to-lymphocyte ratio in peripheral blood and prognosis of squamous cell carcinoma of the head and neck[J]. Chin J Oncology, 2017, 39(1): 29-32. DOI:10.3760/cma.j.issn.0253-3766.2017.01.006 |
| [18] |
Gentles AJ, Newman AM, Liu CL, et al. The prognostic landscape of genes and infiltrating immune cells across human cancers[J]. Nat Med, 2015, 21(8): 938-945. DOI:10.1038/nm.3909 |
| [19] |
Elinav E, Nowarski R, Thaiss CA, et al. Inflammation-induced cancer: crosstalk between tumours, immune cells and microorganisms[J]. Nat Rev Cancer, 2013, 13(11): 759-771. DOI:10.1038/nrc3611 |
| [20] |
程玉强, 张修平, 李楠, 等. 血小板与肿瘤转移关系的研究进展[J]. 肿瘤研究与临床, 2018, 30(4): 278-281. Cheng YQ, Zhang XP, Li N, et al. Research progress on the relationship between platelets and tumor metastasis[J]. Oncol Res and Clin Med, 2018, 30(4): 278-281. DOI:10.3760/cma.j.issn.1006-9801.2018.04.016 |
| [21] |
Takenaka Y, Oya R, Kitamiura T, et al. Platelet count and platelet-lymphocyte ratio as prognostic markers for head and neck squamous cell carcinoma: Meta-analysis[J]. Head Neck, 2018, 40(12): 2714-2723. DOI:10.1002/hed.25366 |
| [22] |
Heinz S, Braspenning J. Measurement of blood coagulation factor synthesis in cultures of human hepatocytes[M]. New York: Humana Press, 2015.
|
| [23] |
由伟, 王福光, 鞠再双, 等. 循环肿瘤细胞及纤维蛋白原在评估头颈部肿瘤预后中的作用[J]. 大连医科大学学报, 2020, 42(5): 410-418. You W, Wang FG, Ju ZS, et al. Role of circulating tumor cells and fibrinogen in evaluating the prognosis of head and neck tumors[J]. J Dalian Med Univ, 2020, 42(5): 410-418. DOI:10.11724/jdmu.2020.05.06 |
| [24] |
Mosesson MW. Fibrinogen and fibrin structure and functions[J]. J Thromb Haemost, 2005, 3(8): 1894-1904. DOI:10.1111/j.1538-7836.2005.01365.x |
| [25] |
Sahni A, Simpson-Haidaris PJ, Sahni SK, et al. Fibrinogen synthesized by cancer cells augments the proliferative effect of fibroblast growth factor-2 (FGF-2)[J]. J Thromb Haemost, 2008, 6(1): 176-183. DOI:10.1111/j.1538-7836.2007.02808.x |
| [26] |
Witsch E, Sela M, Yarden Y. Roles for growth factors in cancer progression[J]. Physiology (Bethesda), 2010, 25(2): 85-101. DOI:10.1152/physiol.00045.2009 |
| [27] |
Avilés-Jurado FX, León X. Prognostic factors in head and neck squamous cell carcinoma: comparison of CHAID decision trees technology and Cox analysis[J]. Head Neck, 2013, 35(6): 877-883. DOI:10.1002/hed.23058 |
| [28] |
Lin Y, Liu Z, Qiu Y, et al. Clinical significance of plasma D-dimer and fibrinogen in digestive cancer: a systematic review and meta-analysis[J]. Eur J Surg Oncol, 2018, 44(10): 1494-1503. DOI:10.1016/j.ejso.2018.07.052 |
| [29] |
Grafetstätter M, Hüsing A, González MS, et al. Plasma fibrinogen and sP-selectin are associated with the risk of lung cancer in a prospective study[J]. Cancer Epidemiol Biomarkers Prev, 2019, 28(7): 1221-1227. DOI:10.1158/1055-9965.EPI-18-1285 |
| [30] |
Izuegbuna OO, Agodirin OS, Olawumi HO, et al. Plasma D-dimer and fibrinogen levels correlates with tumor size and disease progression in nigerian breast cancer patients[J]. Cancer Invest, 2021, 39(8): 1-25. DOI:10.1080/07357907.2021.1909059 |
| [31] |
刘金玉, 梁玉珊, 卢杏娟, 等. 晚期喉癌患者D-二聚体、纤维蛋白原水平与化疗效果的关系研究[J]. 河北医药, 2018, 40(24): 3741-3744. Liu JY, Liang YS, Lu XJ, et al. Relationship between D-dimer and fibrinogen levels and chemotherapy effects in patients with advanced laryngeal cancer[J]. Hebei J Med, 2018, 40(24): 3741-3744. DOI:10.3969/j.issn.1002-7386.2018.24.014 |
 2022, Vol. 42
2022, Vol. 42


