2. 福建医科大学附属漳州市医院病理科, 漳州 363000;
3. 北京大学第三医院放疗科, 北京 100191
2. Department of Pathology, Zhangzhou Affiliated Hospital of Fujian Medical University, Zhangzhou 363000, China;
3. Department of Radiology, Peking University Third Hospital, Beijing 100191, China
子宫颈癌是妇女最常见的恶性肿瘤之一。目前,中国临床肿瘤学会(CSCO)指南及美国国立综合癌症网(NCCN)指南均推荐以铂类为基础的同步放化疗作为局部晚期子宫颈癌主要治疗方式[1-2]。局部晚期子宫颈癌5年生存率约为70%[3]。据流行病学统计,>65岁的子宫颈癌患者占40%,5年生存率仅为40.8%[4]。老年局部晚期子宫颈癌患者常伴有多种合并症,确诊时分期较晚,对同步放化疗这一标准治疗方案耐受性差,相较年轻患者预后欠佳[5]。因此,寻找高效、低毒的药物替代目前的标准治疗中的化疗药物具有十分重要的临床意义。
尼妥珠单抗是一种人源化IgG1型单克隆抗体,具有高度专一性、半衰期长和人源化程度高的特点,能特异性阻断表皮生长因子受体(epidermal growth factor receptor,EGFR)信号通路,从而抑制肿瘤细胞增殖并促进其凋亡。目前,有多项尼妥珠单抗联合放疗或联合同步放化疗治疗子宫颈癌的临床研究报道,结果均表现出良好的疗效及安全性[6-7]。但目前鲜有老年局部晚期子宫颈癌的相关研究。本研究通过回顾性分析探讨尼妥珠单抗联合放疗在老年局部晚期子宫颈癌中的安全性和疗效。
资料与方法1. 一般资料:回顾性分析2020年6月至2021年12月于福建医科大学附属漳州市医院完成尼妥珠单抗联合根治性放疗或同步放化疗治疗的老年局部晚期子宫颈癌患者共34例,中位年龄71.5岁(65~82岁),病理类型均为鳞状细胞癌。其中,尼妥珠单抗联合放疗组16例,未行同步化疗原因为化疗禁忌7例,拒绝同步化疗9例;尼妥珠单抗联合同步放化疗18例,化疗次数≥4次7例,< 4次11例。见表 1。
|
|
表 1 34例老年子宫颈癌患者的一般资料 Table 1 Characteristics of 34 elderly patients with locally advanced cervical cancer |
2. 入组标准:①纳入标准:初诊时年龄≥65岁;经组织学检验证实为局部晚期子宫颈鳞癌(Ⅱ~Ⅳ期);所有患者均使用2018年国际妇产科联盟(FIGO)分期系统;首次确诊并接受治疗;有可测量病灶;临床资料、影像学资料完整。②排除标准:合并乙肝活动期、梅毒活动期、艾滋病等传染性疾病;癌症已扩散至远处器官;合并有严重心肝肾功能不全;既往接受过子宫颈癌相关治疗。本研究经福建医科大学附属漳州市医院伦理委员会批准通过(批号:2021LWB047),纳入研究的患者及家属均签署知情同意书,符合《赫尔辛基宣言》原则。
3. 治疗方案
(1) 放疗方案:外照射采用适形调强放射治疗(IMRT)(静态调强),靶区包括:原发病灶,盆腔和/或腹主动脉淋巴引流区延伸野,大体肿瘤靶区(GTV)为宫颈原发灶,GTVnd定义为转移淋巴结,临床靶区(CTV)定义为包含GTV、GTVnd、宫颈、子宫双附件和阴道及髂总、髂内、髂外、骶前、闭孔、宫旁、阴道旁淋巴引流区(有髂总淋巴结转移或者腹主动脉旁淋巴结转移则包括腹主动脉淋巴结区),计划靶区(PTV)为CTV外放0.8 cm,PTVnd为GTVnd外放0.8 cm,PTV总剂量48.1 Gy/26次或48.6 Gy/27次,PTVnd给予56~60 Gy;累及阴道下1/3者,照射野包括腹股沟淋巴结引流区,总剂量45 Gy;宫旁受侵外照射不补量,采用后装近距离插植补量,总剂量30~40 Gy,A点/高危(high risk, HR)CTV D90累计剂量80~85 Gy;若肿瘤直径≥4 cm,A点/HR CTV D90累计剂量≥87 Gy。近距离放疗联合外照射治疗8周内完成。
(2) 同步化疗方案:奈达铂25~30 mg/m2,每周1次;治疗过程中停用化疗的原因包括:白细胞总数<3.0×109/L或血小板<50×109/L时,或血红蛋白<90 g/L,放射性肠炎2级,患者胃肠道反应大,评估难以耐受化疗。
(3) 靶向治疗方案:尼妥珠单抗200 mg,每周1次,缓慢静脉滴注,共3~6周。
4. 肿瘤测量:对治疗前及后装治疗前的盆腔磁共振(MRI)所显示肿物进行横断面及矢状面三维方向测量,最大测量值代表肿瘤大小。肿瘤退缩率(tumor regression rate, TRR)=(基线肿瘤大小-后装前肿瘤大小)/基线肿瘤大小×100%。
5. 疗效评价:近距离治疗结束后1个月行MRI进行肿瘤疗效评估,之后每3个月评估1次。按照实体肿瘤疗效评价标准(RECIST)1.1评价完全缓解(complete response, CR)、部分缓解(partial response, PR)情况,客观缓解率(objective response rate, ORR) = CR+PR,疾病控制率(disease control rate, DCR)=CR+PR+病情稳定(SD)。无进展生存期(progression-free survival,PFS)定义为从治疗开始到肿瘤发生(任何方面)进展或(因任何原因)死亡的时间。总生存(overall survival,OS)定义为从治疗开始至(因任何原因)死亡的时间。无病生存期(disease-free survival,DFS)定义为从治疗开始至疾病复发或(因任何原因)死亡的时间。肿瘤特异性生存率(cancer specific survival, CSS)定义为首次诊断患癌之日至因癌症死亡之日或最后一次随访之日。全部患者随访,指标包括临床表现、症状特征、影像学检查等。中位随访时间13.3个月(6.1~24.3个月)。不良反应根据常见不良反应评价标准(CTCAE)5.0以及美国肿瘤放射治疗协作组/欧洲癌症研究与治疗组织(RTOG/EORTC)急性放射损伤分级标准进行评价。
6. 统计学处理:运用SPSS 20.0软件进行数据分析,采用描述性统计对人口学等数据进行报告。符合正态分布计量资料采用x±s进行统计描述,采用配对t检验;不符合正态分布计量资料采用Wilcoxon配对秩和检验。计数资料采用频数、构成比进行统计描述,根据疗效评估结果计算ORR,采用Kaplan-Meier法进行生存分析,Log-rank法检验生存差异。P < 0.05为差异有统计学意义。
结果1. 疗效分析:总计34例患者中,24例(70.6%)达到CR,8例(23.5%)达到PR,ORR为94.1%(32例)。在尼妥珠单抗联合放疗组和联合同步放化疗组中,分别有11例(68.8%)和13例(72.2%)达到CR,5例(31.3%)和3例(16.7%)达到PR,ORR为100%(16例)和88.9%(16例)。
所有患者放疗前肿瘤直径为(49.56±19.22)mm,尼妥珠单抗联合外照射治疗后,肿瘤直径为(19.61±14.59)mm,差异具有统计学意义(Z= - 5.09, P < 0.05),TRR=59.22%。其中,在肿瘤直径≥50 mm的14例患者中,放疗前肿瘤直径(69.50±12.23)mm,尼妥珠单抗联合外照射治疗后,肿瘤直径(26.64±18.04)mm,与治疗前比较差异具有统计学意义(t=9.20, P < 0.05),TRR =61.67%。外照射后肿瘤直径退缩至3 cm以下共28例。尼妥珠单抗联合放疗组中,放疗前与外照射后肿瘤直径分别为47.56±20.73和(20.05±16.67)mm,TRR=57.84%。尼妥珠单抗联合同步放化疗组中,放疗前和外照射后肿瘤直径分别为(52.16±18.61)和(19.00±12.95)mm,TRR=63.57%。
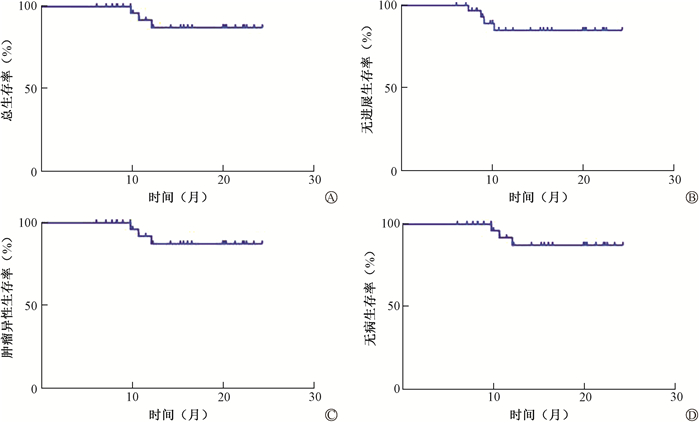
所有患者的1、2年PFS分别为84.9%、84.9%,OS分别为91.8%、87.2%,DFS分别为91.8%、87.2%,CSS分别为95.7%、90.9%。其中,尼妥珠单抗联合放疗组的1、1.5年PFS、OS、DFS、CSS均为100%;尼妥珠单抗联合同步放化疗组的1、2年PFS分别为76.7%、76.7%,OS分别为88.2%、82.4%,DFS分别为88.2%、82.4%,CSS分别为88.2%、82.4%,两组比较差异均无统计学意义(P>0.05,图 1)。
|
图 1 Kaplan-Meier法对患者生存曲线分析 A.总生存;B.无进展生存;C.肿瘤特异性生存;D.无病生存 Figure 1 Kaplan-Meier estimates of survival in patients A. Overall survival (OS); B. Progression-free survival (PFS); C. Cancer-specific survival (CSS); D. Disease-free survival (DFS) |
治疗前,患者鳞状细胞癌抗原(squamous cell carcinoma, SCC)为(18.73±23.77)ng/ml,外照射治疗后为(1.91±1.86)ng/ml,差异具有统计学意义(Z= - 5.05,P < 0.05)。
2. 不良反应:尼妥珠联合治疗局部晚期老年子宫颈癌患者主要不良反应为放射性肠炎、白细胞减少、低蛋白血症和贫血,以1~2级为主,3级不良反应为白细胞减少,发生率8.8%,未观察到4级不良反应,见表 2。
|
|
表 2 不同不良反应在两组老年子宫颈癌患者中的例数 Table 2 The number of the different adverse reactions of two groups patients with locally advanced cervical cancer |
讨论
老年局部晚期子宫颈癌患者,根据分期选择手术、放疗或同步放化疗治疗后,1年OS率为69.9%[8],1年CSS为80.0%[9]。单纯近距离放射治疗老年局部晚期子宫颈癌患者1年DFS为30%~72%[10]。目前尚缺乏老年局部晚期子宫颈癌的放疗最佳同步化疗或靶向、免疫治疗报道,标准化治疗方案亟待解决。
子宫颈癌以鳞癌为主,EGFR在子宫颈鳞癌的表达率高达85%[11],而EGFR的过表达与肿瘤的不良预后密切相关[12]。尼妥珠单抗在鼻咽癌同步放化疗中的疗效和安全性已得到验证,而在子宫颈癌同步放化疗中,既往亦有多项研究表明其疗效及安全性良好:Cao等[6]和Chen等[7]研究显示尼妥珠单抗联合同步放化疗相较于单纯的同步放化疗可以明显提高局晚期宫颈癌患者的近期疗效和远期疗效,并且安全可耐受。此外,有基础研究提示尼妥珠单抗具有放射增敏的作用[13]。
老年子宫颈癌患者预后差的主要原因是分期较晚和无标准化治疗手段[9]。老年局部晚期子宫颈癌对同步放化疗的耐受性差,化疗完成比例较低,且并发症多,目前尚无特别理想的同步放化疗、靶向或者免疫治疗方案以提高老年局部晚期子宫颈癌的综合疗效。本研究首次聚焦于老年局部晚期子宫颈癌,探索尼妥珠单抗同步放疗的疗效和安全性。
本研究在尼妥珠单抗联合放疗或同步放化疗结束1个月后进行影像学评估,CR率为70.6%,ORR为94.1%。既往Cao等[6]在局部晚期子宫颈癌患者(中位年龄56岁,38~67岁)中采用尼妥珠单抗联合同步放化疗,CR率为63.0%,ORR为87.0%;Chen等[7]在局晚期子宫颈癌患者(中位年龄52岁,20~65岁)中采用尼妥珠单抗联合同步放化疗,CR率为78.3%,ORR为87.0%;陈杰等[14]对61例局部晚期子宫颈癌患者(中位年龄53岁,33~70岁)采用尼妥珠单抗联合TP方案或铂类单药同步放化疗,CR率为70.5%,ORR为85.3%。本研究结果与以上研究结果相似,提示尼妥珠单抗联合放疗/放化疗治疗老年局晚期子宫颈癌具有良好的近期疗效。
本研究随访结果显示,所有患者的1年OS、CSS和DFS均优于既往放疗或放化疗治疗局部晚期子宫颈癌患者的研究[8-10];2年OS、CSS和DFS也均优于Naumann等[15]报道的2年OS率49.8%和Zhang等[16]报道的2年CSS率60.6%~79.6%,以及Lèguevaque等[17]报道的2年DFS率66%,提示尼妥珠单抗治疗老年局晚期子宫颈癌具有良好的疗效,但本研究需要随访更长的时间以获取更远期疗效。
老年局部晚期子宫颈癌同步放化疗耐受性差,接受尼妥珠单抗联合同步放化疗的大部分患者未完成4次以上化疗,主要原因为:中粒细胞减少、放射性肠炎、因不良反应患者拒绝继续化疗。但即使未完成4周期化疗,本组人群仍可全部完成放疗联合尼妥珠单抗治疗,且疗效和单纯放疗联合尼妥珠组相似,提示对于老年局部晚期宫颈癌患者,放疗联合尼妥珠单抗耐受性优于放化疗联合尼妥珠单抗;两组疗效差异无统计学意义,可能与化疗完成率低及老年人对化疗不耐受,化疗增加治疗不良反应有关,提示对于一般情况欠佳不耐受化疗的患者,单纯放疗联合尼妥珠单抗是安全有效的。
Escande等[18]对于子宫颈癌后装治疗研究表明,子宫颈癌患者盆腔淋巴结转移和肿瘤直径≥3 cm与较差的DFS相关。并且,外照射后肿瘤缩小到3 cm以下对于后装靶区覆盖及近距离治疗疗效有很大益处,亦能减少后装治疗的困难及降低后装治疗不良反应。本研究整组人群放疗前,肿瘤直径(49.56±19.22)mm,其中肿瘤直径≥50 mm的患者14例,尼妥珠单抗联合外照射治疗后,肿瘤直径(19.61±14.59)mm,有28例肿瘤最大径退缩到 < 3 cm,达到很好的缩瘤效果。本研究纳入的人群肿瘤负荷较大,单纯外照射缩瘤效果有限,对于该部分化疗耐受差、存在禁忌证或拒绝化疗的老年局部晚期子宫颈癌患者,加入尼妥珠单抗能提高外照射缩瘤率,从而提高后装靶区覆盖和剂量,提高局部控制率,降低复发,同时减少后装插植范围大带来的不良反应。
SCC水平升高可见于83%的子宫颈癌,SCC的水平与疾病的分期、肿瘤的大小和基质浸润的程度有明显的相关性,是子宫颈癌患者治疗前最佳的独立预后因子,其水平高低对预后具有预测价值[19]。Micke等[20]研究发现,治疗期间SCC水平可以反映肿瘤的响应率,若治疗前SCC升高的患者治疗中没有显著下降,患者的缓解率和预后都将较差。本研究加入尼妥珠单抗治疗后SCC水平显著下降,疗效良好。
本研究主要不良反应事件依次为放射性肠炎、白细胞减少、低蛋白血症、贫血共23例。以1~2级不良反应为主,未观察到4级以上的不良反应。其中,尼妥珠单抗联合同步放化疗组不良反应发生率略高于尼妥珠单抗联合放疗组。既往Wang等[21]的研究中使用放疗或同步放化疗治疗老年子宫颈癌的3级血液学不良反应发生率达31.5%;而Tian等[22]采用诱导化疗序贯同步放化疗治疗局部晚期子宫颈癌的研究中,3~4级肠道不良反应发生率约为21.7%。王坚等[23]回顾性分析422例宫颈癌患者的放疗不良反应,其中3级及以上的骨髓抑制、放射性肠炎发生率分别为27.7%、17.3%,同步放化疗组高于单纯放疗组。而本研究人群为老年局部晚期子宫颈癌患者,一般情况基线因素等较上述研究人群更差,加入尼妥珠单抗并未增加不良反应发生率,与既往同步放化疗或单纯放疗治疗宫颈癌的相关研究比较,3级以上不良反应少,尼妥珠单抗联合放疗在老年子宫颈癌患者中具有较好的安全性。
本研究显示尼妥珠单抗联合放疗或同步放化疗治疗老年局部晚期子宫颈癌安全有效。对于无法耐受同步化放疗的老年局部晚期子宫颈癌患者,尼妥珠单抗联合放疗可作为新的选择,但本研究为回顾性研究,样本量少、随访时间较短。有必要进一步开展大样本的前瞻性研究以验证其在老年局部晚期子宫颈癌的远期疗效以及安全性,并进一步探索EGFR表达与治疗疗效的相关关系。
利益冲突 无
作者贡献声明 卓延红负责研究方案设计、数据分析、论文撰写;王尤佳、陈丽民、郑春暖、李艺敏负责病例收集;陈惠琴、江萍、李永斌负责统计分析;王俊杰、黄建丽负责指导论文撰写
| [1] |
Abu-Rustum NR, Yashar CM, Bean S, et al. NCCN guidelines insights: Cervical cancer, version. 2022[EB/OL]. (2021-10-26)[2022-05-01]. https://www.nccn.org/guidelines/guidelines-detail?category=1&id=1426.
|
| [2] |
中国临床肿瘤学会指南工作委员会组织. 中国临床肿瘤学会(CSCO)宫颈癌诊疗指南-2022[M]. 北京: 人民卫生出版社, 2022. Working Committee on Guidelines of Chinese Society of Clinical Oncology. Chinese Society of Clinical Oncology (CSCO) guidelines for the diagnosis and treatment of cervical cancer-2022[M]. Beijing: People's Medical Publishing House, 2022. |
| [3] |
Cohen PA, Jhingran A, Oaknin A, et al. Cervical cancer[J]. Lancet, 2019, 393(10167): 169-182. DOI:10.1016/S0140-6736(18)32470-X |
| [4] |
Inoue S, Ito H, Hosono S, et al. Net survival of elderly patients with gynecological cancer aged over 75 years in 2006-2008[J]. Asian Pac J Cancer Prev, 2019, 20(2): 437-442. DOI:10.31557/APJCP.2019.20.2.437 |
| [5] |
Darlin L, Borgfeldt C, Widén E, et al. Elderly women above screening age diagnosed with cervical cancer have a worse prognosis[J]. Anticancer Res, 2014, 34(9): 5147-5151. |
| [6] |
Cao Y, Deng L, Lian S, et al. Research on the efficacy of cisplatin and nimotuzumab combined with concurrent chemoradiotherapy on locally advanced cervical cancer[J]. J BUON, 2019, 24(5): 2013-2019. |
| [7] |
Chen W, Li T, Wang J, et al. Clinical study of nimotuzumab combined with concurrent radiochemotherapy for treatment of locally advanced cervical cancer[J]. Cancer Manag Res, 2019, 11: 8157-8165. DOI:10.2147/CMAR.S191134 |
| [8] |
Barben J, Kamga AM, Dabakuyo-Yonli TS, et al. Cervical cancer in older women: Does age matter?[J]. Maturitas, 2022, 158: 40-46. DOI:10.1016/j.maturitas.2021.11.011 |
| [9] |
Xie S, Pan S, Zou S, et al. Characteristics and treatments of patients aged 65 years or over with cervical cancer[J]. Clin Interv Aging, 2020, 15: 841-851. DOI:10.2147/CIA.S255305 |
| [10] |
Opfermann KJ, Wahlquist A, Watkins J, et al. Impact of point A asymmetry on local control and survival for low dose-rate (LDR) brachytherapy in cervical cancer[J]. J Contemp Brachytherapy, 2012, 4(1): 3-7. DOI:10.5114/jcb.2012.27945 |
| [11] |
Small W Jr, Bacon MA, Bajaj A, et al. Cervical cancer: A global health crisis[J]. Cancer, 2017, 123(13): 2404-2412. DOI:10.1002/cncr.30667 |
| [12] |
del Campo JM, Prat A, Gil-Moreno A, et al. Update on novel therapeutic agents for cervical cancer[J]. Gynecol Oncol, 2008, 110(3 Suppl 2): S72-76. DOI:10.1016/j.ygyno.2008.04.016 |
| [13] |
Xu Z, Shu H, Zhang F, et al. Nimotuzumab combined with irradiation enhances the inhibition to the HPV16 E6-promoted growth of cervical squamous cell carcinoma[J]. Front Oncol, 2020, 10: 1327. DOI:10.3389/fonc.2020.01327 |
| [14] |
陈杰, 曹元杰, 朱莉, 等. 尼妥珠单抗联合同步放化疗治疗局部晚期宫颈癌的临床观察[J]. 中华医学杂志, 2021, 101(8): 597-601. Chen J, Cao YJ, Zhu L, et al. Clinical observational study of Nimotuzumab combined with concurrent chemoradiotherapy in the treatment of locally advanced cervical cancer[J]. Natl Med J China, 2021, 101(8): 597-601. DOI:10.3760/cma.j.cn112137-20201104-03011 |
| [15] |
Naumann RW, Hollebecque A, Meyer T, et al. Safety and efficacy of nivolumab monotherapy in recurrent or metastatic cervical, vaginal, or vulvar carcinoma: results from the phase Ⅰ/Ⅱ CheckMate 358 trial[J]. J Clin Oncol, 2019, 37(31): 2825-2834. DOI:10.1200/JCO.19.00739 |
| [16] |
Zhang W, Gao Y, Zhang W, et al. Survival outcomes and prognostic factors of papillary serous adenocarcinoma and papillary squamous cell carcinoma of the uterine cervix[J]. J Obstet Gynaecol, 2022, 42(5): 1233-1238. DOI:10.1080/01443615.2021.1945559 |
| [17] |
Lèguevaque P, Motton S, Delannes M, et al. Completion surgery or not after concurrent chemoradiotherapy for locally advanced cervical cancer?[J]. Eur J Obstet Gynecol Reprod Biol, 2011, 155(2): 188-192. DOI:10.1016/j.ejogrb.2010.11.016 |
| [18] |
Escande A, Gouy S, Mazeron R, et al. Outcome of early stage cervical cancer patients treated according to a radiosurgical approach: Clinical results and prognostic factors[J]. Gynecol Oncol, 2017, 144(3): 541-546. DOI:10.1016/j.ygyno.2016.12.026 |
| [19] |
陈君茂, 徐策. SCC水平对宫颈癌和卵巢癌患者手术联合新辅助化疗敏感性及疗效预测价值的比较分析[J]. 实用癌症杂志, 2018, 33(3): 500-502, 506. Chen JM, Xu C. Comparative analysis of SCC levels in predicting neoadjuvant chemotherapy sensitivity and efficacy of cervical cancer and ovarian cancer after surgery[J]. Pract J Cancer, 2018, 33(3): 500-502, 506. DOI:10.3969/j.issn.1001-5930.2018.03.044 |
| [20] |
Micke O, Bruns F, Schäfer U, et al. The impact of squamous cell carcinoma (SCC) antigen in patients with advanced cancer of uterine cervix treated with (chemo-)radiotherapy[J]. Anticancer Res, 2005, 25(3A): 1663-1666. |
| [21] |
Wang W, Hou X, Yan J, et al. Outcome and toxicity of radical radiotherapy or concurrent chemoradiotherapy for elderly cervical cancer women[J]. BMC Cancer, 2017, 17(1): 510. DOI:10.1186/s12885-017-3503-2 |
| [22] |
Tian X, Yang F, Li F, et al. A comparison of different schemes of neoadjuvant chemotherapy followed by concurrent chemotherapy and radiotherapy for locally advanced cervical cancer: a retrospective study[J]. Cancer Manag Res, 2021, 13: 8307-8316. DOI:10.2147/CMAR.S328309 |
| [23] |
王坚, 胡莉钧, 于波, 等. 422例宫颈癌患者调强放疗加后装治疗的不良反应和预后因素分析[J]. 中华放射医学与防护杂志, 2019, 39(11): 807-812. Wang J, Hu LJ, Yu B, et al. Adverse events and prognosis analysis in 422 cervical cancer patients after intensity modulated radiation therapy combined with brachytherapy[J]. Chin J Radiol Med Prot, 2019, 39(11): 807-812. DOI:10.3760/cma.j.issn.0254-5098.2019.11.002 |
 2022, Vol. 42
2022, Vol. 42


