同步放化疗是局部晚期非小细胞肺癌(locally advanced non-small cell lung cancer, LA-NSCLC)和局限期小细胞肺癌(limited stage small cell lung cancer, LS-SCLC)的标准治疗模式[1-3]。然而,同步放化疗由于治疗强度的加大使患者的耐受性降低。文献报道仅有约60%的患者能够按时足量的完成同步放化疗[4],主要原因之一是中性粒细胞减少症。中性粒细胞减少症会影响治疗的顺利进行,引起严重并发症[5-6],导致住院时间延长和治疗费用的增加[7]。
聚乙二醇化重组人粒细胞集落刺激因子(PEG-rhG-CSF)广泛用于化疗患者中粒细胞减少症的治疗[8]。但由于既往的一项临床研究发现在同步放化疗期间使用该类药物会显著增加血液不良反应的发生率[9],所以美国国立综合癌症网络(NCCN)指南不推荐在同步放化疗时联合使用。但2021年,CONVERT研究的数据显示,LS-SCLC同步放化疗联合重组人粒细胞集落刺激因子(recombinant human granulocyte colony-stimulating factor,rhG-CSF)并没有出现更严重的不良反应[10]。同年,我国学者也发表了同步放化疗期间预防应用PEG-rhG-CSF的专家共识[11]。这表明在精确放疗技术条件下,可以联合使用rhG-CSF类药物预防中性粒细胞减少症。但是目前在肺癌患者同步放化疗期间联合PEG-rhG-CSF的用药方案和疗效有待验证。本研究通过回顾性分析肺癌患者同步放化疗期间患者的血液学不良反应与放化疗的完成情况,进一步评价预防性使用PEG-rhG-CSF的作用。
资料与方法1. 临床资料:从数据库中提取2020年4月至2021年4月于北京大学肿瘤医院接受胸部病灶放化疗的LA-NSCLC及LS-SCLC患者。排除接受单纯放疗、序贯放化疗和缺少血液学检查资料的患者。允许纳入同步放化疗前后接受诱导/巩固化疗的患者。最终筛选出149例符合条件的患者。
2. 分组方法:根据PEG-rhG-CSF的使用方式分为初级预防组(又称一级预防)、次级预防组(又称二级预防)和未预防组。初级预防组定义为在化疗全程的每周期用药后1周内使用PEG-rhG-CSF。次级预防组定义为既往化疗周期中出现过中性粒细胞减少症,在随后的化疗周期用药后1周内使用PEG-rhG-CSF。未预防组定义为未使用PEG-rhG-CSF或rhG-CSF药物预防,仅在必要时给予挽救治疗。
3. 所有患者均接受同步放化疗。LA-NSCLC患者胸部放疗的处方剂量为60~66 Gy/28~33次。LS-SCLC患者胸部放疗方案包括超分割方案和常规分割方案。超分割方案的处方剂量为45~54 Gy/30次,每天2次。常规分割方案的处方剂量为60~64 Gy/30~32次。同步化疗药物及剂量见表 1。专家共识不建议在每周方案同步放化疗中预防性使用PEG-rhG-CSF[11],同时单药化疗强度较弱且非标准治疗,故没有纳入每周方案和单药方案的病例。在放疗期间接受2个周期同步化疗的患者定义为完成了足量的同步放化疗。
|
|
表 1 同步化疗剂量方案 Table 1 Dosage regimen of concurrent chemoradiotherapy |
4. 观察指标:放化疗期间3~4级中性粒细胞减少症(中性粒细胞计数<1.0×109/L);粒细胞缺乏伴发热的发生率(中性粒细胞计数<0.5×109/L且体温>38℃);同步放化疗足量完成率;放化疗剂量减量和治疗时间延迟的发生率;血液学不良反应相关住院率。
5. 统计学处理:采用SPSS 26.0软件进行统计分析。符合正态分布的计量资料采用独立样本t检验,计数资料采用χ2检验及Fisher精确检验等。P<0.05为差异有统计学意义。
结果1. 患者特征:全组149例患者,其中非小细胞肺癌92例(鳞癌53例、腺癌35例、大细胞癌1例、非特指型3例),小细胞癌57例。预防组患者共79例,分为初级预防组48例,次级预防组31例。未预防组患者70例。预防组及未预防组在病理类型、放疗分割方案和剂量、PTV体积、化疗方案和剂量、是否接受诱导或巩固化疗以及基线中性粒细胞绝对值计数方面较为均衡,组间差异无统计学意义。但预防组高龄(年龄>65岁以上)患者及女性患者多于未预防组。具体情况详见表 2。
|
|
表 2 全组149例患者基本情况 Table 2 The characteristics of 149 patients |
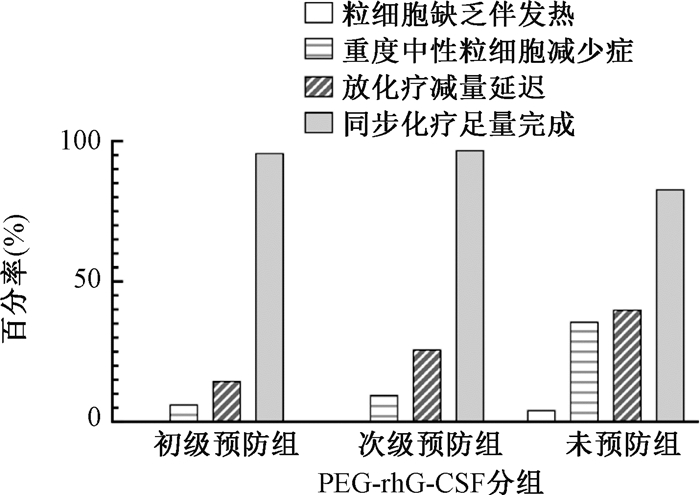
2. 疗效分析:PEG-rhG-CSF预防用药的效果见图 1。
|
图 1 不同PEG-rhG-CSF组的不良反应发生率及治疗完成情况 Figure 1 Incidence rate of adverse reactions and completion of treatment of different PEG-rhG-CSF groups |
(1) 中性粒细胞减少:全组患者在放化疗期间有48例(32.2%)患者出现了3~4级中性粒细胞减少,其中初级预防组3例,发生率为6.3%(3/48);次级预防组使用PEG-rhG-CSF前发生率为64.5%(20/31),预防后再次发生3例,发生率为9.7%(3/31);未预防组的发生率35.7%(25/70)。预防组(初级预防+次级预防组)与未预防组间差异有统计学意义(χ2=17.81, P<0.001),见表 3。采用常规分割放疗方案的患者中,放疗剂量>60 Gy的患者3~4级中性粒细胞减少发生率为24.4%(10/41),放疗剂量60 Gy的患者其发生率为29.3%(22/75),差异无统计学意义(P=0.569)。采用超分割放疗方案的患者中,放疗剂量54 Gy的患者3~4级中性粒细胞减少发生率为43.8%(7/16),放疗剂量45 Gy的患者其发生率为52.9%(9/17),差异无统计学意义(P=0.598)。
|
|
表 3 PEG-rhG-CSF不同治疗组主要观察指标的比较 (%) Table 3 Comparison of main observation indexes in different PEG-rhG-CSF groups (%) |
(2) 粒细胞缺乏伴发热(febrile neutropenia, FN):全组有5例患者在放化疗期间出现FN(5/149,3.4%),全部发生在未预防组和次级预防组使用PEG-rhG-CSF之前。初级预防组无患者发生FN。预防组(初级预防+次级预防组用药后)与未预防组的差异无统计学意义(P=0.202,表 3)。
(3) 同步放化疗足量完成率:预防组与未预防组同步放化疗足量完成率分别为96.2%(76/79)和82.9%(58/70),差异有统计学意义(χ2=7.30,P=0.007);初级预防组和次级预防组为95.8%(46/48)和96.8%(30/31)(P>0.999,表 3)。
(4) 放化疗剂量减量和治疗时间延迟:预防组和未预防组的放化疗剂量减量和治疗时间延迟发生率分别为19.0%(15/79)和40.0%(28/70),差异有统计学意义(χ2=7.98,P=0.005)。初级预防组和次级预防组的发生率为14.6%(7/48)和25.8%(8/31),差异无统计学意义(P=0.214)。放化疗剂量减量和治疗时间延迟的主要原因包括:中性粒细胞减少、血小板减少、全血细胞减少、非血液学不良反应及非医疗原因(放疗设备故障、医院或个人原因未按时入院等),见表 4。
|
|
表 4 放化疗剂量减量和治疗时间延迟的原因 (例) Table 4 Causes of dose reduction and treatment delay of chemoradiotherapy |
(5) 血液学不良反应相关住院率:全组有6例患者因血液学不良反应住院。其中初级预防组1例(2%),次级预防组1例(3.1%),原因均为全血细胞减少。非预防组4例,3例为中性粒细胞减少,1例为全血细胞减少。
讨论同步放化疗较单纯放疗/化疗会引起更为严重的血液学不良反应。有研究证实,对于非小细胞肺癌患者,同步放化疗时发生中性粒细胞减少症的风险比单纯放疗提高了3.53倍,比序贯放化疗提高了1.38倍[12]。文献报道在肺癌同步放化疗中的3~4级中性粒细胞减少症的发生率高达77%,FN发生率为16%[13]。本研究显示,未预防组相较预防组的3~4级中性粒细胞减少症的发生率从35.7%减少到7.6%,且患者使用PEG-rhG-CSF预防后未出现粒细胞缺乏伴发热的症状。这与刘芳等[14]在头颈部肿瘤同步放化疗中使用PEG-rhG-CSF的结果一致,在该研究中,预防性使用PEG-rhG-CSF组对比延迟性使用rhG-CSF的患者,粒细胞缺乏伴发热的发生率分别为0.96%和8.53%(P=0.023),3~4级中性粒细胞减少症的发生率明显下降(3.85% vs. 19.5%,P=0.001)。同时两组的按期给药率分别为96.2%和86.1%,差异接近有统计学意义(P=0.062)。
血液学不良反应引起放化疗中断和减量可以导致局部控制率及生存率的降低[15]。2017年的一项针对局部晚期非小细胞肺癌的研究显示,放疗期间出现中断的患者生存期更短,分别为18.6和22.7个月(P<0.001)[16]。同步放化疗的中断和减量可能影响疗效。在本研究中,未预防性使用PEG-rhG-CSF的患者放化疗剂量减量和治疗时间延迟的发生率为40.0%,而预防组可以显著降低至19.0%。有两项研究印证了这一结果。2021年一项针对宫颈癌的研究显示,同步放化疗期间使用PEG-rhG-CSF预防可使化疗延迟的发生率从61.11%降低至12.5%(P =0.001),同时也可降低3~4级中性粒细胞减少症和粒细胞缺乏伴发热的发生率[17]。另一项针对实体瘤的单臂观察性研究也报道,预防性使用PEG-rhG-CSF后,仅有5%和3%的患者因中性粒细胞减少症导致化疗和放疗的延迟[18]。
但是以上研究仅分析预防性使用PEG-rhG-CSF的疗效,而未提及其预防使用时机的作用。目前仍缺乏同步放化疗中初级预防对比次级预防疗效分析的临床数据。本研究中,由于次级预防组的患者在预防使用PEG-rhG-CSF前的化疗周期中出现过中性粒细胞减少症,所以在PEG-rhG-CSF预防前3~4级中性粒细胞减少症的发生率明显高于初级预防组。而两组在PEG-rhG-CSF预防后中性粒细胞减少症的发生率相当,表明两种预防使用时机均可有效降低中性粒细胞减少症发生率。初级预防组和次级预防组在同步放化疗足量完成率上并无显著差异(95.8% vs. 96.8%,P>0.999),这可能是由于本研究71.4%的患者接受了诱导化疗,在诱导化疗时发生了中性粒细胞减少症而接受PEG-rhG-CSF次级预防,起到了弥补作用,因此并没有影响到随后同步放化疗的足量完成。但是,由于PEG-rhG-CSF使用的滞后,相较于初级预防组,次级预防组放化疗剂量减量和治疗时间延长的发生率仍较高(14.6% vs. 25.8%),但两组间差异无统计学意义,其原因可能是亚组分析的样本量及事件数较少。该问题也可参考晚期肿瘤化疗的相关研究。2019年一项针对实体瘤单纯化疗的研究显示,化疗周期越长,初级预防组比次级预防组的FN发生率更低。初级预防组还能显著降低4级中性粒细胞减少症的发生[19]。根据以上结果,对于需要接受更多化疗周期的患者使用PEG-rhG-CSF初级预防可能更具优势。
目前虽有几项关于胸部肿瘤在同步放化疗期间使用PEG-rhG-CSF的疗效研究,但针对肺癌单病种的临床数据不多。2017年一项纳入了食管癌和肺癌患者的研究比较了预防性使用PEG-rhG-CSF和延迟性使用rhG-CSF的有效性。结果显示,预防性使用较之延迟性使用可以降低化疗延迟的发生率(5% vs. 17.69%,P=0.001),同时显著降低中性粒细胞减少症的发生率、抗生素的使用率及中性粒细胞减少相关的住院率[20]。2022年一项食管癌同步放化疗研究也显示PEG-rhG-CSF预防性使用对比延迟性使用,降低了3~4级中性粒细胞减少症的发生率(6.3% vs. 39.4% P=0.001)。预防组和延迟组同步放化疗足量完成率分别为93.8%和63.2%(P=0.002),放化疗中断的发生率为12.5%和36.8%(P=0.020)[21]。以上结果与本研究一致,显示了在胸部肿瘤同步放化疗期间使用PEG-rhG-CSF的有效性。
另有研究显示,LS-SCLC同步放化疗期间使用粒细胞-巨噬细胞刺激因子导致了严重的血小板减少症,而4级中性粒细胞减少症的发生率没有显著降低[9],这可能是受限于当时的常规二维放疗技术所致。本研究纳入患者均采用调强放疗技术,常规分割和超分割放疗方案中更高的放疗剂量并不会显著增加中性粒细胞减少症的发生率。本研究还发现同步放化疗期间预防性使用PEG-rhG-CSF降低了粒细胞缺乏导致的放化疗减量和治疗时间的延迟,这使得血小板减少导致的放化疗减量和治疗时间延迟占比明显增加(初级预防组55.6%,次级预防组45.5%,未预防组17.6%),并成为影响放化疗按计划进行的主要原因。
此项回顾性研究也存在一定局限性。由于回顾性资料记录不全,无法分析PEG-rhG-CSF导致的发热、骨痛等不良反应。预防组相比未预防组的患者年龄较大,女性偏多,可能存在选择偏倚;同时在化疗方案和剂量、诱导化疗、巩固化疗、总化疗周期方面不一致,存在一定混杂因素。
综上所述,肺癌同步放化疗期间初级预防和次级预防性使用PEG-rhG-CSF能有效降低中性粒细胞减少症的发生率,更好地保证同步放化疗的按计划进行。
利益冲突 无
作者贡献声明 董昕负责研究资料收集、数据整理、统计分析和论文撰写;余荣、邓玮、赵雨婷、姜蕾蕾、杨丹、于会明、石安辉负责提供数据;王维虎负责研究设计和论文修改
| [1] |
Spigel DR, Faivre-Finn C, Gray JE, et al. Five-year survival outcomes from the PACIFIC trial: durvalumab after chemoradiotherapy in stage Ⅲ non-small-cell lung cancer[J]. J Clin Oncol, 2022, 40(12): 1301-1311. DOI:10.1200/JCO.21.01308 |
| [2] |
Faivre-Finn C, Snee M, Ashcroft L, et al. Concurrent once-daily versus twice-daily chemoradiotherapy in patients with limited-stage small-cell lung cancer (CONVERT): an open-label, phase 3, randomised, superiority trial[J]. Lancet Oncol, 2017, 18(8): 1116-1125. DOI:10.1016/S1470-2045(17)30318-2 |
| [3] |
Turrisi AT 3rd, Kim K, Blum R, et al. Twice-daily compared with once-daily thoracic radiotherapy in limited small-cell lung cancer treated concurrently with cisplatin and etoposide[J]. N Engl J Med, 1999, 340(4): 265-271. DOI:10.1056/NEJM199901283400403 |
| [4] |
Chan AT, Teo PM, Ngan RK, et al. Concurrent chemotherapy-radiotherapy compared with radiotherapy alone in locoregionally advanced nasopharyngeal carcinoma: progression-free survival analysis of a phase Ⅲ randomized trial[J]. J Clin Oncol, 2002, 20(8): 2038-2044. DOI:10.1200/JCO.2002.08.149 |
| [5] |
Clark OA, Lyman GH, Castro AA, et al. Colony-stimulating factors for chemotherapy-induced febrile neutropenia: a meta-analysis of randomized controlled trials[J]. J Clin Oncol, 2005, 23(18): 4198-4214. DOI:10.1200/JCO.2005.05.645 |
| [6] |
Ellis M. Febrile neutropenia[J]. Ann N Y Acad Sci, 2008, 1138: 329-350. DOI:10.1196/annals.1414.035 |
| [7] |
Kuderer NM, Dale DC, Crawford J, et al. Mortality, morbidity, and cost associated with febrile neutropenia in adult cancer patients[J]. Cancer, 2006, 106(10): 2258-2266. DOI:10.1002/cncr.21847 |
| [8] |
马军, 朱军, 徐兵河, 等. 聚乙二醇化重组人粒细胞刺激因子(PEG-rhG-CSF)临床应用中国专家共识[J]. 中国肿瘤临床, 2016, 43(7): 271-274. Ma J, Zhu J, Xu BH, et al. Chinese expert consensus on the clinical application of pegylated recombinant human granulocyte stimulating factor (PEG-rhG-CSF)[J]. Chin J Clin Oncol, 2016, 43(7): 271-274. DOI:10.3969/j.issn.1000-8179.2016.07.239 |
| [9] |
Bunn PA Jr, Crowley J, Kelly K, et al. Chemoradiotherapy with or without granulocyte-macrophage colony-stimulating factor in the treatment of limited-stage small-cell lung cancer: a prospective phase Ⅲ randomized study of the Southwest Oncology Group[J]. J Clin Oncol, 1995, 13(7): 1632-1641. DOI:10.1200/JCO.1995.13.7.1632 |
| [10] |
Gomes F, Faivre-Finn C, Mistry H, et al. Safety of G-CSF with concurrent chemo-radiotherapy in limited-stage small cell lung cancer - Secondary analysis of the randomised phase 3 CONVERT trial[J]. Lung Cancer, 2021, 153: 165-170. DOI:10.1016/j.lungcan.2021.01.025 |
| [11] |
中国医师协会放射肿瘤治疗医师分会, 中华医学会放射肿瘤治疗学分会, 中国抗癌协会肿瘤放射治疗专业委员会. 同步放化疗期间应用聚乙二醇化重组人粒细胞刺激因子中国专家共识(2020版)[J]. 国际肿瘤学杂志, 2021, 48(1): 11-17. Chinese Association of Radiation Oncologist, Branch of Chinese Medical Doctor Association, Chinese Society of Radiation Oncology, Branch of Chinese Medical Association, The Society of Radiation Therapy, Branch of China Anti-Cancer Association. Chinese expert consensus on pegylated recombinant human granulocyte stimulating factor during concurrent chemoradiotherapy (2020 version)[J]. J Int Oncol, 2021, 48(1): 11-17. DOI:10.3760/cma.j.cn371439-20201126-00002 |
| [12] |
O'Rourke N, Roqué I Figuls M, Farré Bernadó N, et al. Concurrent chemoradiotherapy in non-small cell lung cancer[J]. Cochrane Database Syst Rev, 2010(6): CD002140. DOI:10.1002/14651858.CD002140.pub3 |
| [13] |
Sekine I, Sumi M, Ito Y, et al. Phase I study of concurrent high-dose three-dimensional conformal radiotherapy with chemotherapy using cisplatin and vinorelbine for unresectable stage Ⅲ non-small-cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2012, 82(2): 953-959. DOI:10.1016/j.ijrobp.2011.01.008 |
| [14] |
刘芳, 俞伟, 梁岚清, 等. 聚乙二醇重组人粒细胞集落刺激因子预防头颈部肿瘤同步放化疗后中性粒细胞减少症的研究[J]. 中国临床保健杂志, 2015(4): 386-389. Liu F, Yu W, Liang LQ, et al. A clinical study of pegfilgrastim prevention neutropenia syndrome in patients with head and neck cancer after concurrent chemoradiotherapy[J]. Chin J Clin Healthcare, 2015(4): 386-389. DOI:10.3969/J.issn.1672-6790.2015.04.018 |
| [15] |
Videtic GM, Fung K, Tomiak AT, et al. Using treatment interruptions to palliate the toxicity from concurrent chemoradiation for limited small cell lung cancer decreases survival and disease control[J]. Lung Cancer, 2001, 33(2-3): 249-258. DOI:10.1016/s0169-5002(00)00240-3 |
| [16] |
McMillan MT, Ojerholm E, Verma V, et al. Radiation treatment time and overall survival in locally advanced non-small cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2017, 98(5): 1142-1152. DOI:10.1016/j.ijrobp.2017.04.004 |
| [17] |
Zou D, Guo M, Zhou Q. A clinical study of pegylated recombinant human granulocyte colony stimulating factor (PEG-rhG-CSF) in preventing neutropenia during concurrent chemoradiotherapy of cervical cancer[J]. BMC Cancer, 2021, 21(1): 661. DOI:10.1186/s12885-021-08364-9 |
| [18] |
陈扬, 王巍, 张瑞平, 等. PEG-rhG-CSF初级预防同步放化疗后中性粒细胞减少的有效性观察[J]. 中华放射肿瘤学杂志, 2021, 30(1): 66-70. Chen Y, Wang W, Zhang RP, et al. Efficacy of pegylated recombinant human granulocyte colony stimulating factor (PEG-rhG-CSF) therapy in the primary prevention of concurrent chemoradiotherapy-induced neutropenia[J]. Chin J Radiat Oncol, 2021, 30(1): 66-70. DOI:10.3760/cma.j.cn113030-20200324-00131 |
| [19] |
李惠平, 樊征夫, 郑虹, 等. 聚乙二醇化重组人粒细胞集落刺激因子初级与次级预防化疗后中性粒细胞减少的有效性和安全性临床研究[J]. 中国肿瘤临床, 2019, 46(14): 739-744. Li HP, Fan ZF, Zheng H, et al. Efficacy and safety of PEG-rhG-CSF therapy in the primary and secondary prevention of chemotherapy-induced neutropenia[J]. Chin J Clin Oncol, 2019, 46(14): 739-744. DOI:10.3969/j.issn.1000-8179.2019.14.967 |
| [20] |
Liu F, Du Y, Cai B, et al. A clinical study of polyethylene glycol recombinant human granulocyte colony-stimulating factor prevention neutropenia syndrome in patients with esophageal carcinoma and lung cancer after concurrent chemoradiotherapy[J]. J Cancer Res Ther, 2017, 13(5): 790-795. DOI:10.4103/jcrt.JCRT_320_17 |
| [21] |
Xin Dong, Wei Deng, Leilei Jiang, et al. A retrospective study of pegylated recombinant human granulocyte colony-stimulating factor (PEG-rhG-CSF) in preventing neutropenia during definitive concurrent chemoradiotherapy in patients with esophageal squamous carcinoma[J]. Radiat Med Prot, 2022, 03(2): 81-85. DOI:10.1016/j.radmp.2022.04.002 |
 2022, Vol. 42
2022, Vol. 42


