2. 清华大学工程物理系, 北京 100084
2. Department of Engineering Physics, Tsinghua University, Beijing 100084, China
立体定向体放射治疗(stereotactic body radiation therapy, SBRT)可代替手术治疗早期的、不能手术的非小细胞肺癌或胸腔内寡转移性疾病。射波刀(cyberknife)是全身肿瘤立体定向放射外科治疗设备之一,其采用计算机立体定位导向,自动追踪靶区;在先进的影像技术的引导下,可实时追踪靶目标位置,使靶区内放射剂量更大,靶区外剂量跌落更快,对靶区周围的危及器官损伤更小,从而达到精确治疗的目的[1-2]。射波刀同步呼吸追踪系统可联合金标追踪,其利用同步追踪系统和影像系统,关联患者体表运动幅度与体内金标运动幅度,建立患者的呼吸模型,实现肿瘤的四维照射,最大限度地提高了放射治疗的准确性[3]。经支气管镜植入金标技术逐渐兴起,尤其是电磁导航支气管镜(electromagnetic navigation bronchoscopy, ENB)的出现,可通过支气管内带微传感器的探头进入更细的支气管分支到达病灶或周围进行定位[4]。以往通过支气管植入的金标多是线性金标,其位移率高达10%~53%,而后,减少迁移率的非线性金标被开发出来,并将迁移率降低至8%[5]。基于以上研究结果,并考虑到金标植入体内的局限性,本研究设计一款可回收金属肺部弹簧圈定位标记(以下简称为可回收金标)及配套回收系统,探索在智能电磁导航支气管镜引导下植入可回收金标并实施射波刀同步呼吸追踪的可行性和有效性。
材料与方法1. 实验分组:在同一肺生物模型上设置多痰支气管环境组和湿润支气管环境组,多痰支气管环境组在生物猪肺的支气管内涂上超声耦合剂,模拟支气管湿润、多痰环境;湿润支气管环境组的生物猪肺保持支气管相对湿润环境。两组均在左、右肺后叶不同肺段支气管设计模拟病灶4处,位置相同,在各病灶周围分别设计植入4颗可回收金标。
2. 智能规划植入位点:大孔径螺旋CT(荷兰飞利浦公司,Brilliance CT Big Bore)扫描生物猪肺模型(常州朗合医疗,生物猪肺仿真模拟实验系统,PBM-01B),扫描参数120 kV,250 mA,层厚1 mm。初始规划阶段将获取的CT图像DICOM数据导入电磁导航支气管镜定位系统(常州朗合医疗,iLungTM电磁导航支气管镜定位系统EMND001A)进行三维重建,绘制出支气管内路径。基于金标植入原则在各模拟病灶周围的支气管中规划4个金标位置,并进行计算验证,确认植入位点[6]。
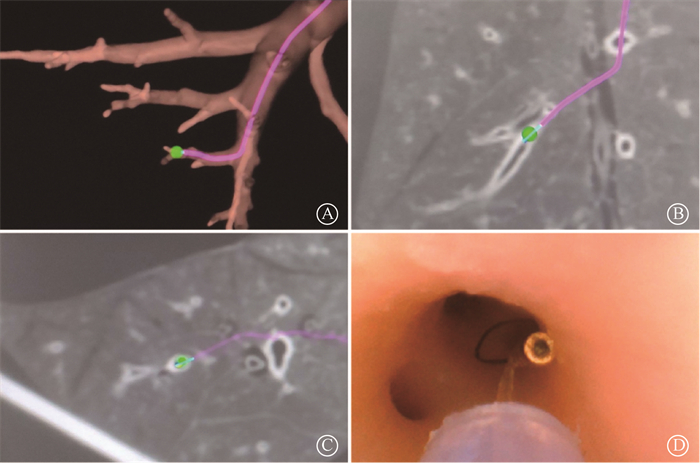
3. 电磁导航引导支气管镜植入:使用电磁导航支气管镜定位系统,将生物猪肺装置放置在其电磁定位板上,支气管镜进入肺内对支气管配准,使其解剖标志记录在磁场中,并覆盖在CT三维重建图上,利用多平面CT扫描图像和“尖端视图”定位,将传感器探头和工作通道导向预植入位点。当探头尖端与预植入位点之间达到最小距离(< 5 mm) 时,通过工作通道鞘将可回收金标(常州朗合医疗,FM001-D6/D8)植入该支气管内,操作界面如图 1所示。所使用可回收金标由0.8 mm×3.0 mm的金标本体与尾部弹性固定结构相连,总长度7 mm。全部植入后,对生物猪肺定位并做好标记,进行CT平扫,层厚1 mm,观察各个金标植入位置,并将图像上传至射波刀计划系统(Multiplan v4.6)。在规划位点放置可回收金标,其尾部螺旋线圈完全撑开,且CT影像或支气管镜观察显示金标完整形态记为成功植入。
|
注:系统根据植入位点(绿色圆点)生成植入导航路径(紫红色线条) 图 1 电磁导航支气管镜系统植入可回收金标操作界面 A.三维支气管树路径导航图;B.冠状面CT图像路径导航图;C.横断面CT图像路径导航图;D.到达位点后通过工作通道鞘将可回收金标植入该支气管内 Figure 1 Operation interfaces of ENB in recoverable fiducial marker implantatio A. Three-dimensional map showing the path navigation along a bronchial tree; B. Coronal diagram showing the CT image-based path navigation; C. Cross-section showing CT image-based path navigation; D. After reaching the target site, the recoverable fiducial marker is implanted into the bronchus via working channel sheath |
4. 射波刀同步呼吸追踪:使用射波刀计划系统勾画模拟肿瘤的大体肿瘤体积(GTV),标记出金标位置,每个治疗计划设计5分次,追踪方式采用Synchrony同步呼吸追踪联合金标追踪。射波刀追踪前根据定位标记线摆位,将体表呼吸监测标记贴于生物猪肺表面,依次采集呼吸周期中的8个点建立呼吸模型,监测生物猪肺模拟的周期呼吸运动下金标的追踪情况。成功追踪的金标组合将15 s拍摄1次实时X射线片,记录治疗数据于log文件中。射波刀影像上可识别并成功追踪用于施照的可回收金标记为成功追踪。
5. 金标回收:完成射波刀施照后,将抓取装置送入支气管镜工作通道鞘,利用装置前段的抓钳抓住可回收金标的头部,取出术前植入的所有金标。待取出金标后再次CT扫描扫描,确认生物猪肺内的金标全部取出,可回收金标不滞留在生物猪肺内记为成功取出。
6. 数据获取与分析:研究围绕支气管镜智能导航精度、植入可回收金标操作可行性、可回收金标稳定性以及射波刀追踪精度展开。实验前对支气管镜智能导航系统进行机械精度测试,在专业工装测试台下记录系统配准误差、平均配准时间以及平均导航时间。通过记录可回收金标的成功植入率与成功取出率评估操作可行性。通过射波刀靶区定位系统(target locating system,TLS)获得金标左右方向(LR)、前后方向(AP)和头脚方向(IS)的平移位置数据,并获取金标左右方向(roll)、俯仰方向(pitch)和平旋方向(yaw)的旋转位置数据,保存CDMS日志文件中,统计质心各方向平移修正偏差与旋转修正偏差,评估可回收金标稳定性。通过统计可回收金标追踪率与CDMS日志文件中金标刚性误差数据评估射波刀追踪精度。
7. 统计学处理:采用SPSS 26.0软件进行数据分析。质心平移修正偏差、旋转修正偏差、刚性误差数据符合正态分布,用x±s表示,组间比较采用Wilcoxon符号秩检验。P<0.05为差异有统计学意义。
结果1. 支气管镜智能导航精度:实验前,系统精度测试结果显示配准误差为(2.74±1.39)mm,平均配准时间为(4.25±0.89)min,平均导航时间为(3.38±1.89)min。实验根据CT扫描图像确认,所有8个目标模拟病灶导航均成功,系统能够导入CT影像数据,能够规划路径,完成配准。
2. 植入可回收金标操作可行性:追踪前操作顺利,智能导航系统在金标输送与取出操作上与支气管镜配合度好,8组实验在支气管镜智能磁导航引导下预计植入32个可回收金标,成功植入32个,植入成功率为100%。实验结束后32个金标取出,取出率100%。
3. 可回收金标稳定性:湿润支气管环境组与多痰支气管环境组各设计4组,分别采集到539和502个数据,各组的平移偏差、旋转偏差以及刚性误差均值详见表 1。湿润支气管环境组与多痰支气管环境组在左右方向平移偏差、左右方向旋转偏差、俯仰方向旋转偏差的差异均无统计学意义(P>0.05);在前后方向平移偏差(Z=-3.57,P < 0.01)及头脚方向平移偏差(Z=-2.53,P < 0.05)上,多痰支气管环境组稍高于湿润支气管环境组,差异有统计学意义;而平旋方向旋转偏差(Z=-3.88,P < 0.01)及刚性误差(Z=-3.32,P < 0.01)均低于湿润支气管环境组,差异均有统计学意义,见表 1。
|
|
表 1 两组生物猪肺模型的位移偏差与刚性误差数据(x±s) Table 1 The translational errors and rigid body errors of the two groups of pig lung models (x±s) |
4. 射波刀追踪精度:射波刀追踪过程中,所有成功植入的32个金标均可用于金标追踪,可追踪率100%。所有组刚性误差均<5 mm。
讨论呼吸运动是肺部肿瘤精准放射治疗的主要挑战,对于X射线平片影像上识别较差的低密度肿瘤的肺癌患者,使用金标追踪技术是射波刀放射治疗的最好选择。XsightⓇ肺追踪系统是目前应用较成熟的追踪技术,在一些研究中发现,其与金标追踪技术的肿瘤局部控制率相似[7]。然而,这种追踪系统有很大的局限性,如要求一定的肿瘤密度、最小尺寸、与关键器官的距离等,这些要求使得追踪的成功率只达到66%[8]。因此,射波刀金标追踪技术更适用于周围型早期非小细胞肺癌,或直径 < 25 mm、影像上密度较淡的肺部肿瘤。
目前,射波刀治疗肺癌患者的金标植入技术有3种入路方法,分别是经皮经胸穿刺入路、经血管穿刺入路以及经支气管入路。经皮经胸穿刺放置金标是传统上放置标记物的标准方法,也是目前主要的植入方式[9]。但以往的研究显示经胸穿刺植入金标的并发症发病率较高,气胸发生率为33%~67%,且3%的患者可能会出现严重的肺出血[5]。此外,经血管植入金标也是近年来出现的植入技术,血管内植入金属弹簧圈具有低并发症和成功率高的特点。但此方法不能对病灶组织进行活检,且需配备专用的血管造影基础设施和熟练的技术操作人员,对技术与设备要求较高,临床运用较难大范围开展[4]。经支气管入路的手术方式具有无辐射风险、术后并发症少的优势,正成为植入金标技术的主要选择,而通过ENB引导植入金标技术具有安全高效的发展潜力。目前,该技术的相关研究报道了1%~3%的低迁移率以及97%~100%的高病灶追踪率[10-12]。但使用ENB进行金标植入术需要专用的基础设备,且一旦患者处于电磁场中,需要中度至深度镇静以减少运动,这些可能影响该技术的使用范围[5]。
同步呼吸追踪治疗计划中金标追踪的效果与金标尺寸、空间分布关系密切,本实验所用可回收金标可被射波刀影像系统识别,智能导航系统可为植入金标的空间分布规划提供帮助。美国SuperDimension公司的电磁导航支气管镜系统在临床中使用较为广泛,其平均配准精度为4.5 mm[13]。本研究电磁导航支气管镜系统的配准误差为(2.74±1.39)mm,在精度方面有明显的优势。随着电磁导航技术与人工智能的发展,智能导航规划植入路径的辅助技术迎合需求。SuperDimension等电磁导航公司已推出相关智能导航功能产品,可在病灶周围进行测量后生成金标推荐植入位置,并在较小的气道中计算符合几何间隔的位置,以实现金标迁移最小化,但目前开展的临床研究较少,唯一报道的文献中由于设计问题,并非所有患者都实现植入不少于3个金标的追踪,因此系统仍有待改进,需要更完善的临床实践验证其精确度[14]。
金标的位置和稳定性对于实施SBRT是至关重要的,而植入后金标迁移的风险亦不可忽视,其滞留在体内有可能发生位移、咳出、堵塞气管等情况[15]。因此,本研究提出可在放射治疗后及时取出追踪金标,以减少后期金标位移与并发症风险。本研究设计的可回收金标在植入过程中未发生脱落与滑出情况,治疗期间均能被射波刀影像系统识别并追踪,治疗结束均能完成取回操作,整体操作可行性好。在实施同步呼吸追踪治疗期间,多痰支气管环境组与湿润支气管环境组的六维修正偏差结果无明显差异,多痰支气管环境组在前后方向及头脚方向的平移偏差稍高于湿润支气管环境组,可能是由于生物猪肺在左右与头脚方向的运动不确定度导致,平移偏差均在0.1 mm之内。平旋方向旋转偏差及刚性误差的结果显示,可回收金标没有因支气管环境的改变而加大偏差。因此,可回收金标两种环境下的支气管中仍有较好的稳定性。
由于本研究使用的生物猪肺是利用脉冲式负压仿生肺的呼吸运动,装置的气密性改变可能造成猪肺充气状态的轻微改变,造成金标位置的改变,产生系统误差。此外,虽然实验过程中增加固定装置以及相应措施,在生物猪肺的摆位过程中也可能产生摆位误差。为减低系统误差及保证实验重复性,每个治疗计划设计5分次,每分次治疗时间在30 min内,分次内生物猪肺保持呼吸运动,治疗计划持续3~5 d。在每分次摆位过程中,修正平移、旋转的6个方向偏差控制在1 mm以内,以此尽可能降低摆位误差带来的影响。目前,国内外尚未有文献提及在放射治疗后将植入的金标取出,相应的风险和受益也需要进一步的研究和探索,并且考虑到金标的固定性与取出的安全性,在金标的形状与材质设计还需要使用验证,对操作造成的组织损伤情况也需要进一步的验证和研究,探索可能存在的新问题。由于临床实践中该技术需要进行两次支气管镜术,且再次回收金标顺利与否与治疗前放置部位、放疗后局部肺组织和支气管损伤及治疗后时间有关,取出操作应在充分评估患者肺部情况后考虑实施。
综上所述,在保证定位准确的前提下,采用更安全的植入方式以及可回收的金标是目前技术发展的目标,也具有很大的挑战性,决定了精准放疗在肺部临床应用的未来发展趋势。为实现安全高效的肿瘤位置实时追踪、实现放疗的精确性,并避免金标滞留于患者体内,临床上需研发一款并发症少、定位精准、植入后稳定性强的可回收金标,将追踪金标与射波刀治疗技术相结合,有效提高射波刀的定位精度,改善治疗效果,降低并发症的发生率。
利益冲突 本研究由署名作者按以下贡献声明独立开展,未因进行该研究接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证
作者贡献声明 陈静、邓显智负责设计研究方案,研究实施及论文撰写;傅芬芳、郑芬、何善廷负责协助研究实施与收集实验数据;张建平、李小波提出研究思路与论文修改;徐本华、刘亚强负责技术指导
| [1] |
景生华, 李兵. 射波刀治疗肺部肿瘤追踪精度的初步分析[J]. 医疗卫生装备, 2014, 35(9): 94-96. Jing SH, Li B. Preliminary analysis of tracking accuracy about treatment of CK in lung tumor[J]. Chin Med Equip J, 2014, 35(9): 94-96. DOI:10.7687/j.issn.1003-8868.2014.09.094 |
| [2] |
王境生, 李丰彤, 董洋, 等. 射波刀5种追踪方法的原理[J]. 医疗卫生装备, 2013, 34(4): 130-132. Wang JS, Li FT, Dong Y, et al. Principles of five tracing methods for CyberKnife[J]. Chin Med Equip J, 2013, 34(4): 130-132. DOI:10.7687/j.issn.1003-8868.2013.04.130 |
| [3] |
Hoogeman M, Prévost JB, Nuyttens J, et al. Clinical accuracy of the respiratory tumor tracking system of the cyberknife: assessment by analysis of log files[J]. Int J Radiat Oncol Biol Phys, 2009, 74(1): 297-303. DOI:10.1016/j.ijrobp.2008.12.041 |
| [4] |
Casutt A, Noirez L, Bernasconi M, et al. Endobronchial coil spring fiducial markers for CyberKnifeⓇ stereotactic body radiation therapy[J]. Respirology, 2021, 26(5): 469-476. DOI:10.1111/resp.14006 |
| [5] |
Casutt A, Kinj R, Ozsahin EM, et al. Fiducial markers for stereotactic lung radiation therapy: review of the transthoracic, endovascular and endobronchial approaches[J]. Eur Respir Rev, 2022, 31(163): 210149. DOI:10.1183/16000617.0149-2021 |
| [6] |
Murphy MJ. Fiducial-based targeting accuracy for external-beam radiotherapy[J]. Med Phys, 2002, 29(3): 334-344. DOI:10.1118/1.1448823 |
| [7] |
Bahig H, Campeau MP, Vu T, et al. Predictive parameters of CyberKnife fiducial-less (XSight Lung) applicability for treatment of early non-small cell lung cancer: a single-center experience[J]. Int J Radiat Oncol Biol Phys, 2013, 87(3): 583-589. DOI:10.1016/j.ijrobp.2013.06.2048 |
| [8] |
de Bruin K, Dahele M, Mostafavi H, et al. Markerless real-time 3-dimensional kV tracking of lung tumors during free breathing stereotactic radiation therapy[J]. Adv Radiat Oncol, 2021, 6(4): 100705. DOI:10.1016/j.adro.2021.100705 |
| [9] |
Kord M, Kluge A, Kufeld M, et al. Risks and benefits of fiducial marker placement in tumor lesions for robotic radiosurgery: technical outcomes of 357 implantations[J]. Cancers (Basel), 2021, 13(19): 4838. DOI:10.3390/cancers13194838 |
| [10] |
Nabavizadeh N, Zhang J, Elliott DA, et al. Electromagnetic navigational bronchoscopy-guided fiducial markers for lung stereotactic body radiation therapy: analysis of safety, feasibility, and interfraction stability[J]. J Bronchol Interv Pulmonol, 2014, 21(2): 123-130. DOI:10.1097/LBR.0000000000000065 |
| [11] |
Schroeder C, Hejal R, Linden PA. Coil spring fiducial markers placed safely using navigation bronchoscopy in inoperable patients allows accurate delivery of CyberKnife stereotactic radiosurgery[J]. J Thorac Cardiovasc Surg, 2010, 140(5): 1137-1142. DOI:10.1016/j.jtcvs.2010.07.085 |
| [12] |
Minnich DJ, Bryant AS, Wei B, et al. Retention rate of electromagnetic navigation bronchoscopic placed fiducial markers for lung radiosurgery[J]. Ann Thorac Surg, 2015, 100(4): 1163-1165. DOI:10.1016/j.athoracsur.2015.04.060 |
| [13] |
Lamprecht B, Porsch P, Wegleitner B, et al. Electromagnetic navigation bronchoscopy (ENB): increasing diagnostic yield[J]. Respir Med, 2012, 106(5): 710-715. DOI:10.1016/j.rmed.2012.02.002 |
| [14] |
Stowe H, Ogake S, Sharma S, et al. Improved respiratory motion tracking through a novel fiducial marker placement guidance system during electromagnetic navigational bronchoscopy (ENB)[J]. Radiat Oncol, 2019, 14(1): 124. DOI:10.1186/s13014-019-1306-0 |
| [15] |
Belanger AR, Burks AC, Chambers DM, et al. Peripheral lung nodule diagnosis and fiducial marker placement using a novel tip-tracked electromagnetic navigation bronchoscopy system[J]. J Bronchology Interv Pulmonol, 2019, 26(1): 41-48. DOI:10.1097/LBR.0000000000000528 |
 2022, Vol. 42
2022, Vol. 42


