2. 中山大学肿瘤防治中心放疗科, 广州 510060;
3. 中国科学院大学附属肿瘤医院 浙江省肿瘤医院 I 期病房, 杭州 310022;
4. 中国科学院大学附属肿瘤医院 浙江省肿瘤医院胸部放疗科, 杭州 310022
2. Department of Radiation Oncology, Sun Yat-sen University Cancer Center, Guangzhou 510060, China;
3. Phase I Clinical Trial Ward, Cancer Hospital Affiliated to University of Chinese Academy of Science, Zhejiang Cancer Hospital, Hangzhou 310022, China;
4. Department of Chest Radiotherapy, Cancer Hospital Affiliated to University of Chinese Academy of Science, Zhejiang Cancer Hospital, Hangzhou 310022, China
对于早期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者,目前的标准治疗为体部立体定向放射治疗(stereotactic body radiation therapy,SBRT)或手术。已有研究表明,SBRT与手术的疗效无显著差异,且相较于手术,SBRT的耐受性更好[1-3]。但在临床实践中,大部分患者仍会选择手术治疗,而在根治性手术治疗后,有3%~10% 的患者出现肺内复发[4-6]。对于这部分患者,明确病灶为转移或第二原发是决定治疗方式的重要因素,虽然目前美国国立综合癌症网络指南优先推荐手术治疗,但患者对再次手术的不良反应的耐受能力明显下降,使得二次手术的适应证难以明确[7-8]。且目前比较SBRT和再次手术疗效差异的研究较少,本研究旨在探讨根治性手术后出现肺内复发的NSCLC患者,SBRT和再次手术治疗的疗效差异。
资料与方法1. 病例选择: 2012年11月至2018年12月在中国科学院大学附属肿瘤医院接受肺内病灶SBRT治疗或手术治疗的患者。纳入标准:治疗前临床分期为T1~3N0M0;在接受SBRT或手术治疗前曾因肺恶性肿瘤接受根治性手术,病理报告证实切缘阴性且病理类型为非小细胞肺癌。排除标准:在接受首次根治性切除时患者存在多原发病灶,术后针对未切除病灶接受SBRT或二次手术的患者;首次手术病理报告及术后辅助治疗不详的患者;有其他恶性肿瘤病史或合并其他恶性肿瘤的患者;复发灶为超中心复发即复发灶的计划靶区与中央支气管、食管或肺动脉接触或重叠,无法行SBRT的患者。
所有患者的数据收集和分析均得到伦理委员会的批准。患者原发灶根治术后的病理分期基于第8版美国癌症联合委员会(AJCC)TNM分期。对于术后肺内复发病灶的诊断和分期,基于影像学证据或病理学证据。部分患者采用B超或CT引导下经皮肺穿刺活检、支气管内镜或纵隔镜活检、肺泡灌洗液的脱落细胞、术中活检取得病理组织。因穿刺风险较大或拒绝穿刺活检无法取得病理组织的患者,依据胸部CT影像学形态特征、多次CT对比病灶直径增大、正电子发射计算机体层显像(positron emission tomography,PET-CT)氟代脱氧葡萄糖的最大标准摄取值(maximized standardized uptake value, SUVmax)>2.5、肿瘤标志物持续升高等临床证据,由胸部外科医生、胸部放疗科医生、放射科诊断医生等多学科讨论后综合判断。建议每位患者进行PET-CT检查,对于因经济原因或其他原因未行PET-CT检查的患者,在SBRT治疗前应进行同位素全身骨扫描(emission computed tomography,ECT)、腹部CT、头颅磁共振(magnetic resonance imaging,MRI)等检查排除其他部位转移。
2. 治疗方式:对于单纯肺内复发的患者,根据肿瘤的大小、深度及位置,以及原发病灶的特征,由胸部外科医生、胸部放疗科医生等多学科讨论选择合适的治疗方式。手术治疗包括开胸或腔镜下切除肿块及相应区域淋巴结清扫。对于术后出现淋巴结阳性的患者,由主管医生评估患者情况后辅助药物治疗。因合并症而无法手术或拒绝手术的患者选择SBRT。大体肿瘤靶区(gross tumor volume, GTV),包括原发灶周围短毛刺根部及胸膜侵犯区域;肿瘤内靶区(internal target volume, ITV)为肿瘤活动区,通过4D-CT技术评估;计划靶区(planning target volume, PTV)为在ITV的基础上从各个方向向外扩3~5 mm。生物等效剂量(biological effective dose, BED)计算方式为BEDα/β= nD(1+D/α/β),其中n为分割数,D为单次分割剂量,肿瘤组织的α/β取值为10 Gy[9]。
3. 随访:治疗后的随访内容包括病史,体格检查,肿瘤标记物,胸/腹部CT,通常在治疗后第1年,每2~3个月进行1次,治疗后第2年每3~6个月进行1次,两年后每6个月1次[9-10]。必要时也可进行头部MRI、ECT、PET-CT等。当病理学确认或影像学上可见持续超过6个月的局部磨玻璃样肿块增大,且肿块中的实性成分不断增加,即可诊断为肿瘤局部再次复发[11]。对于高度怀疑复发的患者,建议行PET-CT检查,PET-CT显示强摄取且SUVmax>2.5考虑为肿瘤复发[12]。
4. 生存情况:总生存(overall survival,OS):患者从接受SBRT或再次手术开始至因任何原因死亡的日期;无进展生存(progression-free survival, PFS):患者从接受SBRT或再次手术开始至发生任何部位复发转移或因任何原因导致死亡的日期;局部区域控制率(locoregional control rate,LRCR):患者从接受SBRT或再次手术开始至随访结束,未发生局部区域复发的比例。
生存结局均以患者为单位计算,末次随访未发生终点的情况记为删失。局部区域复发定义为:接受SBRT的病灶进展或肺门和纵隔淋巴结复发;接受手术的同一肺叶内复发(楔形或肺段切除)或手术残端复发(肺叶切除)或纵隔和肺门淋巴结复发。远处转移定义为除局部区域以外位置的复发。
5. 统计学处理:统计和制图利用SPSS 25.0和GraphPad Prism 8.0软件进行。生存结局指标采用Kaplan-Meier法计算,并通过Log-rank法进行组间对比。中位随访时间通过反Kaplan-Meier法计算。采用Cox比例风险模型进行单因素及多因素回归分析,除治疗方式外,单因素回归P<0.05的变量纳入多因素回归。P<0.05为差异有统计学意义。
结果1. 患者特征:收治的NSCLC根治术后肺内单纯复发患者总计62例,其中33例行SBRT治疗,29例行手术治疗。6例患者存在多发病灶(SBRT组3例,手术组3例),复发病灶数共14个(SBRT组8个,手术组6个)。两组间患者的性别、年龄、肺功能、体能状态、术后病理、复发时间隔等差异均无统计学意义(P>0.05)。SBRT组有PET-CT的患者共12例,9例患者存在病理明确的复发灶,24例未取病理。在接受SBRT的患者中,24例患者(26处病灶)BED达到100 Gy。手术组的患者中,肺叶切除13例,肺段切除6例,楔形切除10例;术后病理分期T1 25例,T2 4例,N0 26例,N1 3例。第二次治疗后两组共15例患者行辅助药物治疗,SBRT组6例,其中4例口服靶向药,2例行辅助化疗;手术组共9例,其中6例口服靶向药,4例行辅助化疗,见表 1。
|
|
表 1 SBRT组和手术组患者一般特征 Table 1 General characteristics of patients in the SBRT and surgery groups |
2. 生存分析:截至末次随访,SBRT组共有6例患者死亡,5例与肿瘤进展有关,1例原因未知。手术组2例患者死亡,1例与肿瘤进展有关,1例因心梗急性发作死亡。SBRT组中位随访时间为45.8个月(38.8~52.8个月),手术组中位随访时间为37.4个月(32.2~42.7个月)。SBRT组和手术组分别有14例患者出现进展。SBRT组8例出现局部区域复发(2例伴随远处转移),6例患者出现远处转移;手术组5例患者出现局部区域复发(3例伴随远处转移),12例患者出现远处转移。SBRT组1、3、5年的OS分别为94.1%、78.0%、78.0%;手术组分别为91.0%、85.5%、85.5%。SBRT组患者1、3、5年的LRCR分别为84.6%、79.8%、71.8%;手术组分别为96.0%、90.2%、54.1%。SBRT组患者1、3、5年的PFS分别为74.8%、58.5%、39.0%;手术组为56.2%、42.3%,5年PFS未达到。Log-rank检验提示,SBRT组和手术组LRCR、OS、PFS差异均无统计学意义(P>0.05),见图 1。
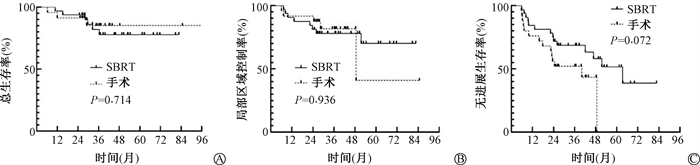
|
注:SBRT.体部立体定向放射治疗 图 1 SBRT组和手术组总生存率(A)、局部区域控制率(B)、无进展生存率(C)的生存曲线 Figure 1 OS (A), LRCR (B), and PFS (C) of the SBRT and surgery groups |
纳入年龄、性别、KPS评分、CCI指数、吸烟指数等变量进行单因素Cox回归分析,结果显示,对OS有利的因素为吸烟指数<400年支(P=0.004)、首次术后病理为腺癌(P=0.021);对LRCR有利的因素为吸烟指数<400(P=0.005)、CCI指数为0(P=0.006)、首次术后病理为腺癌(P=0.006);对PFS的有利因素为CCI指数为0(P=0.004)、辅助药物治疗(P<0.001),见表 2。
|
|
表 2 62例肺内复发患者预后影响的单因素Cox回归分析 Table 2 Univariate Cox regression analysis of prognostic factors for 62 patients with intrapulmonary recurrence |
依据单因素分析的结果展开多因素分析,结果显示,手术组患者较SBRT组患者有较差的PFS(HR 2.59,95%CI:1.11~6.05,P=0.027),CCI指数为2的患者较CCI指数为0的患者有较差的PFS(HR 8.22,95% CI:1.56~43.26,P=0.013),未辅助药物治疗的患者较辅助药物治疗的患者有较差的PFS(HR 0.25,95%CI:0.11~0.58,P=0.001)。其余各因素对OS和LRCR无影响,见表 3。
|
|
表 3 62例肺内复发患者预后影响的多因素Cox回归分析 Table 3 Multivariate Cox regression analysis of prognostic factors for 62 patients with intrapulmonary recurrence |
依据患者病灶来源展开分层生存分析,Log-Rank检验提示,SBRT组及手术组的PFS差异无统计学意义(P>0.05),见图 2。
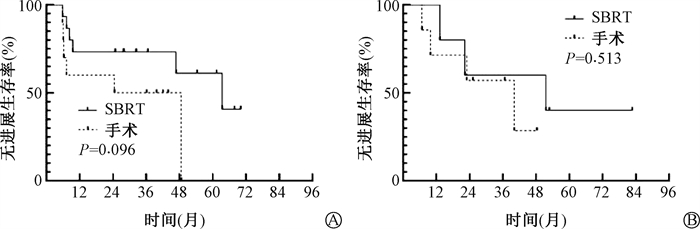
|
图 2 第二原发(A)及转移(B)患者的PFS的生存曲线 Figure 2 Progression-free survival of patients with primary(A) and metastasis(B) lesions |
3. 不良反应:SBRT组共6例患者死亡,其中5例与肿瘤进展有关;14例出现急性放射性肺炎,其中10例为1级,3例为2级,1例为3级。其余常见急性不良反应主要为咳嗽咳痰、乏力、放射性皮炎等,经过对症治疗后好转。未观察到4~5级不良反应。手术组共2例患者死亡,其中1例与肿瘤进展有关,1例为急性心肌梗塞。9例患者观察到1~2级并发症。两组均未观察到治疗相关死亡。
讨论对于接受根治性手术治疗后出现肺内局部复发的NSCLC患者,依据原发NSCLC的治疗手段,手术和SBRT都是可选的治疗方式[1-3]。但当局部疾病进展为全身性疾病时,局部治疗通常被认为好处有限。然而许多研究表明,对仅转移至肺部的病灶进行局部治疗有延长生存的作用[13-15]。此外,Lewis等[16]对来自43个国家的1 007名放射肿瘤学研究者进行调查发现,肺和肝是SBRT治疗颅外寡转移灶的主要器官,其中因为肺部病灶接受SBRT治疗的患者约占90%。一项回顾性研究分析了110名肺寡转移患者,其中42例SBRT治疗,68例接受手术治疗,5年OS分别为49%和41%,尽管每位患者均通过多学科讨论后决定治疗方式,将手术切除作为首选治疗(62%),SBRT作为次选治疗(38%),选择SBRT的患者通常年龄较大、原发肿瘤恶性程度更高、无转移生存期更短,但从生存曲线上看,SBRT组甚至高于手术组[17]。另有一项倾向得分匹配分析比较了SBRT和手术在异时性肺癌中的疗效,尽管手术组的患者有更好的体能状态及肺功能,但在倾向评分匹配前后,两组患者的5年OS均相似[18]。因此,SBRT也可作为术后肺内局部复发患者的治疗手段之一。
既往研究显示,治疗前的体能状态、病灶最大直径、原发肿瘤组织病理学、转移病灶数目以及肿瘤病灶诊断与治疗之间的时间间隔均显著影响OS[19]。在本研究中,SBRT组和手术组的基线特征相似且疗效相当,无论是SBRT组或手术组,都有相当不错的5年OS(85.5%和78.0%),这与SBRT和手术治疗早期原发NSCLC的OS在数值上相似[20-21]。在SBRT治疗原发性NSCLC的研究中,当SBRT的生物有效剂量(BED)至少达到100 Gy时,其LRCR与手术相当[22]。本项研究中有5例患者BED未达100 Gy,但两组患者的LRCR相似,在数值上相较于先前回顾性研究中治疗原发早期NSCLC患者的LRCR明显较差[3, 21],这可能是因为本研究并未明确区分肺内复发病灶为转移或第二原发。对于如何区分转移和第二原发,临床上尚未得出统一的观点。目前普遍认可的是Martini和Melamed [23]的观点:当病理学相同,复发时间间隔>2年或原位癌或病灶位于不同肺叶且没有淋巴结及远处转移时才可被认为是第二原发肺癌。SBRT组考虑为转移的患者有6例,考虑为第二原发的患者共27例;手术组考虑为转移的患者有4例,第二原发的患者共25例。针对病灶来源展开分层生存分析,手术组及SBRT组的疗效相当。美国胸科医师学会(ACCP)认为,当前后两个病灶组织病理学相同且没有远处转移时,复发间隔<2年则认为是转移,>4年则认为是第二原发[24]。根据多因素Cox回归结果,复发时间间隔与患者预后无关。全面的组织学特征评估能更准确地区分转移病灶与多原发病灶,但其受限于病理标本的获取及其质量[25]。对于术后肺内局部复发的病灶,其长径偏小故穿刺难度较大,且取得的标本往往限于细胞学评估而很难满足全面组织学特征评估的需要。同时,患者在术后拒绝进一步的有创操作也加大了获取病理标本的难度。因此,对于病灶病理条件不充分的情况,只能通过临床特征判断其来源。
目前,肺腺癌患者可针对基因突变采用靶向药物治疗,最常见的类型是EGFR阳性和ALK阳性[26]。这种个性化治疗现已成为肺腺癌的标准治疗方式之一[27]。靶向药的广泛应用显著延长了肺腺癌患者的生存期,而在鳞癌患者的治疗中尚无充分循证学依据,有研究表明,肺腺癌患者较肺鳞癌患者有更好的OS[28]。本研究中,SBRT组共4例患者出现基因突变,其中3例为EGFR阳性,1例为ALK阳性,均口服靶向药物;手术组共5例患者出现基因突变,均为EGFR阳性,其中4例口服靶向药物,另2例患者虽无基因突变,但仍自行购买靶向药物口服,这可能是腺癌较鳞癌预后更好的原因。但由于样本量较小,尚未对此开展进一步探索,期待更大规模的研究来验证这一观点。此外,有研究发现合并症较多会显著影响OS[29]。但在临床中,CCI指数较高的患者通常在接受药物治疗时因并发症难以耐受而减少药物剂量,这也可能会影响疾病进展。也有研究表明,CCI<1患者的PFS明显高于CCI≥1的患者,虽然该研究的对象是接受免疫治疗的NSCLC患者,但对本研究仍具有一定参考价值[30]。
本项研究的不足之处在于回顾性的本质,以及单中心研究的样本量较少,无法避免出现混杂偏倚。对于SBRT组的部分复发病灶因直径较小或部位靠近大血管不便穿刺而未取得病理,可能会影响病灶诊断对结果造成一定偏倚,同时也影响Cox回归的结果判读。基于现有的证据,难以明确哪种局部治疗方式能使患者获益更多,因而需要相关的前瞻性研究来解答。期待更大规模的多中心合作来进一步探讨手术与SBRT对NSCLC根治术后肺内复发病灶的疗效。
对于NSCLC根治术后肺内单纯复发的患者,基于现有证据,SBRT与手术的疗效差异无统计学意义。此外,明确病灶来源是决定采用局部治疗和(或)全身治疗的重要因素,亦是重要研究课题。
利益冲突 无
作者贡献声明 吴晴负责整理数据、统计分析和论文撰写;董百强、金佳男负责研究设计、整理病例资料和协助论文修改;杭青青、刘晓慧负责统计分析;徐裕金、陈明负责研究设计和修改论文
| [1] |
Dong BQ, Zhu X, Jin JN, et al. Comparison of the outcomes of sublobar resection and stereotactic body radiotherapy for stage T1-2N0M0 non-small cell lung cancer with tumor size ≤ 5 cm: a propensity score matching analysis[J]. J Thorac Dis, 2020, 12(10): 5934-5954. DOI:10.21037/jtd-20-2367 |
| [2] |
Dong BQ, Wang J, Zhu X, et al. Comparison of the outcomes of stereotactic body radiotherapy versus surgical treatment for elderly (≥ 70) patients with early-stage non-small cell lung cancer after propensity score matching[J]. Radiat Oncol, 2019, 14(1): 195. DOI:10.1186/s13014-019-1399-5 |
| [3] |
Chang JY, Senan S, Paul MA, et al. Stereotactic ablative radiotherapy versus lobectomy for operable stage I non-small-cell lung cancer: a pooled analysis of two randomised trials[J]. Lancet Oncol, 2015, 16(6): 630-637. DOI:10.1016/S1470-2045(15)70168-3 |
| [4] |
Endo C, Sakurada A, Notsuda H, et al. Results of long-term follow-up of patients with completely resected non-small cell lung cancer[J]. Ann Thorac Surg, 2012, 93(4): 1061-1068. DOI:10.1016/j.athoracsur.2012.01.004 |
| [5] |
Lou F, Huang J, Sima CS, et al. Patterns of recurrence and second primary lung cancer in early-stage lung cancer survivors followed with routine computed tomography surveillance[J]. J Thorac Cardiovasc Surg, 2013, 145(1): 75-81. DOI:10.1016/j.jtcvs.2012.09.030 |
| [6] |
al-Kattan K, Sepsas E, Fountain SW, et al. Disease recurrence after resection for stage I lung cancer[J]. Eur J Cardiothorac Surg, 1997, 12(3): 380-384. DOI:10.1016/s1010-7940(97)00198-x |
| [7] |
Erhunmwunsee L, Tong BC. Preoperative evaluation and indications for pulmonary metastasectomy[J]. Thorac Surg Clin, 2016, 26(1): 7-12. DOI:10.1016/j.thorsurg.2015.09.002 |
| [8] |
Petrella F, Chieco P, Solli P, et al. Which factors affect pulmonary function after lung metastasectomy?[J]. Eur J Cardiothorac Surg, 2009, 35(5): 792-796. DOI:10.1016/j.ejcts.2009.01.011 |
| [9] |
中华医学会放射肿瘤治疗学分会, 中国抗癌协会肿瘤放射治疗学专业委员会, 中国医师协会放射治疗医师分会. 早期非小细胞肺癌立体定向放疗中国专家共识(2019版)[J]. 中华肿瘤杂志, 2020, 42(7): 522-530. Radiation Oncology Branch of Chinese Medical Association, Radiation Therapy Committee of China Anti-Cancer Association, Radiation Oncologist Branch of Chinese Medical Doctor Association. Chinese expert consensus on stereotactic body radiation therapy for early stage non-small cell lung cancer (2019 Edition)[J]. Chin J Oncol, 2020, 42(7): 522-530. DOI:10.3760/cma.j.cnl12152-20200116-00039 |
| [10] |
刘伦旭, 高树庚, 何建行, 等. 非小细胞肺癌术后随访中国胸外科专家共识[J]. 中国胸心血管外科临床杂志, 2021, 28(1): 4-10. Liu LX, Gao SG, He JX, et al. Chinese thoracic surgery experts consensus on postoperative follow-up plans for non-small cell lung cancer patients[J]. Chin J Clin Thoracic Cardiovasc Surg, 2021, 28(1): 4-10. DOI:10.7507/1007-4848.202010032 |
| [11] |
Caulo A, Mirsadraee S, Maggi F, et al. Integrated imaging of non-small cell lung cancer recurrence: CT and PET-CT findings, possible pitfalls and risk of recurrence criteria[J]. Eur Radiol, 2012, 22(3): 588-606. DOI:10.1007/s00330-011-2299-8 |
| [12] |
Keidar Z, Haim N, Guralnik L, et al. PET/CT using 18F-FDG in suspected lung cancer recurrence: diagnostic value and impact on patient management[J]. J Nucl Med, 2004, 45(10): 1640-1646. |
| [13] |
Pfannschmidt J, Egerer G, Bischof M, et al. Surgical intervention for pulmonary metastases[J]. Dtsch Arztebl Int, 2012, 109(40): 645-651. DOI:10.3238/arztebl.2012.0645 |
| [14] |
Corona-Cruz JF, Domínguez-Parra LM, Saavedra-Pérez D, et al. Lung metastasectomy: long-term outcomes in an 18-year cohort from a single center[J]. Surg Oncol, 2012, 21(3): 237-244. DOI:10.1016/j.suronc.2012.05.003 |
| [15] |
Jang JW, Kay CS, You CR, et al. Simultaneous multitarget irradiation using helical tomotherapy for advanced hepatocellular carcinoma with multiple extrahepatic metastases[J]. Int J Radiat Oncol Biol Phys, 2009, 74(2): 412-418. DOI:10.1016/j.ijrobp.2008.08.034 |
| [16] |
Lewis SL, Porceddu S, Nakamura N, et al. Definitive stereotactic body radiotherapy (SBRT) for extracranial oligometastases: an international survey of >1000 radiation oncologists[J]. Am J Clin Oncol, 2017, 40(4): 418-422. DOI:10.1097/COC.0000000000000169 |
| [17] |
Widder J, Klinkenberg TJ, Ubbels JF, et al. Pulmonary oligometastases: metastasectomy or stereotactic ablative radiotherapy?[J]. Radiother Oncol, 2013, 107(3): 409-413. DOI:10.1016/j.radonc.2013.05.024 |
| [18] |
Miyazaki T, Yamazaki T, Sato S, et al. Surgery or stereotactic body radiotherapy for metachronous primary lung cancer? A propensity score matching analysis[J]. Gen Thorac Cardiovasc Surg, 2020, 68(11): 1305-1311. DOI:10.1007/s11748-020-01394-3 |
| [19] |
Rieber J, Streblow J, Uhlmann L, et al. Stereotactic body radiotherapy (SBRT) for medically inoperable lung metastases-A pooled analysis of the German working group "stereotactic radiotherapy"[J]. Lung Cancer, 2016, 97: 51-58. DOI:10.1016/j.lungcan.2016.04.012 |
| [20] |
Senthi S, Lagerwaard FJ, Haasbeek CJA, et al. Patterns of disease recurrence after stereotactic ablative radiotherapy for early stage non-small-cell lung cancer: a retrospective analysis[J]. Lancet Oncol, 2012, 13(8): 802-809. DOI:10.1016/S1470-2045(12)70242-5 |
| [21] |
Lagerwaard FJ, Verstegen NE, Haasbeek CJA, et al. Outcomes of stereotactic ablative radiotherapy in patients with potentially operable stage I non-small cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2012, 83(1): 348-353. DOI:10.1016/j.ijrobp.2011.06.2003 |
| [22] |
Davis JN, Medbery C, Sharma S, et al. Stereotactic body radiotherapy for centrally located early-stage non-small cell lung cancer or lung metastases from the RSSearch(Ⓡ) patient registry[J]. Radiat Oncol, 2015, 10: 113. DOI:10.1186/s13014-015-0417-5 |
| [23] |
Martini N, Melamed MR. Multiple primary lung cancers[J]. J Thorac Cardiovasc Surg, 1975, 70(4): 606-612. |
| [24] |
Shen KR, Meyers BF, Larner JM, et al. Special treatment issues in lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition)[J]. Chest, 2007, 132(Suppl): 290S-305S. DOI:10.1378/chest.07-1382 |
| [25] |
Girard N, Deshpande C, Lau C, et al. Comprehensive histologic assessment helps to differentiate multiple lung primary nonsmall cell carcinomas from metastases[J]. Am J Surg Pathol, 2009, 33(12): 1752-1764. DOI:10.1097/PAS.0b013e3181b8cf03 |
| [26] |
Garraway LA. Genomics-driven oncology: framework for an emerging paradigm[J]. J Clin Oncol, 2013, 31(15): 1806-1814. DOI:10.1200/JCO.2012.46.8934 |
| [27] |
Saito M, Suzuki H, Kono K, et al. Treatment of lung adenocarcinoma by molecular-targeted therapy and immunotherapy[J]. Surg Today, 2018, 48(1): 1-8. DOI:10.1007/s00595-017-1497-7 |
| [28] |
Zhao W, Choi YL, Song JY, et al. ALK, ROS1 and RET rearrangements in lung squamous cell carcinoma are very rare[J]. Lung Cancer, 2016, 94: 22-27. DOI:10.1016/j.lungcan.2016.01.011 |
| [29] |
Pylväläinen J, Talala K, Murtola T, et al. Charlson comorbidity index based on hospital episode statistics performs adequately in predicting mortality, but its discriminative ability diminishes over time[J]. Clin Epidemiol, 2019, 11: 923-932. DOI:10.2147/CLEP.S218697 |
| [30] |
Zeng XH, Zhu SC, Xu C, et al. Effect of comorbidity on outcomes of patients with advanced non-small cell lung cancer undergoing anti-PD1 immunotherapy[J]. Med Sci Monit, 2020, 26: e922576. DOI:10.12659/MSM.922576 |
 2022, Vol. 42
2022, Vol. 42


