微量元素指占机体总重量万分之一以下的元素。尽管存在水平微乎其微,但对生物体的生长发育和健康至关重要[1]。研究证明,金属元素的蓄积或缺乏会诱发机体不良反应、疾病、甚至死亡[2]。目前发现微量元素水平与糖尿病、肺癌、神经退行性疾病等相关[3-5]。氡气是一种惰性放射性气体,进一步衰变产生218Po、214Bi、210Pb等一系列氡子体[6]。这些子体可随呼吸进入体内,随血液循环分布全身[7]。研究表明,高浓度氡气可使肺癌发生率升高[8];也有学者提出会使胃癌、白血病等发生率升高[9]。近年来,已有空气中有害物质影响体内金属元素水平的报道[10-12],但还未见关于吸入氡气及其子体对体内金属元素含量影响的报道。氡染毒对机体微量元素平衡影响的研究对解析氡毒性具有一定的意义。
材料与方法1. 实验动物:SPF级雌性BALB/c小鼠40只,体重(17±1)g,购自北京维通利华实验动物中心,合格证号:SCXK(京)2016-0006。小鼠正常饮水进食,实验前适应性喂养1周。小鼠饲养在湿度恒定,22 ~ 26℃和12 h光/暗循环的环境中。实验动物许可证号:SYXK(军)2017-0023。本实验所进行的所有相关操作均在军事医学研究院动物伦理委员会的批准下进行,动物管理和使用均符合法规要求(审查编号:IACUC-DWZX-2020-503)。
2. 实验材料:超纯水:18.2 MΩ·cm超纯水(Milli-Q纯水机制备);硝酸痕量金属级(德国Honeywell Fluka公司);元素标准溶液:33种混合元素标准储备液及金元素单标溶液(加拿大SCP science公司);汞元素单标溶液内标溶液(美国Agilent Technologies公司):含有100 μg/ml的铋(Bi)、锗(Ge)、铟(In)、锂(Li6)、镥(Lu)、铑(Rh)、钪(Sc)、铽(Tb);质谱调谐液(美国Agilent Technologies公司):含有1.0 μg/L钡(Ba)、铋(Bi)、铈(Ce)、钴(Co)、铟(In)、锂(Li)和铀(U)的混合标准溶液;全血微量元素标准品(德国RECIPE公司)。
3. 主要仪器设备:HD-3型多功能生态氡室(苏州大学制造);电感耦合等离子体质谱仪(ICP-MS,美国Agilent Technologies Inc.公司,7790型)配备自动进样器(美国Agilent Technologies Inc.公司SPS4型);Milli-Q超纯水仪(美国Aillipore公司,Milli-Q Advantage A10型);MX-S型涡旋振荡器(美国Scilogex公司);无创肺功能检测仪(德国EMKA公司)。
4. 动物分组:40只7周龄左右雌性BALB/c小鼠,按随机数表法分为对照组、吸入氡气30 WLM组、60 WLM组、120 WLM组,每组10只。
5. 氡染毒动物模型:多功能生态氡室浓度设定为105 Bq/m3,根据在3 700 Bq/m3工作170 h为1 WLM计算,累积30、60、120 WLM分别需要11、22、45 d。染氡期间,氡室内温度设定为25℃,湿度设定为50%,12 h明暗交替,氧浓度恒定在21%,在此条件下小鼠自由饮水进食,并每周记录一次体重。
6. 肺功能检测及病理切片检查:达到累积剂量后用无创肺功能检测仪检测小鼠清醒无束缚状态下的通气功能,检测指标包括:吸气时间(TI)、呼气时间(TE)、最大吸气量(PIF)、最大呼气量(PEF)、潮气量(TV)、呼气量(EV)、呼吸频率(F)、松弛时间(RT)、每分钟呼气量(MV),小鼠处死后取4%多聚甲醛固定的肺组织,石蜡包埋、切片、脱水及水化,HE染色后在显微镜下观察并拍照分析。
7. 样品采集及制备:氡暴露结束24 h内,小鼠麻醉后摘眼球取血保存于无金属元素的15 ml离心管中,处死后取左肺组织保存于4%多聚甲醛固定液中,剩余肺组织及心脏、肝脏、脾脏、肾脏等脏器冻存于-80℃直至分析。临用前将样品取出放至常温,称重后转移至无金属元素的15 ml离心管中,加入2倍体积的70%硝酸,预消解2 h后98℃水浴消解2 h,待样品消解为无固体物的溶液后取出放至室温,用超纯水稀释至硝酸浓度在2%~3% 之间,混匀后4℃保存备用。
8. 电感耦合等离子体质谱方法检测金属元素:用电感耦合等离子体质谱(ICP-MS)测定金属Cr、Mn、Ni、As、Se、Mo、Ag、Cd、Pb、Co、Cu、Sn、Hg、Al、Zn组织中的含量,标曲范围是0.1~20 ng/ml和1~100 ng/ml。在样品测定之前首先调谐仪器,参数设置为:射频功率1 550 W,采样深度8 mm,雾化气1 L/min,蠕动泵0.1 r/s,稀释气体0.2 L/min,Omega偏转电压-85 V,Omega透镜电压10.7 V,碰撞池入口-40 V,出口-60 V,氦气流速5 ml/min,八极杆偏转电压-18.0 V,能量歧视5.0 V。随后进行精密度和准确度考察,用全血微量元素标准品进行回收率验证,结果显示低浓度的Sn标准品测定的含量为3.164 ng/g,超出标定范围(1.51~2.26 ng/g),但中浓度和高浓度均符合测定范围。可能是仪器本底过高,且测试的样品中Sn含量除肺组织外都低于定量下限,而肺组织中Sn含量高于中浓度标准品值,符合要求。其余均在定量范围内。
9. 统计学处理:采用Graphpad Prism8.3.0软件进行数据分析。数据符合正态分布和方差齐性,以x±s表示。采用单因素方差分析进行4组间比较,采用Tukey检验进行多重检验。P<0.05为差异有统计学意义。
结果1. 氡染毒对小鼠肺功能影响:无创肺功能检测结果如表 1所示。与对照组相比,染氡小鼠TI、PIF、PEF、TV、EV、MV降低,在60 WLM组差异均有统计学意义(P<0.05),120 WLM组有所恢复,与对照组相比,仅有PIF、PEF、MV差异有统计学意义(P<0.05)。表明氡染毒后小鼠肺通气功能降低,以短促的浅呼吸为主。
|
|
表 1 氡染毒小鼠肺功能的改变(x±s) Table 1 Changes of lung function of mice exposed to radon (x±s) |
2. 氡染毒对小鼠肺组织病理损伤:HE染色结果显示,对照组小鼠肺泡腔形态、结构正常,支气管、细支气管黏膜上皮完整,腔内干净无异物。染氡组小鼠肺脏被膜完整,在低倍镜下可以观察到局部肺泡隔轻度增宽,局部肺泡塌陷,部分肺泡融合,邻近区域肺泡腔代偿性扩张。高倍镜下,少量肺泡上皮细胞坏死、脱落,毛细血管扩张充血;肺间质中可见少量淋巴细胞等炎性细胞浸润。见图 1。
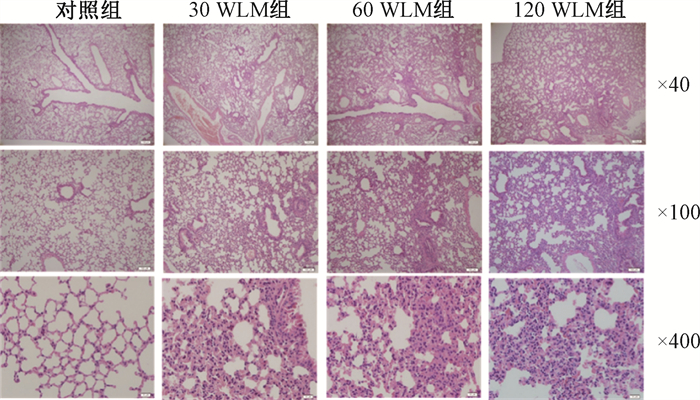
|
图 1 各组小鼠肺组织病理学改变HE染色 Figure 1 Histopathological images of the mice lungs in each group HE staining |
3. 染氡对全血中金属元素的影响:各组小鼠血液中含量有差异的金属元素见表 2。Cr、Mn、Zn、Mo在染氡组含量降低,120 WLM组Mn降低16.4%,Cr降低48.9%,Zn降低15.1%,Mo降低25.8%,与对照组相比差异有统计学意义(P<0.05)。Al在30 WLM组达到最低,随着染氡剂量的累积其含量逐渐回升,但120 WLM组与对照组相比,差异仍有统计学意义(P<0.05)。与对照组相比,As和Se在30 WLM组升高,差异有统计学意义(P<0.05),但是随着染氡剂量的继续累积,其含量逐渐降低。Fe是血红蛋白的主要组成部分,无论在血液中,还是其余组织中,其含量均超出定量上限。而Co、As、Ag、Cd、Sn、Pb是一些具有潜在毒性的元素,其在体内本身含量低,在消化处理后低于定量下限,因此表中未列出。
|
|
表 2 氡染毒小鼠血液中的金属含量(ng/g,x±s) Table 2 Metal contents in the blood of radon-exposed mice (ng/g, x±s) |
4. 肺组织中微量元素含量变化:各组小鼠肺部含量有差异的金属元素含量见表 3。与对照组相比,染氡组的Cr、Al、Sn、Pb含量降低,与对照组相比,染氡3组差异均有统计学意义(P<0.05),60 WLM组含量降至最低。相较于对照组,60 WLM组小鼠Cr含量降低43.1%,Al降低40.8%,Sn降低36.0%,Pb降低57.3%。120 WLM组有所恢复,但与对照组差异仍有统计学意义(P<0.05)。染氡组的Cu、Mo、Se、As含量升高,与对照组相比,Cu在120 WLM组增加13.9%,差异有统计学意义(P<0.05),60 WLM组Mo增加16.6%,Se增加28.8%,差异有统计学意义(P<0.05),染氡3组的As与对照组相比差异均有统计学意义(P<0.05),在60 WLM组含量达到最高,相较于对照组增加83.0%。
|
|
表 3 氡染毒小鼠肺部金属含量(ng/g,x±s) Table 3 Metal contents in the lungs of radon-exposed mice (ng/g, x±s) |
5. 心脏中微量元素的含量变化:在心脏中仅观察到Zn在染氡组含量降低,且在120 WLM组差异具有统计学意义。与对照组相比,120 WLM组Zn含量降低14.6%[(19 633±2 700)ng/g vs(16 755±1 335)ng/g,P < 0.05]。
6. 肝脏中微量元素含量变化:各组小鼠肝脏中含量有差异的金属元素含量见表 4。与对照组相比,在肝脏中观察到染氡组Cr的含量降低,60 WLM组与120 WLM相较于对照组差异有统计学意义(P<0.05)。Mn、Cu、Zn的含量升高,120 WLM组相较对照组Mn升高32.5%,Cu升高19.0%,Zn升高15.1%,差异具有统计学意义(P<0.05)。Hg和As的含量先升高后降低。在30 WLM组含量达到最高,与对照组相比30 WLM组Hg升高26.8%,As升高40.3%,差异有统计学意义(P<0.05)。
|
|
表 4 氡染毒小鼠肝脏中金属含量(ng/g,x±s) Table 4 Metal contents in the liver of radon-exposed mice (ng/g, x±s) |
7. 脾脏、肾脏中微量元素含量变化:各组小鼠脾脏中有差异的金属元素含量见表 5。在脾脏中观察到,与对照组相比,120 WLM组的小鼠体内Zn、Mn、Cu含量升高,Zn升高29.4%,Mn升高31.1%,Cu升高27.6%,差异有统计学意义(P<0.05)。Mo含量降低,在60 WLM组最低,相较于对照组降低30.0%,差异有统计学意义(P<0.05)。在肾脏中未观察到金属元素含量显著变化。
|
|
表 5 氡染毒小鼠脾脏中金属含量(ng/g,x±s) Table 5 Metal contents in the spleen of radon-exposed mice (ng/g, x±s) |
讨论
已有文献证明,长期暴露于高浓度氡气的小鼠在各组织内检测到氡子体210Po、210Pb的蓄积[13]。由此可引发肺部炎症、染色体断裂等损伤[14]。本研究在染氡小鼠肺部HE染色观察到肺间质有少量淋巴细胞等炎性细胞浸润,在60和120 WLM组现象较明显。肺功能指标中潮气量和呼吸频率决定了每分钟通气量,潮气量数值过低表示肺通气不足,肺水肿、纤维化等限制性肺部疾病通常表现为潮气量减少、呼吸频率增快的浅呼吸形式[15]。最大吸气量和最大呼气量可以反映呼吸肌力量的大小以及肺容积和顺应性,其数值减少表示呼吸肌疲劳,收缩无力[16]。本研究结果表明,长期暴露于高浓度氡气会诱发肺部炎症,导致通气功能降低。60 WLM组比120 WLM组肺通气功能低可能与染氡时间有关,根据氡气累积计算方法,累积60 WLM需要22 d,根据辐射损伤进程,这一时间是炎症最严重时期,随着时间延长炎症症状减轻[17]。因此推测60 WLM组肺通气功能最低与累积时间有关。
ICP-MS检测结果显示,染氡小鼠各个脏器内金属元素水平扰动,扰动最显著的是肺部和血液,且为必需微量元素和常见的具有潜在毒性的元素,例如Cr、Cu、Mn、Zn、Al、Pb等,而一些特定场景出现的元素如Ag、Cd、Hg等未在组织中检出。由结果可知,不同金属水平在给定的组织样本内差异可达5个数量级,同一金属在不同组织内仍有差异。不同金属之间浓度的巨大差异可归因于这些金属是否为必需金属,具有重要生物学作用的元素通常以高内源性水平存在,例如Zn和Cu,或者异生金属,如As和Pb,没有明确的生物学作用,因此通常以微量水平存在[10]。本研究结果显示,氡暴露小鼠的肺和血液中Cr、Al含量均降低,血液中Mn、Zn的含量也显著降低,但肝脏和脾脏中Mn、Zn含量显著升高,Cr、Al含量减少。有文献证明Pb、Cr、Al间有关联作用,Pb的外排会同步引起Cr、Al的减少[18],而Mn、Zn在肝脏和脾脏中含量增多可能是因为这两个脏器的蓄积功能。血液与肺组织金属水平变化趋势有一定关联性,例如都观察到Cr、Al的含量降低,但与其余脏器中的金属含量相关性不强,这是金属在体内代谢及血液循环的综合结果,因此,不能用血液中金属水平预测脏器内的金属水平。
这些检出的金属元素生理功能明确,并且体内缺少后可能引起的不良反应也是已知的。例如Cr,是胰岛素的关键辅助因子,Cr缺乏会导致心血管疾病发病率增加[19-20]。Zn是许多酶和蛋白质的辅助因子,在整个生长发育过程中发挥着重要作用[21]。研究证明,Zn缺乏与肺炎、生长迟缓、免疫系统功能障碍有关[22-23]。Cu是细胞色素10的一部分,与氧化应激、铁代谢等有关。Mn缺乏可能会诱发高胆固醇血症、皮炎、葡萄糖耐受量异常等反应[24]。
综上所述,本次实验发现吸入高浓度的氡以后小鼠肺通气功能降低,肺部发生炎症,体内金属元素水平出现波动,代谢性相关离子含量减少。这些现象都是因为氡子体沉积于体内引起的,金属水平扰动和肺功能降低是否有关联还需要进一步的研究。并且以上结果是一次实验数据分析所得,有一定的局限性,需要更大的样本量进行更复杂的分析。未来需要更多的研究来探索氡气及子体气溶胶对整个机体的影响而不局限于呼吸系统。还应该关注长期接触高浓度氡气人员体内代谢情况及可能诱发的慢性疾病。
利益冲突 无
作者贡献声明 刘慧蒙负责实验操作、数据分析和论文撰写;王美玉、陈广瑞、周慧雨协助实验;袁勇、孟志云、顾若兰、甘慧、吴卓娜和窦桂芳指导实验设计和论文修改
| [1] |
Bartzokis G, Tishler TA, Lu PH, et al. Brain ferritin iron may influence age-and gender-related risks of neurodegeneration[J]. Neurobiol Aging, 2007, 28(3): 414-423. DOI:10.1016/j.neurobiolaging.2006.02.005 |
| [2] |
Nieder R, Benbi DK, Reichl FX. Soil components and human health[M]. Berlin: Springer Dordrecht, 2018. DOI:10.1007/978-94-024-1222-2_1
|
| [3] |
Cicero CE, Mostile G, Vasta R, et al. Metals and neurodegenerative diseases. A systematic review[J]. Environ Res, 2017, 159: 82-94. DOI:10.1016/j.envres.2017.07.048 |
| [4] |
Foster HD. Disease family trees: the possible roles of iodine in goitre, cretinism, multiple sclerosis, amyotrophic lateral sclerosis, Alzheimer's and Parkinson's diseases and cancers of the thyroid, nervous system and skin[J]. Med Hypotheses, 1987, 24(3): 249-263. DOI:10.1016/0306-9877(87)90072-7 |
| [5] |
Pasha Q, Malik SA, Shah MH. Statistical analysis of trace metals in the plasma of cancer patients versus controls[J]. J Hazard Mater, 2008, 153(3): 1215-1221. DOI:10.1016/j.jhazmat.2007.09.115 |
| [6] |
Gillmore GK, Phillips PS, Denman AR. The effects of geology and the impact of seasonal correction factors on indoor radon levels: a case study approach[J]. J Environ Radioact, 2005, 84(3): 469-479. DOI:10.1016/j.jenvrad.2005.05.004 |
| [7] |
Porstend rfer J, Pagelkopf P, Gründel M. Fraction of the positive 218Po and 214Pb clusters in indoor air[J]. Radiat Prot Dosim, 2005, 113(3): 342-351. DOI:10.1093/rpd/nch465 |
| [8] |
Sorimachi A, Ishikawa T, Tokonami S, et al. An intercomparison for NIRS and NYU passive thoron gas detectors at NYU[J]. Health Phys, 2012, 102(4): 419-424. DOI:10.1097/HP.0b013e31823ecd5c |
| [9] |
Messier KP, Serre ML. Lung and stomach cancer associations with groundwater radon in North Carolina, USA[J]. Int J Epidemiol, 2017, 46(2): 676-685. DOI:10.1093/ije/dyw128 |
| [10] |
Re DB, Hilpert M, Saglimbeni B, et al. Exposure to e-cigarette aerosol over two months induces accumulation of neurotoxic metals and alteration of essential metals in mouse brain[J]. Environ Res, 2021, 202: 111557. DOI:10.1016/j.envres.2021.111557 |
| [11] |
Falcone LM, Erdely A, Kodali V, et al. Inhalation of iron-abundant gas metal arc welding-mild steel fume promotes lung tumors in mice[J]. Toxicology, 2018, 409: 24-32. DOI:10.1016/j.tox.2018.07.007 |
| [12] |
Zahedi A, Hassanvand MS, Jaafarzadeh N, et al. Effect of ambient air PM(2.5)-bound heavy metals on blood metal(loid)s and children's asthma and allergy pro-inflammatory (IgE, IL-4 and IL-13) biomarkers[J]. J Trace Elem Med Biol, 2021, 68: 126826. DOI:10.1016/j.jtemb.2021.126826 |
| [13] |
潘鹏, 杨占山, 王天昶, 等. 氡暴露后大鼠体内210Po的含量及分布测定[J]. 中华放射医学与防护杂志, 2007, 27(6): 534-536, 581. Pan P, Yang ZS, Wang Tc, et al. Contentration and distribution of 210Po in rats exposed to radon[J]. Chin J Radiol Med Prot, 2007, 27(6): 534-536, 581. |
| [14] |
Robertson A, Allen J, Laney R, et al. The cellular and molecular carcinogenic effects of radon exposure: a review[J]. Int J Mol Sci, 2013, 14(7): 14024-14063. DOI:10.3390/ijms140714024 |
| [15] |
Yu G, Tzouvelekis A, Wang R, et al. Thyroid hormone inhibits lung fibrosis in mice by improving epithelial mitochondrial function[J]. Nat Med, 2018, 24(1): 39-49. DOI:10.1038/nm.4447 |
| [16] |
Michaudel C, Fauconnier L, Julé Y, et al. Functional and morphological differences of the lung upon acute and chronic ozone exposure in mice[J]. Sci Rep, 2018, 8(1): 10611. DOI:10.1038/s41598-018-28261-9 |
| [17] |
Arroyo-Hernández M, Maldonado F, Lozano-Ruiz F, et al. Radiation-induced lung injury: current evidence[J]. BMC Pulm Med, 2021, 21(1): 9. DOI:10.1186/s12890-020-01376-4 |
| [18] |
Chen P, Miah MR, Aschner M. Metals and neurodegeneration[J]. F1000Res, 2016, 5: 366. DOI:10.12688/f1000research.7431.1 |
| [19] |
Vincent JB. Effects of chromium supplementation on body composition, human and animal health, and insulin and glucose metabolism[J]. Curr Opin Clin Nutr Metab Care, 2019, 22(6): 483-489. DOI:10.1097/MCO.0000000000000604 |
| [20] |
Sealls W, Penque BA, Elmendorf JS. Evidence that chromium modulates cellular cholesterol homeostasis and ABCA1 functionality impaired by hyperinsulinemia——brief report[J]. Arterioscler Thromb Vasc Biol, 2011, 31(5): 1139-1140. DOI:10.1161/ATVBAHA.110.222158 |
| [21] |
Moazed V, Jafari E, RashidiNezhad B, et al. Copper and zinc levels in myelodysplastic syndrome patients versus healthy subjects[J]. Asian Pac J Cancer Prev, 2020, 21(1): 239-241. DOI:10.31557/APJCP.2020.21.1.239 |
| [22] |
Grüngreiff K, Reinhold D, Wedemeyer H. The role of zinc in liver cirrhosis[J]. Ann Hepatol, 2016, 15(1): 7-16. DOI:10.5604/16652681.1184191 |
| [23] |
Lee SR. Critical role of zinc as either an antioxidant or a prooxidant in cellular systems[J]. Oxid Med Cell Longev, 2018, 2018: 9156285. DOI:10.1155/2018/9156285 |
| [24] |
O'Neal SL, Zheng W. Manganese toxicity upon overexposure: a decade in review[J]. Curr Environ Health Rep, 2015, 2(3): 315-328. DOI:10.1007/s40572-015-0056-x |
 2022, Vol. 42
2022, Vol. 42


