2. 火箭军特色医学中心检验科, 北京 100088;
3. 火箭军特色医学中心锦州医科大学研究生培养基地, 北京 100088;
4. 中国人民解放军军事科学院军事医学研究院辐射医学研究所, 北京 100850
2. Department of Clinical Laboratory, PLA Rocket Army Characteristic Medical Center, Beijing 100088, China;
3. Graduate Training Base of Jinzhou Medical University, PLA Rocket Army Characteristic Medical Center, Beijing 100088, China;
4. Institute of Radiation Medicine, Academy of Military Medical Sciences, Academy of Military Sciences, Beijing 100850, China
小肠黏膜上皮细胞是高度辐射敏感器官,终身在不断地自我更新,这一过程依赖小肠隐窝中干细胞的持续增殖、分化取代外层的终末分化细胞来完成。放射性肠炎(radiation enteritis,RE)是盆腔恶性肿瘤患者放疗后最常见的并发症,早期出现呕吐、腹泻、感染和体重减轻,严重时可能发生感染性休克导致死亡。目前,在临床上尚无针对放射性肠炎治疗的统一临床路径[1]。多项研究表明,中草药或提取物可能会降低受照动物由辐射诱导的脑、食管和血液系统的损伤[2-6]。
巴特日(Bateri)-7是由草乌叶、诃子、多叶棘豆、茜草、黑云香、银朱、麝香7味药材组成的水丸制剂,具有清瘟解毒,消“粘”,止痛,散瘀止痢的作用,是蒙医临床用于治疗肠炎的经典复方,具有蒙药抗菌药物之称[7]。虽然该药物临床应用较普遍,但未见用于治疗放射性肠炎的相关报道。本研究以放射性肠炎小鼠为模型,探讨蒙药巴特日-7对放射性肠炎的防治作用,为放疗导致的肠道损伤患者寻找新的防治药物提供实验依据。
材料与方法1. 实验动物:SPF级C57BL/6J雄性小鼠共65只,6~8周龄,体质量20~22 g,购于北京斯贝福公司,许可证号:SCXK(京)2019-0010。于军事医学研究院辐射医学研究所实验室内按组分笼喂养,环境温度18~22℃,实验期间小鼠自助摄食摄水。所有实验动物均经过适应性喂养7 d。
2. 试剂与仪器:蒙药巴特日-7由内蒙古民族大学附属医院蒙药制剂室生产。5-溴-2′-去甲酰尿苷(BrdU)购自北京中杉金桥公司,肿瘤坏死因子α(TNF-α)、白介素6(IL-6)、趋化因子5(Cxcl-5)购自北京宝日医公司,磷酸盐缓冲液(PBS)购自北京博士德公司;Tunel细胞凋亡试剂盒购自北京碧云天公司,Ki-67抗体购自美国Cell Signaling公司,倒置显微镜(XDS-1B)购自日本Olympus公司。
3. 实验分组及受照条件:采用随机数表法将65只SPF级C57BL/6J雄性小鼠分为对照组、照射组和照射给药组,每组15只;存活实验分为照射组和照射给药组,每组10只。给药7 d后,将全部小鼠分3批置于小鼠照射盒内(30 cm×20 cm,为照射源配套装置),60Co γ射线照射,源皮距3 m,吸收剂量12 Gy,吸收剂量率60.06 cGy/min,全身照射小鼠制备放射性肠道损伤动物模型,照射设备由军事医学研究院辐射医学研究所提供,为HFY-YC型60Co γ照射源。
4. 给药方法:照射前7 d和照射后3 d给予对照组、照射组生理盐水0.4 ml灌胃,照射给药组给予530 mg/kg巴特日-7,0.4 ml生理盐水溶解灌胃。每天根据小鼠体重换算给药量,每日1次,连续给药11 d。
5. HE染色和免疫组织化学检测:照射后6 h、24 h、3.5 d,采用颈椎脱臼法处死小鼠,剖腹取出小肠段,用4℃ PBS冲洗至无粪便残留,剪切约为0.5 cm小段数段,置于10%甲醛中固定24 h,常规梯度乙醇脱水、二甲苯透明、石蜡包埋、组织切片,常规HE染色;同时进行Tunel、BrdU、Ki67免疫组织化学检测。
6. 外周血FITC-dextran含量测定:12 Gy照射后3.5 d,照射组和照射给药组各取5只小鼠,提前8 h禁食禁水,FITC-dextran灌胃给药,给药4.5h后,心脏取血,离心后将血浆与PBS 1∶1混合待测,取FITC-dextran试剂倍比稀释,在平板读取器上进行检测(激发波长485 nm,发射波长535 nm),制作FITC-dextran浓度和吸光度( A )标准曲线(y=5.57x+86.82,R2=0.999 9),同条件下检测待测血样读取 A 值,代入公式计算样本FITC-dextran浓度。
7. 实时荧光定量PCR(qPCR)法检测炎性因子表达:将小肠组织进行匀浆处理,qPCR法测定小肠组织中炎性因子IL-6、TNF-α和Cxcl-5的表达水平。PCR反应条件为95℃ 10 min;95℃ 15 s,60℃ 1 min,72℃ 30 s,共40个循环。运行结束后使用Bio-rad软件分析各基因相对表达量。
8. 统计学处理:采用SPSS 26.0软件进行统计学分析,Graphpad prism 8软件进行作图,数据以x±s表示,组间均数比较采用独立样本t检验。小鼠存活采用Kaplan-Meier生存分析,生存数据的比较采用Log-rank法检验。P < 0.05为差异有统计学意义。
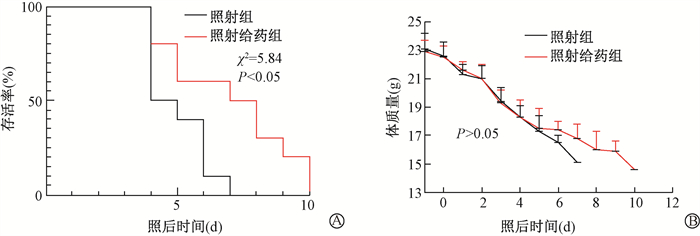
结果1. 巴特日-7对受照后小鼠存活时间的影响:照射组和照射给药组小鼠在照射后均能正常饮水、摄食,照射后第2天,两组小鼠一般状态出现变化,表现为不同程度的体重减轻,反应迟钝;照射后第3天,照射组小鼠开始出现肠道症状,表现为稀便,其精神状态较照射前萎靡,行动迟缓;照射后第4天,两组小鼠均出现死亡现象;照射后第7天,照射组小鼠全部死亡;照射后第10天,照射给药组小鼠全部死亡。照射给药组小鼠存活率与照射组相比,差异具有统计学意义(χ2 = 5.84,P < 0.05);照射后两组间小鼠体质量变化差异无统计学意义(P> 0.05),见图 1。
|
A.存活率;B.照射后体质量变化 图 1 巴特日-7对12 Gy γ射线照射后小鼠存活率和体质量的影响 A. Time response of mice survival; B. Body weight alterations after irradiation Figure 1 Effect of Bateri-7 on the survival and body weight of mice after 12 Gy irradiation |
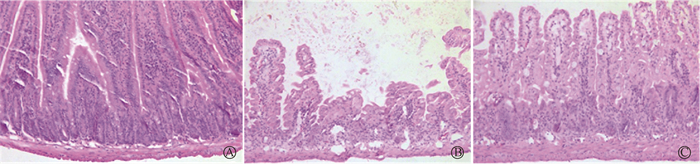
2. 小肠HE染色分析肠道绒毛高度和隐窝深度:如图 2所示,12 Gy照射后3.5 d,小肠组织HE染色显示,照射组小肠绒毛全部脱落或缺如,隐窝排列不齐;照射给药组小肠绒毛组织结构良好,排列整齐,形态完整,少量绒毛发生断裂。用ImageJ软件测量两组小肠绒毛长度和隐窝深度,照射给药组与照射组相比,小肠绒毛长度差异具有统计学意义(t = 20.24,P < 0.05),两组隐窝深度比较差异无统计学意义(P> 0.05,表 1);FITC-dextran渗透性实验显示,照射给药组FITC-dextran的外周血浓度显著低于照射组,差异有统计学意义[(2 025±679)mg/ml vs. (22 730±6 652)mg/ml,t= 6.92,P < 0.05],表明巴特日-7能很好地保护小肠绒毛结构和肠道屏障功能。
|
图 2 12 Gy照射后3.5 d各组小鼠的小肠绒毛结构 HE染色×20 A.对照组;B.照射组;C.照射给药组 Figure 2 Villus structure of small intestine at 3.5dafter 12 Gy irradiation in each group HE staining ×20 A. Control group; B. Irradiation group; C. Irradiation plus drug administration group |
|
|
表 1 12 Gy照射后3.5 d各组小鼠小肠绒毛高度和隐窝深度的变化(μm,x±s) Table 1 Villi height and crypt depth of small intestine 3.5 d after 12 Gy irradiation in each group(μm, x±s) |
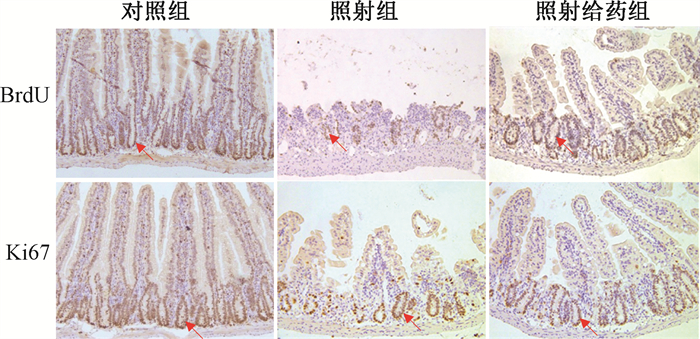
3. 巴特日-7对受照小鼠小肠隐窝细胞的增殖作用的影响:照射组BrdU和Ki67阳性细胞隐窝数量明显低于照射给药组(图 3),差异均具有统计学意义(t= 3.91、-2.57,P < 0.05,表 2),表明蒙药巴特日-7能够促进照射后小鼠小肠隐窝细胞再生。
|
注:红色箭头所指为BrdU、Ki67阳性隐窝 图 3 巴特日-7对12 Gy照射后小肠隐窝细胞增殖的影响免疫组织化学染色×20 Figure 3 Effect of Bateri-7 on the proliferation of small intestinal crypt cells after 12 Gy irradiation Immunohistochemical staining ×20 |
|
|
表 2 12 Gy照射后BrdU+、Ki67+小肠隐窝数量(x±s) Table 2 The number of BrdU+and Ki67+intestinal crypt after 12 Gy irradiation(x±s) |
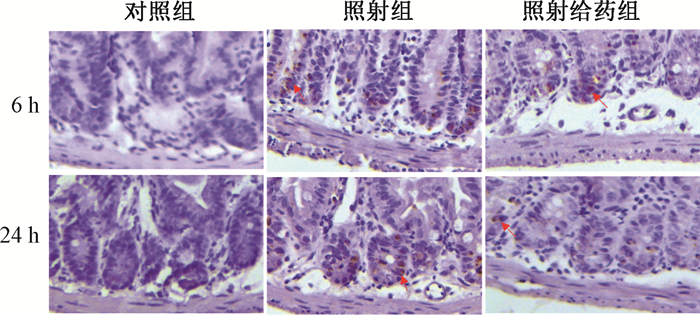
4. 巴特日-7对受照小鼠小肠隐窝细胞凋亡的影响:由于在照射早期小肠隐窝细胞即会发生凋亡,故选择照射后6和24 h观察隐窝细胞凋亡情况。结果显示,照后6和24 h,照射给药组与照射组相比小鼠小肠隐窝Tunel阳性细胞数量明显减少(图 4),差异有统计学意义(t= 3.52、2.90,P < 0.05),见表 3。表明巴特日-7具有明显抑制照射后小鼠隐窝细胞凋亡的作用。
|
注:红色箭头所指为Tunel阳性细胞 图 4 巴特日-7对12 Gy照射后不同时间点小肠隐窝细胞凋亡的影响免疫组织化学染色×20 Figure 4 Effect of Batri-7 on apoptosis of small intestinal crypt cells at different time points after 12 Gy irradiation Immunohistochemical staining ×20 |
|
|
表 3 12 Gy照射后不同时间点Tunel阳性细胞数量(x±s) Table 3 Number of Tunel positive cells at different time points after 12 Gy irradiation(x±s) |
5. 各组小鼠肠道组织IL-6、TNF-α、Cxcl-5表达水平的比较:在照射后3.5 d,照射给药组小鼠小肠组织炎性因子IL-6、TNF-α和Cxcl-5的表达水平均低于照射组,两组相比较均具有统计学意义(t= 7.01、7.18、13.16,P < 0.05)(表 4)。结果显示,巴特日-7能够抑制放射性肠损伤小鼠小肠炎性因子的表达。
|
|
表 4 12 Gy照射后各组小鼠小肠炎性因子的表达(x±s) Table 4 Expression of enteritis factors after 12 Gy irradiation in each group(x±s) |
讨论
蒙药作为蒙古族特有的一种药物,具有低毒、高效、疗效独特等显著优势[8]。巴特日-7是蒙医临床治疗肠炎的首选药物[9],具有抗病毒、抗菌、抗炎、镇痛、增强免疫等作用。在现代药理研究中,其成分草乌叶具有抗炎、镇痛之效;诃子对平滑肌有解痉效果,能抑菌、抗氧化;麝香则能在抗炎的同时对血管通透性进行抑制;茜草具有抗血小板聚集、解痉、抑制病菌之效[10]。经长期临床实践证明,巴特日-7对于某些真菌以及大肠杆菌、痢疾杆菌、伤寒杆菌等具有显著的抑制作用,临床抗炎疗效显著[11]。
本研究建立小鼠放射性肠损伤模型,探讨蒙药巴特日-7对小鼠放射性肠损伤的作用。结果显示,在照射后3.5 d,照射给药组小肠绒毛组织结构良好,排列整齐,形态完整;照射组小肠绒毛全部脱落或缺如,隐窝排列不齐。照射给药组小肠绒毛长度明显大于照射组。证明巴特日-7能有效保护受照小鼠小肠绒毛结构。小肠绒毛是肠道机械屏障的重要组成部分,既然巴特日-7对小肠绒毛结构有显著保护作用,由此推测巴特日-7也能保护放射性肠损伤肠道屏障功能。文献报道荧光标记物异硫氰酸荧光素-葡聚糖(FITC-dextran)渗透实验,是用于评价炎性肠病中肠道通透性的经典技术手段[12]。在肠黏膜严重受损时,经口服FITC-dextran分子可以从肠腔进入全身血液循环,测量小鼠外周血中FITC-dextran含量来反映肠黏膜的受损程度。结果显示,照射给药组小鼠外周血中FITC-dextran的含量显著低于照射组,该结果表明巴特日-7能有效保护受照小鼠小肠屏障功能。
在照后3.5 d,照射组小肠组织IL-6、TNF-α、Cxcl-5的表达水平显著升高,而经巴特日-7干预的小鼠小肠组织中IL-6、TNF-α、Cxcl-5的表达均处于较低水平,两组相比较差异具有统计学意义, 与李淑艳等[13]研究巴特日-7可有效降低炎性因子表达的结果一致, 表明巴特日-7能够显著降低辐射后炎性因子表达水平。肠干细胞在放射诱导损伤后黏膜再生中起着至关重要的作用,而放射诱导的细胞凋亡可能是引发胃肠道综合征的主要因素[14-15]。通过巴特日-7干预的小鼠照射后小肠隐窝Tunel阳性的数量明显减少,BrdU、ki67阳性隐窝数增多,说明巴特日-7能够促进照射后小鼠隐窝细胞增殖和抑制因照射引起的细胞凋亡。存活实验证明巴特日-7能够有效延长小鼠的存活时间,可能与该药能够促进小肠隐窝增殖,保护黏膜屏障,降低炎性因子表达和延缓细胞凋亡有关。本研究由于采用12 Gy全身照射小鼠的方式造模,可能会伴随造血功能抑制,影响其存活,该药物对造血功能的具体影响将在后续实验中进行探讨。由于该药物为复合制剂,短期内无法得到单一的有效成分进行机制研究,相关作用机制也将在后续实验中进行。
综上所述,蒙药巴特日-7能够有效改善放射引起的肠道损伤,对放射性肠炎具有较好的防治作用,为巴特日-7应用于放射性肠炎的治疗提供了实验依据。
利益冲突 无
作者贡献声明 刘国利负责实验操作、数据采集、统计分析;宋秀军、申星指导论文修改;王叶梅协助实验操作;金花、时磊参与论文修改;余祖胤、王欣茹负责指导课题设计
| [1] |
Cheng Y, Dong Y, Hou Q, et al. The protective effects of XH-105 against radiation-induced intestinal injury[J]. J Cell Mol Med, 2019, 23(3): 2238-2247. DOI:10.1111/jcmm.14159 |
| [2] |
Kindekov I, Mileva M, Krastev D, et al. Radioprotective effect of Rapana thomasiana hemocyanin in gamma induced acute radiation syndrome[J]. Biotechnol Biotechnol Equip, 2014, 28(3): 533-539. DOI:10.1080/13102818.2014.924683 |
| [3] |
Lu L, Wang YY, Zhang JL, et al. p38 MAPK inhibitor insufficiently attenuates HSC senescence administered long-term after 6 Gy total body irradiation in mice[J]. Int J Mol Sci, 2016, 17(6): 905. DOI:10.3390/ijms17060905 |
| [4] |
Li D, Tian Z, Tang W, et al. The protective effects of 5-methoxytryptamine-α-lipoic acid on ionizing radiation-induced hematopoietic injury[J]. Int J Mol Sci, 2016, 17(6): 935. DOI:10.3390/ijms17060935 |
| [5] |
Suryavanshi S, Sharma D, Checker R, et al. Amelioration of radiation-induced hematopoietic syndrome by an antioxidant chlorophyllin through increased stem cell activity and modulation of hematopoiesis[J]. Free Radic Biol Med, 2015, 85: 56-70. DOI:10.1016/j.freeradbiomed.2015.04.007 |
| [6] |
Li J, Xu J, Xu W, et al. Protective effects of Hong Shan capsule against lethal total-body irradiation-induced damage in Wistar rats[J]. Int J Mol Sci, 2015, 16(8): 18938-18955. DOI:10.3390/ijms160818938 |
| [7] |
李淑艳, 包晓华, 李淑红, 等. 蒙药巴特日七味丸不同提取部位体外抗菌活性筛选和急性毒性研究[J]. 中国现代应用药学, 2019, 36(23): 2888-2893. Li SY, Bao XH, Li SH, et al. Study on the in vitro antimicrobial activity screening for different extracts of Bateri Qiwei Pills and acute toxicity[J]. Chin J Mod Appl Pharm, 2019, 36(23): 2888-2893. DOI:10.13748/j.cnki.issn1007-7693.2019.23.002 |
| [8] |
金辉, 吴越, 王前宏, 等. 巴特日七味散对大鼠慢性胰腺炎NF-κB活性影响的研究[J]. 中国继续医学教育, 2017, 9(16): 211-212. Jin H, Wu Y, Wang QH, et al. Study on the effect of Bart Seven Are Scattered in rats with chronic pancreatitis research on NF-κB activity[J]. Chin Cont Med Edu, 2017, 9(16): 211-212. DOI:10.3969/j.issn.1674-9308.2017.16.114 |
| [9] |
李淑红, 包黎明, 李淑艳. 蒙药巴特日-7抗炎作用和急性毒性实验研究——以有效部位为研究对象[J]. 世界科学技术-中医药现代化, 2019, 21(7): 1393-1398. Li SH, Bao LM, Li SY. Experimental study on anti-inflammatory effects and acute toxicity of Mongolian medicine Bateri-7-taking effective parts as research objects[J]. World Sci Technol Mod Trad Chin Med, 2019, 21(7): 1393-1398. DOI:10.11842/wst.2019.07.016 |
| [10] |
杜娜日苏. 蒙药巴特日-7味丸联合奥曲肽治疗急性胰腺炎的临床效果及对白细胞介素2水平的影响[J]. 中国民族医药杂志, 2020, 26(11): 23-24. DOI: 10,16041/j.cnki.cn15-1175.2020,11,015. Du NR. Clinical effect of Mongolian medicine Batri-7 Wei Pill combined with octreotide in the treatment of acute pancreatitis and its effect on the level of interleukin-2[J]. J Med Pharm Chin Minorities, 2020, 26(11): 23-24. DOI: 10,16041/j.cnki.cn15-1175,2020,11,015. |
| [11] |
韩峰, 崔黎. 蒙药巴特日七味丸临床应用概述[J]. 中国民族医药杂志, 2020, 26(9): 45-46. Han F, Cui L. Summary of clinical application of Mongolian medicine Batri 7 Pill[J]. J Med Pharm Chin Minorities, 2020, 26(9): 45-46. DOI:10.16041/J.cnki.cn15-1175.2020.09.022 |
| [12] |
Fischer JC, Wintges A, Haas T, et al. Assessment of mucosal integrity by quantifying neutrophil granulocyte influx in murine models of acute intestinal injury[J]. Cell Immunol, 2017, 316: 70-76. DOI:10.1016/j.cellimm.2017.04.003 |
| [13] |
李淑艳, 乌云参丹, 刘燕, 等. 巴特日-7对肠炎大鼠及其血清TNF-α、IL-1β、IL-10水平的影响[J]. 中成药, 2020, 42(7): 1748-1753. Li SY, Wuyun SD, Liu Y, et al. Effects of Bateri-7 on the enteritis rats and their serum levels of TNF-α, IL-1β, and IL-10[J]. Chin Trad Patent Med, 2020, 42(7): 1748-1753. DOI:10.3969/j.issn.1001-1528.2020.07.013 |
| [14] |
Liu Z, Tian H, Jiang J, et al. β-Arrestin-2 modulates radiation-induced intestinal crypt progenitor/stem cell injury[J]. Cell Death Differ, 2016, 23(9): 1529-1541. DOI:10.1038/cdd.2016.38 |
| [15] |
Leibowitz BJ, Yang L, Wei L, et al. Targeting p53-dependent stem cell loss for intestinal chemoprotection[J]. Sci Transl Med, 2018, 10(427): eaam7610. DOI:10.1126/scitranslmed.aam7610 |
 2022, Vol. 42
2022, Vol. 42


