辐射诱导的肺纤维化(RIPF)是胸部放疗患者的常见并发症,发病率可达16%~28%。RIPF的特征是肺部结构的渐进、不可逆的破坏以及气体交换的障碍,临床症状包括呼吸困难、间质积累和肺功能退化,最终导致呼吸衰竭[1]。因此,早期预防RIPF的发生对降低RIPF的发生率,改善胸部放疗患者的预后尤为重要。针对RIPF干预措施中,目前仅通过抗氧化剂、抗炎药、抗纤维化剂等达到延缓疾病进展的目的,尚无临床批准药物可以应用于RIPF的预防[2-3]。所以寻找能够预防RIPF发生发展的措施或药物十分重要。
研究表明,辐射诱导的细胞衰老在RIPF的发病机制中发挥重要作用[4-5]。Ⅱ型肺泡上皮细胞(AECⅡ)衰老是放射性肺纤维化的诱发因素[6-7]。所以抑制肺内AECⅡ衰老可成为预防放射性肺纤维化的一种可能的途径。
间充质干细胞在放射性肺纤维化的治疗中具有独特优势[8],本研究选用比传统间充质干细胞更有广泛应用前景的牙龈间充质干细胞(GMSCs),在具有干细胞应用功能的基础上,其来源易得并在组织修复中形成较少瘢痕,同时其外泌体被报道能够抑制细胞衰老[9-11]。据此,本研究通过构建体外AECⅡ衰老模型及RIPF小鼠模型,探究GMSCs对辐射诱导的肺泡上皮细胞衰老和放射性纤维化发生发展的预防能力,并初步探讨其作用机制。
材料与方法1. 主要试剂及仪器:小鼠Ⅱ型肺泡上皮细胞MLE12购于美国模式培养物集存库(ATCC),牙龈间充质干细胞GMSCs及GMSCs完全培养基由北京泰盛生物科技有限公司赠送。β-半乳糖苷酶(β-Gal)染色试剂盒(江苏碧云天公司),EdU试剂盒(广州锐博公司),Masson三色染色液,(北京索莱宝公司),反转录试剂盒(北京宝日医公司),qPCR MasterMix试剂盒(镇江爱必梦公司);兔抗鼠pro SPC多克隆抗体(AB3786,美国Merck Millipore公司),鼠抗鼠p16 INK4A单克隆抗体、鼠抗鼠p21 Waf1/Cip1单克隆抗体(sc-1661、sc-6246,美国Santa Cruz公司),鼠抗鼠p53单克隆抗体、鼠抗人Phospho-p53单克隆抗体(2524、9286,美国CST公司),鼠抗鼠GLB1单克隆抗体(66586-1-Ig,武汉三鹰公司);γ射线(GC40E W/2C-440,加拿大Best Theratronics公司),X射线(RS-2000,德国RAD SOURCE公司)。
2. 细胞培养、辐射诱导衰老及干预处理:MLE12在完全培养基(2%胎牛血清,DME/F12培养基,胰岛素,转铁蛋白,硒氢化可的松,β-雌二醇,Hepes,L-谷氨酰胺);牙龈间充质干细胞培养于GMSCs完全培养基,两种细胞均于5% CO2、37℃恒温恒湿细胞培养箱中进行培养。MLE12通过γ射线以6 Gy剂量照射,照后立即加入Transwell小室(GMSCs 3×105个细胞)共培养96 h,实验分组:Ctrl(空白对照组)、Ctrl+Trans(非照射加入GMSCs共培养组)、IR(单纯照射组)、IR+Trans(照射后加入GMSCs共培养组)。
3. 纤维化小鼠模型制备及细胞移植:雄性6~8周龄C57BL/6小鼠(北京华阜康生物科技有限公司),饲养于恒温恒湿洁净环境隔离动物室内,许可证号:SCXK(京)2019-0008。60只小鼠均分为4组:Ctrl(健康对照组)、GMSCs(单纯注射GMSCs组)、IR(单纯照射组)、IR+GMSCs(照射+GMSCs组)。需照射小鼠麻醉后,照射野划定为右侧胸部2 cm×2 cm,源皮距10 cm,X射线剂量率2.7 Gy/min,总剂量17 Gy。照后1 d采用尾静脉注射,GMSCs组每鼠注射GMSCs 3×106个细胞,健康对照组注射PBS溶液。
4. 细胞形态学记录:移去细胞培养基,PBS清洗2次,置于200倍光学显微镜下记录细胞形态。
5. β-Gal染色:在6孔板内放入玻片,进行细胞铺板。PBS冲洗3次,使用试剂盒内固定液室温固定10 min,PBS缓慢冲洗3次,配制染色工作液,置于37℃、无CO2孵箱内染色。染色结束后,PBS清洗,通过光学显微镜取多视野进行记录。
6. 细胞增殖成像分析试剂盒(EdU法)染色:细胞铺于玻片,检测时使用完全培养基按1 000 ∶1稀释EdU溶液,细胞由稀释溶液室温孵育2 h,孵育结束使用PBS浸洗2次。4%多聚甲醛(PBS配制)室温固定30 min,固定后使用2 mg/ml甘氨酸置于摇床孵育5 min,再使用0.5% Triton X-100(PBS配制)摇床孵育10 min,结束后PBS冲洗3次。试剂盒内Apollo染色液室温避光染色30 min,使用0.5% Triton X-100脱色摇床清洗2次,每次10 min,最后使用DAPI封片,图像由倒置荧光显微镜(EVOS FL,美国Thermo Scientific公司)记录。
7. 组织样本、脏器比及病理图片统计:照射后每周记录小鼠生存状态,统计生存率。照后180d取样,分离肺组织后拍照记录肺大体形态。左右肺分别称重计算,脏器比=单侧肺部质量/体质量×100%。右肺第二叶用4%甲醛固定,其余右肺组织储于液氮。
8. 组织病理学检查:肺组织固定后,经过脱水、包埋制备病理切片。切片置于60℃烘箱12 h,常规脱蜡。切片经过HE试剂盒或Masson试剂盒染色后,脱水并用中性树脂封片,光学显微镜下记录组织结构。
9. 免疫组织化学法:切片脱蜡,高压加热进行抗原修复,恢复室温后PBS缓冲液浸洗,滴加过氧化物酶阻断剂室温放置15 min,PBS缓冲液浸洗3次5 min,5%BSA室温封闭2 h,封闭后弃去封闭液,吸净液体,用5%BSA配置一抗β-Gal(1 ∶200),4℃孵育12 h。一抗孵育结束后,PBS浸洗3次5 min。酶标山羊抗鼠/兔IgG聚合物室温孵育30 min,PBS浸洗3次5 min,二甲基联苯胺(DAB)染色15 s快速用清水浸洗。苏木染液染色40~50 s后清水浸洗,切片进行脱水并使用中性树脂封片,光学显微镜下记录组织结构。
10. 组织免疫荧光:切片脱蜡后高压抗原修复,恢复室温PBS缓冲液浸洗3次,过氧化物酶阻断剂室温15 min,PBS缓冲液浸洗3次,5%BSA(PBS缓冲液配制)4℃封闭6 h,弃去封闭液,滴加5%BSA配置的一抗P16(1∶100)、P21(1∶100)、β-Gal(1∶150)4℃孵育12 h,切片室温静置30 min,PBS缓冲液浸洗3次,5%BSA配置二抗Cy3-M(1∶500),FITC-R(1∶500)室温孵育1~2 h,PBS浸洗3次,DAPI封片,图像由倒置荧光显微镜记录(EVOS FL,美国Thermo公司)。
11. qRT-PCR:1 ml TRIzol研磨组织/细胞提取RNA,反转录试剂盒25℃ 5 min,42℃ 30 min,85℃ 5 s制备cDNA。使用qPCR MasterMix试剂盒及所列引物进行PCR,根据公式2-ΔΔCt计算结果。引物序列分别为Gapdh正向引物5′AAGGTCATCCCAGAGCTGAA 3′,Gapdh反向引物5′CTGCTTCACCACCTTCTTGA 3′;IL-6正向引物5′TACCACTTCACAAGTCGGAGGC 3′,IL-6反向引物5′CTGCAAGTGCATCATCGTTGTTC 3′;IL-8正向引物5′GGTGATATTCGAGACCATTTACT G 3′,IL-8反向引物5′GCCAACAGTAGCCTTCACCCA 3′;IL-1β正向引物5′TGGACCTTCCAGGATGAGGACA 3′,IL-1β反向引物5′GTTCATCTCGGAGCCTGTAGTG 3′。
12. Western blot:RIPA裂解液研磨肺组织,离心取上清,加入上清体积3倍的4×蛋白上样缓冲液,细胞离心取沉淀加入适量2×蛋白上样缓冲液,100℃变性10 min。蛋白通过12% SDS-PAGE凝胶电泳分离,湿转法260 mA转膜120 min,1%BSA(TBST配制)室温封闭2 h,TBST洗膜3次10 min,一抗P16(1 ∶500)、P21(1 ∶500)、P53(1 ∶1 000)、p-P53(1 ∶1 000)4℃孵育12 h。TBST洗膜3次10 min,1%BSA配制二抗山羊抗鼠IgG(1 ∶4 000)孵育,最后TBST洗膜3次共10 min。使用多功能凝胶成像仪(美国Bio-Rad)进行成像。
13. 统计学处理:实验均进行3次重复验证,细胞图片每样本随机采集5个视野进行统计,图使用GraphPad Prism 5.0软件进行绘制。SPSS 19.0软件进行统计学分析,数据符合正态分布,用x±s表示,进行组间样本t检验,P < 0.05为差异有统计学意义。
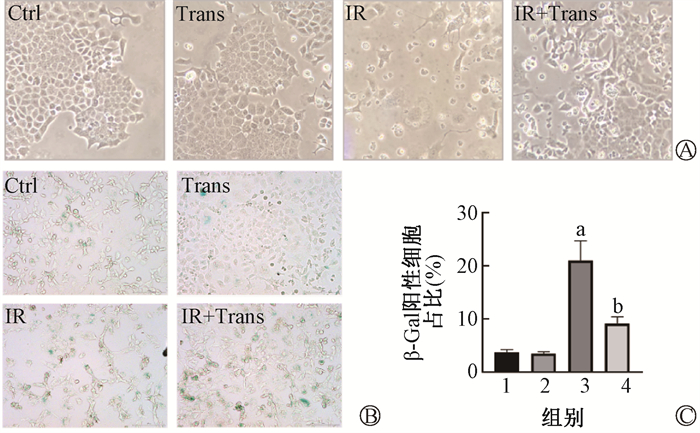
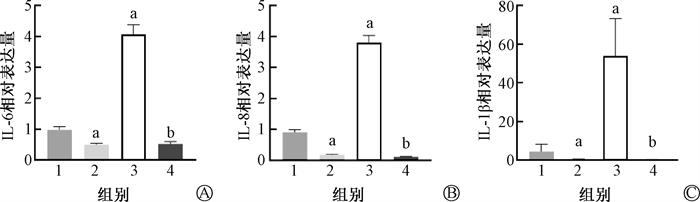
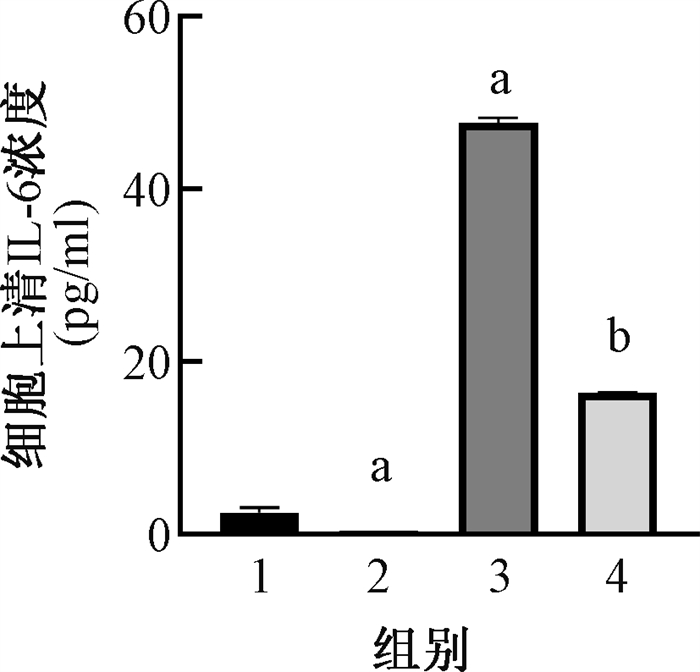
结果1. GMSCs预防辐射诱导的Ⅱ型肺泡上皮细胞衰老:细胞形态示于图 1。由图 1可见,MLE12细胞在6 Gy照射后96 h失去正常Ⅱ型肺泡上皮细胞形态,表现为扁平肥大、边缘不规则的衰老细胞形态。在照射后立即加入GMSCs共培养后,细胞形态表现正常。β-Gal染色示于图 1。由图 1可见,IR组蓝绿色阳染细胞增多(t=10.26,P < 0.05),而在加入GMSCs共培养后阳染细胞减少11.8%(t=6.72,P < 0.05)。SASP基因相对表达水平示于图 2。由图 2可见,照射后IL-6、IL-8、IL-1β的表达均有升高(t=16.69、20.62、4.37,P < 0.05),而在加入GMSCs共培养后表达水平较IR组显著下调(t=28.43、28.43、4.82,P < 0.05)。IL-6分泌水平示于图 3。由图 3可见,IL-6分泌水平同基因表达趋势一致,在照射后分泌增多(t=6.80,P < 0.05),且在与GMSCs共培养后分泌减少(t=95.52、86.54,P < 0.05)。增殖能力下降是细胞进入衰老状态的特征之一,EdU染色检测细胞增殖能力示于图 4。由图 4可见,MLE12在照射后增殖能力降低(t=6.42,P < 0.05),而在GMSCs共培养后增殖能力有所恢复,较正常组差异无统计学意义(t=3.69,P < 0.05)。
|
注:1. Ctrl组;2. Trans组;3. IR组;4. IR+Trans组;a与Ctrl组比较,t=10.26,P < 0.05;b与IR组比较,t=6.72,P < 0.05 图 1 不同组别MLE12细胞形态及β-Gal染色结果 A. MLE12细胞形态×400;B. 细胞衰老相关β-Gal染色,蓝绿色为阳性染色细胞×200;C. β-Gal染色阳性比例统计 Figure 1 Morphology and β-Gal staining of MLE12 cells in different groups. A. MLE12 cell morphology ×400;B. Senescence-associated β-Gal staining cells of MLE12 with blue-green markers ×200; C. The percentage of β-Gal positive cells |
|
注:1. Ctrl组;2. Trans组;3. IR组;4. IR+Trans组;a与Ctrl组比较,t=7.65、16.69、12.73、20.62、1.79、4.37,P < 0.05;b与IR组比较,t=19.44、28.43、4.82,P < 0.05 图 2 不同组别MLE12细胞SASP表达水平 A. IL-6基因表达水平;B. IL-8基因表达水平;C. IL-1β基因表达水平 Figure 2 Expression of SASP in MLE12 cells in different groups A. IL-6 gene expression level; B. IL-8 gene expression level; C. IL-1β gene expression level |
|
注:1. Ctrl组;2. Trans组;3. IR组;4. IR+Trans组;a与Ctrl组比较,t=6.80、95.52,P < 0.05;b与IR组比较,t=86.54,P < 0.05 图 3 不同组内MLE12细胞上清中IL-6分泌水平 Figure 3 IL-6 level in the supernatant of MLE12 cells in different groups |

|
注:1. Ctrl组;2. Trans组;3. IR组;4. IR+Trans组;a与Ctrl组比较,t=6.42,P < 0.05;b与IR组比较,t=3.69,P < 0.05 图 4 GMSCs维持辐射后Ⅱ型肺泡上皮细胞增殖能力×200 A. 不同组内MLE12的EdU染色图片,绿色荧光标记为具有增殖能力阳性细胞;B. EdU阳性细胞比率统计 Figure 4 GMSCs maintained the proliferation of type Ⅱ alveolar epithelial cells after radiation A. EdU staining images of MLE12 cells in different groups. Green fluorescence markers are positive cells with proliferative ability ×200; B. The percentage of EdU positive cells in different groups |
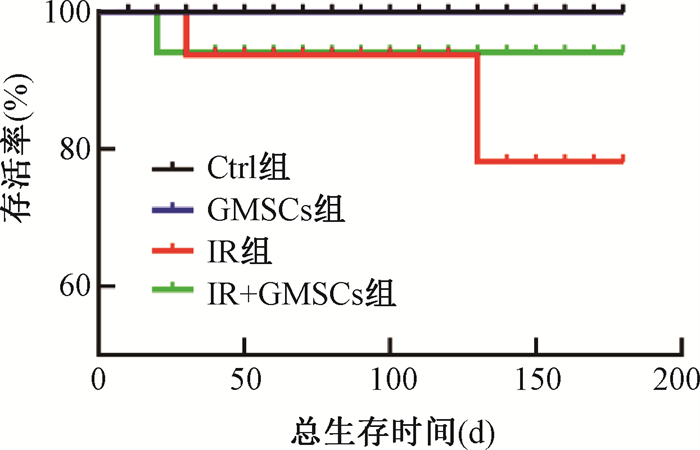
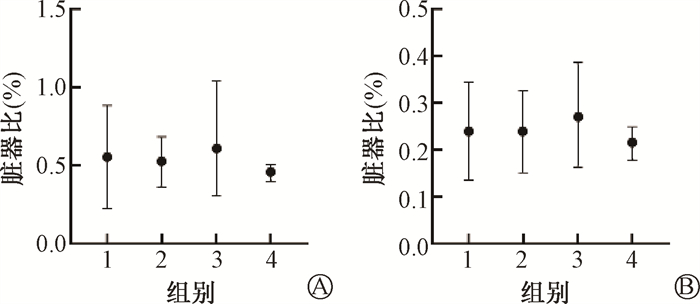
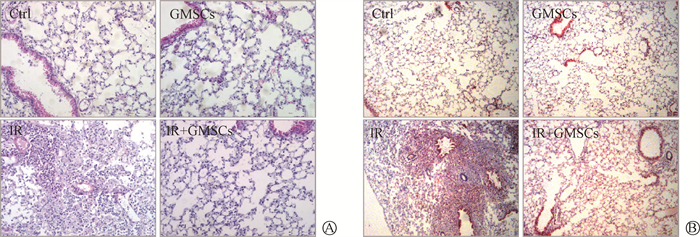
2. GMSCs预防辐射诱导的肺纤维化:C57BL/6小鼠行单侧右肺照射,照射后1 d通过尾静脉注射GMSCs,照后180 d取材,生存统计结果示于图 5。由图 5可见,照射后小鼠生存率呈持续下降的趋势,而GMSCs移植能提高小鼠生存率。肺部大体标本显示照射后右肺呈猪肝色,GMSCs注射后肺组织呈现正常粉白色。脏器比统计结果显示,IR组右肺脏器比高于Ctrl组,GMSCs预防性注射后脏器比较Ctrl组无差异,受旁效应影响,左侧肺部脏器比也呈相同趋势。组织病理切片结果示于图 7。由图 7可见,右肺组织HE染色结果显示,IR组小鼠的肺泡壁增厚,肺泡塌陷,而在GMSCs注射后未见明显病理性变化。Masson染色结果也显示,经过GMSCs注射组未见明显胶原沉积。以上结果表明,GMSCs移植能够预防辐射诱导的肺纤维化,且对正常小鼠肺组织无明显影响。
|
图 5 实验期间(180 d)小鼠生存率统计 Figure 5 Survival rate of mice in different groups within 180d after irradiation |
|
图 6 肺部脏器比 A. 右肺;B. 左肺 Figure 6 The organ index A. Right lung; B. Left lung |
|
Prevention of radiation-induced alveolar structural collapse and collagen deposition by GMSCs ×200 A. HE staining of lung tissue;B. Masson staining of lung tissue, the blue area as collagen staining 图 7 GMSCs预防辐射诱导的肺泡结构塌陷及胶原沉积×200 A. 肺部病理切片HE染色;B. 肺部病理切片Masson染色,蓝色区域为胶原蛋白阳性染色部位 |
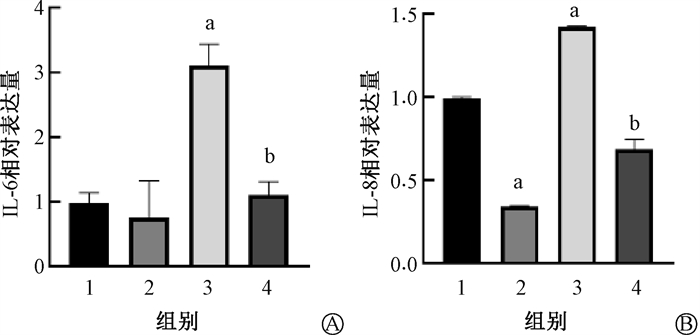
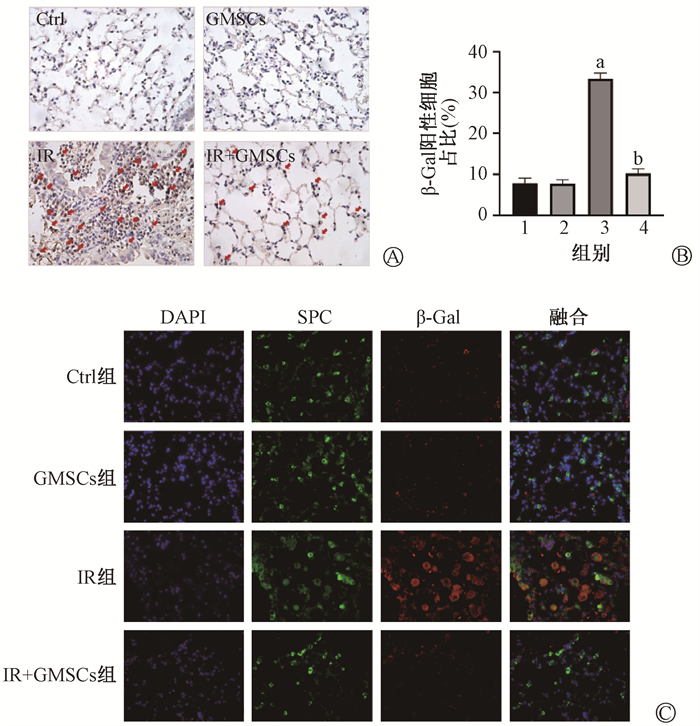
3. GMSCs预防纤维化肺内细胞衰老:小鼠右肺SASP基因表达水平结果示于图 8。由图 8可见,IR组肺内SASP因子(IL-6、IL-8)表达均有所升高(t=10.08、81.64,P < 0.05),而GMSCs注射预防组内IL-6、IL-8水平明显较低(t=8.86、20.63,P < 0.05)。β-Gal免疫组织化学法化及β-Gal与Ⅱ型肺泡上皮细胞(AECⅡ)标志物SPC共定位的免疫荧光示于图 9。由图 9可见,IR组内衰老细胞明显增多,尤其是衰老AECⅡ增多(t=21.17,P < 0.05),而在GMSCs注射预防组中衰老细胞减少23.9%(t=21.83,P < 0.05),尤其是衰老AECⅡ的比例较IR组明显减少。以上结果表明,GMSCs移植能够预防照射后小鼠肺内细胞尤其是AECⅡ的衰老。
|
注:1. Ctrl组;2.GMSCs组;3. IR组;4. IR+GMSCs组;a与Ctrl组比较,t=10.08、130.40、81.64,P < 0.05;b与IR组比较,t=8.86、11.66,P < 0.05 图 8 GMSCs抑制辐照后小鼠肺内SASP表达 A. 肺组织内IL-6基因表达水平;B. 肺组织内IL-8基因表达水平 Figure 8 GMSCs inhibited SASP expression in the lung of irradiated mice A. IL-6 gene expression level in lung tissue; B. IL-8 gene expression level in lung tissue |
|
注:1. Ctrl组;2.GMSCs组;3. IR组;4. IR+GMSCs组;a与Ctrl组比较,t=21.17,P < 0.05;b与IR组比较,t=21.83,P < 0.05 图 9 GMSCs有效减少辐照后小鼠肺内衰老细胞 A. β-Gal免疫组织化学染色,红色箭头标记出部分阳性染色细胞×200;B. β-Gal标记阳性细胞比率统计;C. 肺组织衰老相关β-Gal与SPC免疫荧光共定位×400 Figure 9 GMSCs effectively reduced lung senescence cells in the irradiated mice A. β-Gal immunohistochemistry staining. Red arrows indicate positively stained cells ×200;B. The percentage of β-Gal positive cells; C. Immunofluorescence co-localizing of β-Gal and SPC ×400 |
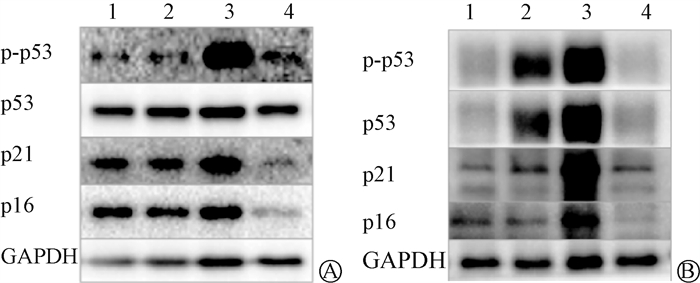
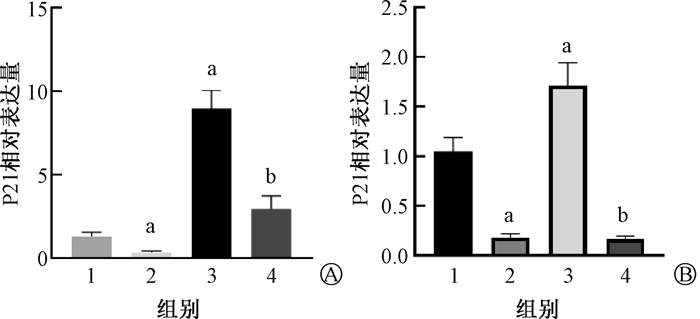
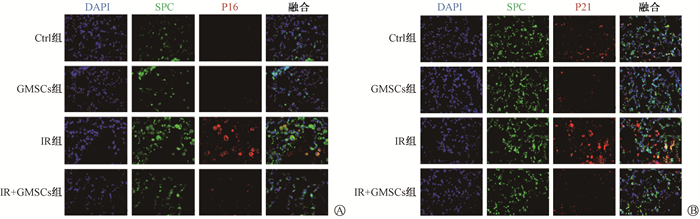
4. GMSCs抑制衰老相关P53-P21及P16信号通路:本研究分别从体内外水平观察了GMSCs移植后P53-P21及P16通路的变化。由图 10可见,在细胞水平,IR诱导的衰老MLE12细胞中,P53、p-P53、P21、P16表达水平均显著升高,而在与GMSCs预防性共培养干预后,其蛋白表达水平显著下调;同样的在动物水平,受照小鼠在GMSCs注射后,肺组织内P53、p-P53、P21及P16蛋白表达水平较RIPF小鼠明显下调。P21转录水平检测结果示于图 11。由图 11可见,在与GMSCs共培养干预后IR+Trans组内P21的转录水平也较IR组显著降低(t=11.66,P < 0.05);动物肺组织中P21的转录水平也呈现出GMSCs干预后降低受照小鼠P21转录水平的相同趋势(t=11.66,P < 0.05)。在对体内衰老相关β-Gal与SPC免疫荧光共定位进一步检测,结果示于图 11。由图 11可见,IR组小鼠肺内AECⅡ中P21及P16表达水平较对照组明显升高,而GMSCs预防组P21、P16的阳性细胞数明显减少。IR组肺内细胞体积明显肥大,经GMSCs移植后肺内细胞体积与正常小鼠肺细胞相近。因此,GMSCs可在体内外抑制RIPF小鼠AECⅡ中P53-P21和P16的信号通路,预防肺组织细胞的衰老。
|
注:图A中,1. Ctrl组;2. Trans组;3. IR组;4. IR+Trans组;图B中,1. Ctrl组;2.GMSCs组;3. IR组;4. IR+GMSCs组 图 10 GMSCs下调衰老通路蛋白 A. MLE12细胞内P53-21、P16蛋白表达;B. 小鼠肺组织中P53-21、P16蛋白表达 Figure 10 GMSCs down-regulated senescence pathway proteins A. P53-21 and P16 protein expressions in MLE12 cells; B. P53-21 and P16 protein expressions in mouse lung tissues |
|
注:图A中,1. Ctrl组;2.Trans组;3. IR组;4. IR+Trans组;图B中,1. Ctrl组;2.GMSCs组;3. IR组;4. IR+GMSCs组;a与Ctrl组比较,t=6.43、11.75、10.18、4.29,P < 0.05;b与IR组比较,t=7.67、11.66,P < 0.05 图 11 GMSCs下调衰老通路相关基因表达 A. MLE12细胞内P21转录水平;B. 小鼠肺组织中P21转录水平 Figure 11 GMSCs down-regulate aging pathway-related gene expression A. P21 transcript levels in MLE12 cells; B. P21 transcript levels in mouse lung tissue |
讨论
辐射诱导的肺纤维化(RIPF)作为放疗的严重并发症,降低了患者的生存质量,也严重限制了放疗的施用剂量[1-2]。在大多数情况下放射性肺纤维化由放射性肺炎发展形成,尽管立体定向放射治疗技术的广泛应用以限制正常肺组织暴露于辐射,但仍有多达35%接受胸放射治疗的肺癌和乳腺癌患者会患放射性肺炎,并在初始放疗和放疗后有极高患RIPF的风险[12]。肺纤维化是辐射诱导的肺炎的终点阶段,目前临床上主要通过皮质类固醇、硫唑嘌呤和环孢素A治疗放射性肺炎[13-14]。在纤维化发展阶段的干预中,有报道称姜黄素因其抗炎和抗纤维化作用,使其能够减轻辐射引起的炎症和纤维化[15]。但目前尚未提出有效的预防RIPF的措施,以阻止纤维化的发生与进展[16],所以寻找切实可行的预防RIPF的方法迫在眉睫。
间充质干细胞在肺部疾病(包括哮喘、慢性阻塞性肺病、特发性肺纤维化、肺动脉高压和矽肺)和危重疾病的细胞治疗法中快速发展并引起持续关注[17]。早期的临床试验表明,MSCs给药是安全的,几乎没有严重不良反应[18]。在本研究中也证实,注射GMSCs细胞的小鼠,未见肺内结构异常及其他不良反应。
在肺纤维化的治疗中,脐带、脂肪间充质干细胞移植可治疗辐射后肺炎及纤维化[19-20]。相较于传统间充质干细胞,牙龈间充质干细胞(GMSCs)更易于获取,具有良好的免疫调节和抗炎功能,并在组织修复中形成较少瘢痕[9-11]。鉴于肺纤维化的肺间质间隙的渐进性瘢痕的临床特征,GMSCs移植对放射性肺纤维化的预防作用成为本研究关注的焦点。结果也证实,GMSCs预防性移植后,受照小鼠肺间质的胶原沉积较少,肺泡结构清晰,未见肺泡明显塌陷,生存率也显著提高。
辐射是衰老的有效诱导剂,辐射后衰老细胞持续增加,当其超过免疫清除能力或衰老细胞无法有效清除时,会导致衰老细胞的积累[4]。照射后纤维化小鼠肺内衰老的AECⅡ增加[6-7]。衰老的AECⅡ自我更新及分化能力受损,不能维持肺泡内的稳态和组织损伤后的上皮修复,衰老的AECⅡ引发的氧化应激和炎症,导致组织异常修复和衰老的持续恶化[4, 21]。同时衰老细胞分泌的衰老分泌相关表型因子(SASP)会引起慢性氧化应激和炎症、刺激细胞增殖和血管生成、诱导上皮-间质转化促进纤维化的进展[22-23]。本研究结果也显示,6 Gy γ射线照射MLE12细胞96 h后,细胞呈现出明显的衰老表型;而且RIPF小鼠的AECⅡ也表现为扁平肥大、边缘不规则的衰老细胞形态。因此,抑制AECⅡ衰老可能是预防RIPF的有效靶点。
|
图 12 GMSCs抑制辐射后小鼠肺组织P16(A)和肺组织P21(B)与SPC的免疫荧光共定位×400 Figure 12 P16 (A) and P21(B) co-localized with SPC immunofluorescence in lung tissue after GMSCs inhibited radiation ×400 |
已有研究证实,脐带、脂肪间充质干细胞(MSCs)可通过分化为肺泡上皮细胞和内皮细胞,产生炎症抑制因子,增加抗炎因子,减少炎症细胞浸润治疗放射性肺纤维化[24-27]。但MSC预防辐射诱导的细胞衰老中的作用仍然有待探索。本研究利用辐射诱导的MLE12衰老细胞模型,通过与GMSCs共培养,在体外证实了GMSCs对于辐射诱导的AECⅡ衰老的预防作用,表现为细胞形态正常化、β-Gal活性下降、SASP因子降低;同时,在对RIPF小鼠预防性移植GMSCs后,肺内AECⅡ衰老细胞显著减少,肺组织中β-Gal阳性细胞明显较少,SASP因子也维持较低水平,表明GMSCs能够有效预防辐射后AECⅡ的衰老。
辐射主要通过p16和p53-p21这两条经典通路诱导细胞衰老,即照射后的DNA损伤反应激活P53、P21、P16,抑制周期蛋白依赖性激酶(CDK)使细胞退出分裂周期,导致衰老[28-29]。本研究中,照射后衰老的MLE12中P53-P21、P16相关通路蛋白也显著升高,而GMSCs共培养能显著下调p-P53、P21和P16蛋白的表达;GMSCs的体内移植也降低了RIPF肺组织内p16和p53-p21通路蛋白的表达,且在AECⅡ中尤为明显。但GMSCs是否通过p16和p53-p21通路抑制AECⅡ的衰老,还需进一步实验证实。
综上,本研究结果表明,GMSCs可通过下调衰老相关P53-P21及P16通路,减轻AECⅡ衰老,预防放射性肺纤维化的发生发展,为临床放射性肺纤维化的预防提供参考。
利益冲突 本研究由署名作者按以下贡献声明独立开展,排名无争议,本研究课题不涉及任何利益冲突
作者贡献声明 赵雯月负责实验操作,数据统计整理,起草论文;李娜、王彦指导部分实验;李科君、何宁宁协助实验数据统计;杜利清确定研究思路,指导论文撰写;刘强指导论文修改
| [1] |
Fu X, Li T, Yao Q. The effect of ophiopogoninCin ameliorating radiation-induced pulmonary fibrosis in C57BL/6 mice: An update study[J]. Front Oncol, 2022, 12: 811183. DOI:10.3389/fonc.2022.811183 |
| [2] |
Singh VK, Seed TM. Repurposing pharmaceuticals previously approved by regulatory agencies to medically counter injuries arising either early or late following radiation exposure[J]. Front Pharmacol, 2021, 12: 624844. DOI:10.3389/fphar.2021.624844 |
| [3] |
Singh VK, Seed TM. An update on romiplostim for treatment of acute radiation syndrome[J]. Drugs Today (Barc), 2022, 58(3): 133-145. DOI:10.1358/dot.2022.58.3.3367994 |
| [4] |
He Y, Thummuri D, Zheng G, et al. Cellular senescence and radiation-induced pulmonary fibrosis[J]. Transl Res, 2019, 209: 14-21. DOI:10.1016/j.trsl.2019.03.006 |
| [5] |
Zhang L, Pitcher LE, Yousefzadeh MJ, et al. Cellular senescence: a key therapeutic target in aging and diseases[J]. J Clin Invest, 2022, 132(15): e158450. DOI:10.1172/JCI158450 |
| [6] |
Citrin DE, Shankavaram U, Horton JA, et al. Role of type Ⅱ pneumocyte senescence in radiation-induced lung fibrosis[J]. J Natl Cancer Inst, 2013, 105(19): 1474-1484. DOI:10.1093/jnci/djt212 |
| [7] |
肖子婷, 田健, 朱琰琰, 等. 肺Ⅱ型上皮干细胞分化在放射性肺纤维化中作用[J]. 中华放射肿瘤学杂志, 2020, 29(12): 1102-1109. Xiao ZT, Tian J, Zhu YY, et al. The role of lung type Ⅱ epithelial stem cell differentiation in radiation-induced pulmonary fibrosis[J]. Chin J Radiat Oncol, 2020, 29(12): 1102-1109. DOI:10.3760/cma.j.cn113030-20190811-00323 |
| [8] |
赵雯月, 杜利清, 刘强. 间充质干细胞治疗放射性肺纤维化的研究进展[J]. 中华放射医学与防护杂志, 2021, 41(4): 309-314. Zhao WY, Du LQ, Liu Q. Progress in the treatment of radiation-induced pulmonary fibrosis with mesenchymal stem cells[J]. Chin J Radiat Med Prot, 2021, 41(4): 309-314. DOI:10.3760/cma.j.issn.0254-5098.2021.04.013 |
| [9] |
Kim D, Lee AE, Xu Q, et al. Gingiva-derived mesenchymal stem cells: Potential application in tissue engineering and regenerative medicine - A comprehensive review[J]. Front Immunol, 2021, 12: 667221. DOI:10.3389/fimmu.2021.667221 |
| [10] |
Wang X, Zhao S, Lai J, et al. Anti-inflammatory, antioxidant, and antifibrotic effects of Gingival-derived MSCs on bleomycin-induced pulmonary fibrosis in mice[J]. Int J Mol Sci, 2021, 23(1): 99. DOI:10.3390/ijms23010099 |
| [11] |
Shi HZ, Zeng JC, Shi SH, et al. Extracellular vesicles of GMSCs alleviate aging-related cell senescence[J]. J Dent Res, 2021, 100(3): 283-292. DOI:10.1177/0022034520962463 |
| [12] |
Bronova I, Smith B, Aydogan B, et al. Protection from radiation-induced pulmonary fibrosis by peripheral targeting of cannabinoid receptor-1[J]. Am J Respir Cell Mol Biol, 2015, 53(4): 555-562. DOI:10.1165/rcmb.2014-0331OC |
| [13] |
Jarzebska N, Karetnikova ES, Markov AG, et al. Scarred lung. An update on radiation-induced pulmonary fibrosis[J]. Front Med (Lausanne), 2020, 7: 585756. DOI:10.3389/fmed.2020.585756 |
| [14] |
Harrell CR, Sadikot TR, Pascual J, et al. Mesenchymal stem cell-based therapy of inflammatory lung diseases: Current understanding and future perspectives[J]. Stem Cells Int, 2019, 2019: 4236973. DOI:10.1155/2019/4236973 |
| [15] |
Johnson S, Shaikh SB, Muneesa F, et al. Radiation induced apoptosis and pulmonary fibrosis: curcumin an effective intervention?[J]. Int J Radiat Biol, 2020, 96(6): 709-717. DOI:10.1080/09553002.2020.1739773 |
| [16] |
Vallard A, Rancoule C, Le Floch H, et al. Medical prevention and treatment of radiation-induced pulmonary complications[J]. Cancer Radiother, 2017, 21(5): 411-423. DOI:10.1016/j.canrad.2017.03.004 |
| [17] |
Cruz FF, Rocco PRM. The potential of mesenchymal stem cell therapy for chronic lung disease[J]. Expert Rev Respir Med, 2020, 14(1): 31-39. DOI:10.1080/17476348.2020.1679628 |
| [18] |
Wang Y, Yi H, Song Y. The safety of MSC therapy over the past 15 years: a meta-analysis[J]. Stem Cell Res Ther, 2021, 12(1): 545. DOI:10.1186/s13287-021-02609-x |
| [19] |
Zanoni M, Cortesi M, Zamagni A, et al. The role of mesenchymal stem cells in radiation-induced lung fibrosis[J]. Int J Mol Sci, 2019, 20(16): 3876. DOI:10.3390/ijms20163876 |
| [20] |
Nicolay NH, Lopez Perez R, Debus J, et al. Mesenchymal stem cells - A new hope for radiotherapy-induced tissue damage?[J]. Cancer Lett, 2015, 366(2): 133-140. DOI:10.1016/j.canlet.2015.06.012 |
| [21] |
Hecker L, Logsdon NJ, Kurundkar D, et al. Reversal of persistent fibrosis in aging by targeting Nox4-Nrf2 redox imbalance[J]. Sci Transl Med, 2014, 6(231): 231r. DOI:10.1126/scitranslmed.3008182 |
| [22] |
Hernández L, Terradas M, Camps J, et al. Aging and radiation: bad companions[J]. Aging Cell, 2015, 14(2): 153-161. DOI:10.1111/acel.12306 |
| [23] |
Su L, Dong Y, Wang Y, et al. Potential role of senescent macrophages in radiation-induced pulmonary fibrosis[J]. Cell Death Dis, 2021, 12(6): 527. DOI:10.1038/s41419-021-03811-8.[HJ52x |
| [24] |
Liu D, Komg F, Yuan Y, et al. Decorin-modified umbilical cord mesenchymal stem cells (MSCs) attenuate radiation-induced lung injuries via regulating inflammation, fibrotic factors, and immune responses[J]. Int J Radiat Oncol Biol Phys, 2018, 101(4): 945-956. DOI:10.1016/j.ijrobp.2018.04.007 |
| [25] |
Jiang X, Jiang X, Qu C, et al. Intravenous delivery of adipose-derived mesenchymal stromal cells attenuates acute radiation-induced lung injury in rats[J]. Cytotherapy, 2015, 17(5): 560-570. DOI:10.1016/j.jcyt.2015.02.011 |
| [26] |
Zhang Y, Jiang X, Ren L. Optimization of the adipose-derived mesenchymal stem cell delivery time for radiation-induced lung fibrosis treatment in rats[J]. Sci Rep, 2019, 9(1): 5589. DOI:10.1038/s41598-019-41576-5 |
| [27] |
Guota N, Nizet V. Stabilization of hypoxia-inducible factor-1α augments the therapeutic capacity of bone marrow-derived mesenchymal stem cells in experimental pneumonia[J]. Front Med (Lausanne), 2018, 5: 131. DOI:10.3389/fmed.2018.00131 |
| [28] |
Inci N, Kamali D, AkyildizEO, et al. Translation of cellular senescence to novel therapeutics: Insights from alternative tools and models[J]. Front Aging, 2022, 3: 828058. DOI:10.3389/fragi.2022.828058 |
| [29] |
Nguyen HQ, To NH, Zadigue P, et al. Ionizing radiation-induced cellular senescence promotes tissue fibrosis after radiotherapy. A review[J]. Crit Rev Oncol Hematol, 2018, 139: 13-26. DOI:10.1016/j.critrevonc.2018.06.012 |
 2022, Vol. 42
2022, Vol. 42


