2. 徐州医科大学动物中心, 徐州 221004;
3. 中国矿业大学附属医院 徐州市第一人民医院放疗科, 徐州 221002
2. Animal Center of Xuzhou Medical University, Xuzhou 221004, China;
3. Department of Radiation Oncology, Xuzhou First People's Hospital, Affiliated Hospital of China University of Mining and Technology, Xuzhou 221002, China
对于原发性和继发性脑肿瘤患者,全脑放疗仍是控制肿瘤进展的重要治疗方法[1-2]。但有效控制肿瘤的同时,难以避免射线对周围正常组织的损伤,引起各种并发症,如放射性脑损伤和认知功能障碍,这将严重影响患者的日常生活能力[3]。海马是重要的学习记忆脑区,全脑放疗可引起海马组织发生一系列病理生理变化,如氧化应激反应、炎症反应等,从而导致认知功能障碍[4]。目前,尚未完全了解放射治疗引起的认知损害的发病机制,但经批准用于其他疾病的药物(如美金刚)用于防治放射性认知损害已经取得了一些进展[5]。近年来,益生菌被证明可以促进肠道屏障功能,降低炎症细胞因子水平,并抑制小胶质细胞的激活,进而减轻全身和神经性炎症[6]。动物双歧杆菌BB-12是人体一种重要的肠道有益微生物,是双歧杆菌中应用广泛的益生菌[7]。Meng等[8]研究发现,健康成人摄入含有BB-12的酸奶奶昔显著降低了脂多糖(LPS)刺激的外周骨髓细胞分泌的炎症细胞因子,这表明BB-12具有潜在的抗炎作用。因此,本研究以BB-12作为干预药物,通过观察小胶质细胞和星形胶质细胞激活情况、炎症因子表达水平及认知功能变化,探索BB-12是否能够减轻海马神经炎症和认知功能障碍。
材料与方法1. 实验动物:SPF级C57BL/6J雄性小鼠60只,7~8周龄,体重20~22 g,由徐州医科大学实验动物中心提供,合格证号:SYXK(苏)2020-0048。小鼠在温度为20~26℃、相对湿度为40%~70%、12 h明/12 h暗周期循环的环境下饲养,自由摄食摄水。
2. 主要试剂和仪器:医用直线加速器(美国Varian公司,Vital Beam 4936);动物双歧杆菌乳亚种(bifidobacterium animalis subsp. lactis, BB-12)购自北京科汉森贸易公司,含活菌数1×109 CFU/g;美金刚试剂(Memantine,上海MedChemExpress有限公司);封闭羊血清(美国OriGene公司);抗离子钙结合衔接分子1(Iba1)单克隆抗体(日本WAKO公司);抗胶质纤维酸性蛋白(GFAP)单克隆抗体(英国Abcam公司);山羊抗兔抗体Alexa Fluor 594结合物(英国Abcam公司);4′6-二脒基-2-苯基吲哚(DAPI)染色液(上海Beyotime公司);TRIzol试剂(北京天根生化科技公司);RNA反转录试剂盒及定量聚合酶链式反应(polymerase chain reaction,PCR)试剂盒(日本TaKaRa公司);利用Primer 3 plus软件设计白介素1β(IL-1β)、IL-6、肿瘤坏死因子α(TNF-α)及β-肌动蛋白引物,由上海生工生物工程股份有限公司合成;二喹啉甲酸(BCA)蛋白浓度测定试剂盒(上海Beyotime公司);IL-1β抗体(美国Affinity Biosciences公司);IL-6、TNF-α抗体(沈阳万类生物科技有限公司);辣根过氧化物酶标记的羊抗兔、羊抗鼠二抗(徐州VICMED生物工程有限公司)。动物行为学实验设备(Y-迷宫、ANY-maze动物行为分析系统)、LightCyclerⓇ 480 Ⅱ实时荧光定量PCR仪等设备由徐州医科大学公共实验研究中心提供。
3. 照射方案:小鼠腹腔注射质量分数1%的戊巴比妥溶液麻醉(50 mg/kg),待其静止后,在自制带有限光孔(2 cm × 25 cm)的方形铅板的保护下(射线通过带孔铅模块垂直照射小鼠脑部,小鼠并排8~10只,照射野避开小鼠双眼、口腔、鼻腔),俯卧固定于医用直线加速器治疗床上,并保证小鼠头部于同一水平线;6 MeV电子线,源皮距为100 cm,照射野2 cm × 25 cm,剂量为10 Gy单次照射小鼠全脑。
4. 动物分组:采用完全随机法,将小鼠分为健康对照组(Con组,12只):仅麻醉;益生菌组(BB-12组,12只):麻醉,给予BB-12治疗8周;单纯照射组(IR组,12只):麻醉后行10 Gy全脑照射;照射+美金刚组(IR+ Memantine组,12只):麻醉后行10 Gy全脑照射,再给予美金刚治疗8周。照射+益生菌组(IR+BB-12组,12只):麻醉后行10 Gy全脑照射,再给予BB-12治疗8周。
5. 给药方法:BB-12组和IR+BB-12组小鼠每天给予0.2 ml益生菌溶液(1×108 CFU/只)灌胃;IR+Memantine组小鼠每天腹腔给药美金刚(4 mg/kg);Con组和IR组小鼠均给予等量生理盐水灌胃,均在每日上午9 ∶00至12 ∶00给药,连续喂养8周。
6. 标本制备:照后8周,小鼠处死前称重,1%的戊巴比妥溶液腹腔注射麻醉小鼠。冰冻切片:小鼠经左心室灌注固定至僵硬状态,剥离全脑,放入10 ml装有4%多聚甲醛的EP管,固定过夜,后经15%、30%蔗糖依次脱水沉糖,行冷冻切片,切片厚度为20 μm。海马组织:将小鼠断头处死后,迅速在冰上剥离新鲜海马,后立即放入-80℃冰箱。
7. 认知行为测定:Y-迷宫实验的3个臂被随机设为新异臂、起始臂、其他臂。新异臂:在实验训练期用隔板挡住,在测试期打开;起始臂:小鼠由起始臂进入迷宫。起始臂和其他臂在实验期间一直打开。在每只小鼠测试结束后,先用75%乙醇擦拭清理,再用无菌水擦拭去除乙醇异味后继续下一只小鼠的测试。上方1 m处安置摄像镜头,全过程用ANY-maze动物行为分析系统进行记录。训练期:用隔板挡住新异臂,将小鼠由起始臂放入,使其在其余2个臂中自由活动5 min后放回笼里,1 h后进行测试期实验。测试期:移开挡板,将小鼠由起始臂放入后自由活动5 min。录像并记录5 min内每只小鼠在各个臂中的移动轨迹,手动记录小鼠进入各臂的次数(>2/3的小鼠身体入臂记为1次)。计算测试期5 min内小鼠进入新异臂的次数占进入3个臂的总次数的百分比,作为评价小鼠空间记忆能力的指标。
8. Iba1、GFAP免疫荧光染色及圆形度计算:用10%的山羊血清37℃封闭40 min后,直接将切片用一抗(Iba1、GFAP单克隆抗体,1∶500)孵育,4℃过夜;次日复温30 min后,用磷酸盐缓冲液(PBS)漂洗3次,用二抗(山羊抗兔抗体Alexa Fluor 594结合物,1∶500)室温孵育2 h,完成后用PBS漂洗3次;最后行DAPI溶液染色,常温孵育10 min后,用PBS漂洗3次,晾干后贴片。选择目标区域在荧光显微镜20倍镜下采集图像,后用ImageJ软件进行计数和分析。胶质细胞激活伴随着形态变化,即细胞的突起部分收缩,从分支状态演变为中间状态或“浓密”状态,最后转变为完整的杆状和变形虫形状或完全激活状态[9]。针对这种形变,圆形度可以作为胶质细胞的激活指标[10-11]。圆形度=4π×(面积)/(周长)2;其值为1.0时表示圆,越接近0表示形状越长。
9. QRT-PCR检测:按照试剂说明书,在无菌条件下从海马组织中提取总RNA,用RNA反转录试剂盒获得各组相应的cDNA。将得到的cDNA在LightCyclerⓇ 480Ⅱ实时荧光定量PCR检测系统上进行扩增。以β-肌动蛋白为内参对照,采用2-ΔΔCt法测定相对mRNA表达量。反应条件:95℃预变性30 s,1个循环;95℃变性5 s,60℃变性30 s,40个循环;95℃变性5 s,60℃变性1 min,95℃,1个循环;50℃降温30 s,1个循环。引物序列如下:IL-1β正向引物5′TGGGAAACAACAGTGGTCAG G 3′,反向引物5′CTGCTCATTCACGAAAAGGG A 3′;IL-6正向引物5′TCACAGAAGGAGTGGCTAAGGACC 3′,反向引物5′A CGCACTAGGTTTGCCGAGTAG A T 3′;TNF-α正向引物5′CTTGTTGCCTCCTCTTTTGCTTA 3′,反向引物5′CTTTATTTCTCTCAATGACCCGTA 3′;β-肌动蛋白正向引物5′AGAAGGTGGTGAAGCAGGCATC 3′,反向引物[JP2]5′CGAAGGTGGAAGAGTGGGAGTTG 3′。
10. Western blot检测:称取组织质量,先后加入蛋白裂解液RIPA和蛋白酶抑制剂PMSF,匀浆后,4℃、12 000 r/min,离心15 min,取上清液。BCA法测定蛋白浓度,变性并配平蛋白,每孔蛋白上样量为25 μg。使用10%聚丙烯酰胺(SDS-PAGE)凝胶电泳,再湿转到硝酸纤维素膜上,经快速封闭液室温封闭30 min后,加入相应一抗(1 ∶10 000),4℃摇床过夜。次日,吐温盐酸缓冲盐溶液(TBST)洗膜3次,每次10 min。加入相应的辣根过氧化物酶标记的特异性二抗(1∶5 000),室温摇床2 h,TBST缓冲液漂洗3次,每次10 min。使用凝胶成像仪进行显影和拍摄,采用ImageJ v1.8.0软件进行灰度值分析,定量分析后,计算各组与β-肌动蛋白灰度值的比值。
11. 统计学处理:利用图像软件GraphPad Prism 8对图像进行统计学分析及作图,实验数据符合正态分布,用x±s表示,组间两两比较采用独立样本t检验。P < 0.05为差异有统计学意义。
结果1.小鼠认知功能测试结果比较:照射后8周,与Con组相比,IR组小鼠在Y-迷宫实验中穿梭新异臂次数百分比显著减少[(49.61±4.57)% vs(37.22±7.19)%,t= 5.04,P < 0.05];而与IR组相比,IR+Memantine组和IR+BB-12组小鼠穿梭新异臂的次数百分比明显增加[(49.75±6.91)%、(47.65±2.62)%,t=4.35、4.72,P < 0.05)]。
2. 各组小鼠海马区Iba1免疫荧光结果比较:照射后,IR组小鼠海马DG区小胶质细胞标志物Iba1阳性细胞数量较Con组显著增多(t=3.05,P < 0.05),圆形度指数显著升高(t=7.18,P < 0.05),胞体呈圆形或长形,突起变粗,呈现激活状态;与IR组相比,IR+Memantine组和IR+BB-12组小鼠海马DG区小胶质细胞标志物Iba1阳性细胞数量显著减少(t=5.10、4.80,P < 0.05),圆形度指数显著降低(t=3.95、2.90,P < 0.05),胞体面积减少,突起趋于变细,小胶质细胞激活得到抑制,见图 1,表 1。
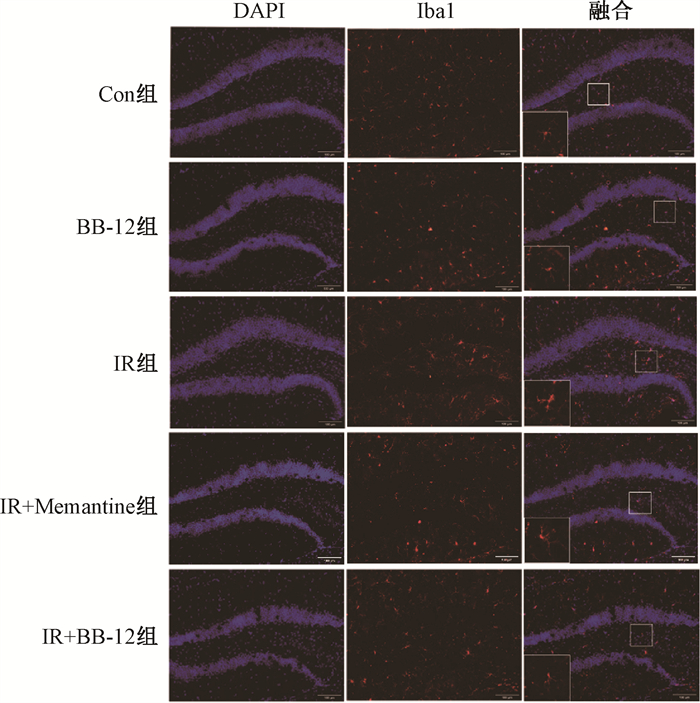
|
注:融合图中大方框为小方框内容放大 图 1 各组小鼠海马区Iba1的表达[KG*2]免疫荧光染色[KG*2]×100 Figure 1 Expression of Iba1 in the hippocampus of mice in each group Immunofluorescence staining ×100 |
|
|
表 1 各组小鼠Iba1阳性细胞数量及圆形度比较(x±s) Table 1 Comparison of the number and circularity of Iba1 positive cells in each group (x±s) |
3.各组小鼠海马区GFAP免疫荧光结果比较:与Con组相比,IR组小鼠海马DG区GFAP标记的阳性细胞数目明显增加(t=6.23,P < 0.05),圆形度指数显著升高(t=2.51,P < 0.05),胞体变肥大,突起变粗短,表明全脑照射引起小鼠海马区星形胶质细胞激活;经Memantinne和BB-12分别作用后,与IR组相比,小鼠海马DG区GFAP标记的阳性细胞数目明显减少(t=7.73、6.22,P < 0.05),圆形度指数显著降低(t=2.62、2.63,P < 0.05),胞体变小,突起变细,星形胶质细胞激活得到抑制,见表 2,图 2。
|
|
表 2 各组小鼠GFAP阳性细胞数量及圆形度比较(x±s) Table 2 Comparison of the number and circularity of GFAP positive cells in each group (x±s) |
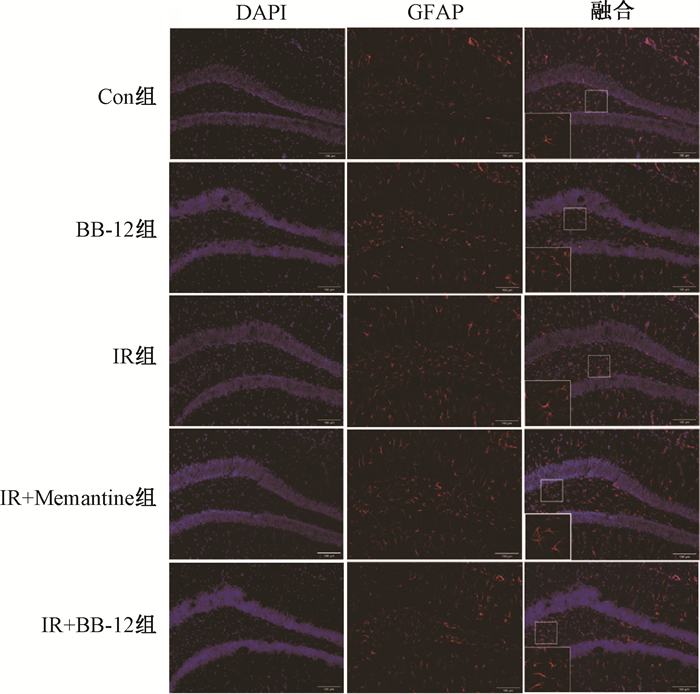
|
注:整合图中大方框为小方框内容放大 图 2 各组小鼠海马区GFAP的表达免疫荧光染色×100 Figure 2 Expression of GFAP in the hippocampus of mice in each group Immunofluorescence staining ×100 |
4.各组小鼠海马区促炎细胞因子mRNA表达水平比较:IR组小鼠海马区IL-1β、IL-6、TNF-α的含量显著高于Con组(t=4.10、3.04、4.18,P < 0.05)。经Memantine和BB-12作用后,可显著减少小鼠海马区受照后IL-1β、IL-6、TNF-α的含量(tMemantine=4.93、3.79、3.68,P < 0.05;tBB-12=4.19、3.40、2.84,P < 0.05),见表 3。
|
|
表 3 各组小鼠海马区促炎细胞因子mRNA表达水平比较(x±s) Table 3 Pro-inflammatory cytokine mRNA expression levels in the hippocampus of mice in each group (x±s) |
5.各组小鼠海马区促炎细胞因子蛋白表达水平比较:IR组小鼠海马区IL-1β、IL-6、TNF-α蛋白含量显著高于Con组(t=11.49、7.04、8.42,P < 0.05)。经Memantine和BB-12作用后,可显著减少小鼠海马区受照后IL-1β、IL-6、TNF-α蛋白含量(tMemantine=6.20、7.04、5.49,P < 0.05;tBB-12=6.36、4.03、3.75,P < 0.05),见图 3,表 4。结果表明,全脑照射可使小鼠海马区炎症水平升高,而动物双歧杆菌BB-12可使升高程度降低,这可能与神经炎症减轻有关。

|
注:1. Con组;2. BB-12组;3. IR组;4. IR+Memantine组;5. IR+BB-12组 图 3 各组小鼠海马区促炎细胞因子蛋白表达 Figure 3 Pro-inflammatory cytokine protein expression levels in the hippocampus of mice in each group |
|
|
表 4 各组小鼠海马区促炎细胞因子蛋白表达水平比较(x±s) Table 4 Pro-inflammatory cytokine proteins expression levels in the hippocampus of mice in each group (x±s) |
讨论
虽然全脑放疗对肿瘤消退和症状减轻有效,但其引起的放射性脑损伤和认知功能障碍仍受到人们普遍质疑[12]。研究认为,放疗造成的亚急性期损害将在照射后1至6个月内显现,且这些损害可能是可逆的;而晚期神经不良反应已被证明发生在照射后6个月或甚至更晚,这种不良反应的特征是不可逆转和高度可变的进行性症状[13-14]。一般认为,放射性脑损伤的亚急性期损害主要表现为炎性反应,如持续的胶质细胞激活[15]、炎症因子表达增加[16]等。包括吲哚美辛在内的抗炎药已被证明可以减少海马区激活的小胶质细胞的数量,并改善放疗引起的认知障碍[17-18]。但这些药物并非放射性脑损伤的特定药物,可能存在许多不良反应,因此,仍需继续探索放射性脑损伤的抗炎药物。
益生菌是定植于人体消化系统并发挥积极作用的活性微生物,能够优化肠道微生物菌群,改善宿主微生态平衡,对许多疾病的治疗起到有益作用[19]。Kobayashi等[20]的研究证明口服短双歧杆菌A1可以通过抑制海马炎症和免疫反应基因表达来预防阿尔茨海默病小鼠的认知缺陷。本实验利用与其相同的Y-迷宫方法来评估短期记忆和识别能力。Y-迷宫方法是基于啮齿动物探索新环境的先天倾向,被认为能有效检测小鼠的空间识别记忆能力[21-22]。本研究发现,与Con组比较,IR组小鼠空间识别记忆能力受到明显损伤;经BB-12治疗后,照射对小鼠造成的认知功能损伤明显改善,这可能与海马区神经炎症减轻有关。
神经炎症最初是一种保护机制,可以恢复中枢神经系统中受损的神经胶质细胞和神经细胞;但过度的炎症反应会损害中枢神经系统的神经回路及其功能,抑制神经元再生[23]。研究表明,放疗会激活小胶质细胞和星形胶质细胞,并诱导炎症因子(IL-1β、IL-6、TNF-α)释放,从而导致神经炎症、神经元损伤和认知障碍[24]。近年来,研究发现益生菌具有抗炎作用,可有效减轻认知功能障碍。例如Luo等[14]给小鼠口服益生菌-4(由乳杆菌、干酪乳杆菌、双歧杆菌和嗜酸乳杆菌组成的益生菌制剂)12周后显著改善了神经炎症介导的老年小鼠的记忆障碍、脑神经元和突触损伤、胶质细胞激活,并改变了肠道微生物区系组成。Abdelhamid等[25]给阿尔茨海默病造模小鼠补充短双歧杆菌MCC1274后,显著减少了海马中的Iba1阳性细胞数量和蛋白水平,降低了炎症因子IL-6和IL-1β mRNA表达水平,并改善了小鼠认知记忆障碍。本实验结果显示,照射后海马区小胶质细胞和星形胶质细胞都被不同程度地激活。QRT-PCR和Western blot结果显示,IR组小鼠在胶质细胞激活的同时,炎症因子IL-1β、IL-6和TNF-α也过度表达。而照射后经BB-12治疗的小鼠海马区小胶质细胞和星形胶质细胞激活被明显抑制,IL-1β、IL-6和TNF-α表达水平显著下降,提示BB-12可能通过抑制小胶质细胞和星形胶质细胞激活来减少炎症因子表达,从而减轻照射造成的海马神经炎症反应。
对于BB-12是通过何种途径来调节大脑中的神经炎症的,有研究认为,益生菌能够改变肠道微生物的组成,从而调节大脑中的基因表达[26];益生菌可以直接参与微生物群脑-肠轴的通讯,通过迷走神经将信息从外周器官传递到中枢神经系统[27];益生菌刺激迷走神经,通过神经递质乙酰胆碱发挥抗炎作用[28],并对难治性抑郁症、癫痫有治疗作用[29]。另外,肠道微生物菌群的代谢物变化也可能参与机制。使用益生菌治疗可能会影响肠道中微生物代谢活动,并调节宿主代谢组,从而影响中枢神经系统功能[30]。今后需要进一步研究动物双歧杆菌BB-12改善海马神经炎症和认知功能障碍的机制。
综上所述,放疗激活小胶质细胞和星形胶质细胞,导致炎症因子IL-1β、IL-6和TNF-α释放,引起海马神经炎症和认知功能障碍。BB-12通过抑制胶质细胞激活,减轻炎症因子的产生,改善小鼠海马神经炎症和认知功能障碍。BB-12作为一种对人体有益的益生菌,为海马神经炎症和认知功能障碍的治疗提供了新的可能。但是, 仍然需要更多的研究,来探究其涉及的分子机制。
利益冲突 无
作者贡献声明 杨珊负责实验操作、收集数据、撰写论文;吴连连协助部分实验的完成,参与论文撰写;郭雯、丁云鹤、董海北、吴小进指导实验,参与论文修改
| [1] |
Jacob J, Durand T, Feuvret L, et al. Cognitive impairment and morphological changes after radiation therapy in brain tumors: A review[J]. Radiother Oncol, 2018, 128(2): 221-228. DOI:10.1016/j.radonc.2018.05.027 |
| [2] |
Guo L, Du QQ, Cheng PQ, et al. Neuroprotective effects of lycium barbarum berry on neurobehavioral changes and neuronal loss in the hippocampus of mice exposed to acute ionizing radiation[J]. Dose Response, 2021, 19(4): 15593258211057768. DOI:10.1177/15593258211057768 |
| [3] |
Wefel JS, Vardy J, Ahles T, et al. International Cognition and Cancer Task Force recommendations to harmonise studies of cognitive function in patients with cancer[J]. Lancet Oncol, 2011, 12(7): 703-708. DOI:10.1016/S1470-2045(10)70294-1 |
| [4] |
王贞, 罗诗诗, 牛磊, 等. 电离辐射激活海马星形胶质细胞诱导小鼠认知功能障碍[J]. 辐射研究与辐射工艺学报, 2019, 37(1): 18-24. Wang Z, Luo SS, Niu L, et al. Ionizing radiation induces cognitive dysfunction by activating hippocampal astrocytes in mice[J]. J Radiat Res Radiat Proc, 2019, 37(1): 18-24. DOI:10.11889/j.1000-3436.2019.rrj.37.010301 |
| [5] |
Duman JG, Dinh J, Zhou W, et al. Memantine prevents acute radiation-induced toxicities at hippocampal excitatory synapses[J]. Neuro Oncol, 2018, 20(5): 655-665. DOI:10.1093/neuonc/nox203 |
| [6] |
Lv T, Ye M, Luo F, et al. Probiotics treatment improves cognitive impairment in patients and animals: A systematic review and meta-analysis[J]. Neurosci Biobehav Rev, 2021, 120: 159-172. DOI:10.1016/j.neubiorev.2020.10.027 |
| [7] |
He F, Ouwehan AC, Hashimoto H, et al. Adhesion of Bifidobacterium spp. to human intestinal mucus[J]. Microbiol Immunol, 2001, 45(3): 259-262. DOI:10.1111/j.1348-0421.2001.tb02615.x |
| [8] |
Meng H, Ba Z, Lee Y, et al. Consumption of Bifidobacterium animalis subsp. lactis BB-12 in yogurt reduced expression of TLR-2 on peripheral blood-derived monocytes and pro-inflammatory cytokine secretion in young adults[J]. Eur J Nutr, 2017, 56(2): 649-661. DOI:10.1007/s00394-015-1109-5 |
| [9] |
Pinto MV, Fernandes A. Microglial phagocytosis-rational but challenging therapeutic target in multiple sclerosis[J]. Int J Mol Sci, 2020, 21(17). DOI:10.3390/ijms21175960 |
| [10] |
Zanier ER, Fumagalli S, Perego C, et al. Shape descriptors of the " never resting" microglia in three different acute brain injury models in mice[J]. Intensive Care Med Exp, 2015, 3(1): 39. DOI:10.1186/s40635-015-0039-0 |
| [11] |
Shi H, Wang Q, Zheng M, et al. Supplement of microbiota-accessible carbohydrates prevents neuroinflammation and cognitive decline by improving the gut microbiota-brain axis in diet-induced obese mice[J]. J Neuroinflammation, 2020, 17(1): 77. DOI:10.1186/s12974-020-01760-1 |
| [12] |
Akiba T, Kunieda E, Kogawa A, et al. Re-irradiation for metastatic brain tumors with whole-brain radiotherapy[J]. Jpn J Clin Oncol, 2012, 42(4): 264-269. DOI:10.1093/jjco/hys007 |
| [13] |
Rogers GB, Keating DJ, Young RL, et al. From gut dysbiosis to altered brain function and mental illness: mechanisms and pathways[J]. Mol Psychiatry, 2016, 21(6): 738-748. DOI:10.1038/mp.2016.50 |
| [14] |
Luo XX, Yang C, Zhan GF, et al. Whole brain radiotherapy induces cognitive dysfunction in mice: key role of gut microbiota[J]. Psychopharmacology (Berl), 2020, 237(7): 2089-2101. DOI:10.1007/s00213-020-05520-0 |
| [15] |
Hinkle JJ, Olschowka JA, Love TM, et al. Cranial irradiation mediated spine loss is sex-specific and complement receptor-3 dependent in male mice[J]. Sci Rep, 2019, 9(1): 18899. DOI:10.1038/s41598-019-55366-6 |
| [16] |
Zhou K, Xie C, Wickstr m M, et al. Lithium protects hippocampal progenitors, cognitive performance and hypothalamus-pituitary function after irradiation to the juvenile rat brain[J]. Oncotarget, 2017, 8(21): 34111-34127. DOI:10.18632/oncotarget.16292 |
| [17] |
Xue J, Dong JH, Huang GD, et al. NF-κB signaling modulates radiation-induced microglial activation[J]. Oncol Rep, 2014, 31(6): 2555-2560. DOI:10.3892/or.2014.3144 |
| [18] |
Monje ML, Toda H, Palmer TD. Inflammatory blockade restores adult hippocampal neurogenesis[J]. Science, 2003, 302(5651): 1760-1765. DOI:10.1126/science.1088417 |
| [19] |
Lichtenstein L, Avni-Biron I, Ben-Bassat O. Probiotics and prebiotics in Crohn's disease therapies[J]. Best Pract Res Clin Gastroenterol, 2016, 30(1): 81-88. DOI:10.1016/j.bpg.2016.02.002 |
| [20] |
Kobayashi Y, Sugahara H, Shimada K, et al. Therapeutic potential of Bifidobacterium breve strain A1 for preventing cognitive impairment in Alzheimer's disease[J]. Sci Rep, 2017, 7(1): 13510. DOI:10.1038/s41598-017-13368-2 |
| [21] |
刘小粉, 颜子力, 王建红, 等. 长期注射吗啡对戒断后小鼠Y-迷宫空间识别记忆的影响[J]. 动物学研究, 2009, 30(2): 199-203. Lui XF, Yan ZL, Wang JH, et al. Effects of withdrawal on Y-maze spatial recognition memory in mice after long-term morphine injection[J]. Zoological Res, 2009, 30(2): 199-203. DOI:10.3724/SP.J.1141.2009.02199 |
| [22] |
Dellu F, Contarino A, Simon H, et al. Genetic differences in response to novelty and spatial memory using a two-trial recognition task in mice[J]. Neurobiol Learn Mem, 2000, 73(1): 31-48. DOI:10.1006/nlme.1999.3919 |
| [23] |
Carabotti M, Scirocco A, Maselli MA, et al. The gut-brain axis: interactions between enteric microbiota, central and enteric nervous systems[J]. Ann Gastroenterol, 2015, 28(2): 203-209. |
| [24] |
Liddelow SA, Guttenplan KA, Clarke LE, et al. Neurotoxic reactive astrocytes are induced by activated microglia[J]. Nature, 2017, 541(7638): 481-487. DOI:10.1038/nature21029 |
| [25] |
Abdelhamid M, Zhou C, Ohno K, et al. Probiotic bifidobacterium breve prevents memory impairment through the reduction of both amyloid-β production and microglia activation in APP knock-in mouse[J]. J Alzheimers Dis, 2022, 85(4): 1555-1571. DOI:10.3233/JAD-215025 |
| [26] |
Distrutti E, O'Reilly JA, McDonald C, et al. Modulation of intestinal microbiota by the probiotic VSL#3 resets brain gene expression and ameliorates the age-related deficit in LTP[J]. PLoS One, 2014, 9(9): e106503. DOI:10.1371/journal.pone.0106503 |
| [27] |
Tillisch K, Labus J, Kilpatrick L, et al. Consumption of fermented milk product with probiotic modulates brain activity[J]. Gastroenterology, 2013, 144(7): 1394-1401. DOI:10.1053/j.gastro.2013.02.043 |
| [28] |
Borovikova LV, Ivanova S, Zhang M, et al. Vagus nerve stimulation attenuates the systemic inflammatory response to endotoxin[J]. Nature, 2000, 405(6785): 458-462. DOI:10.1038/35013070 |
| [29] |
Morris GL 3rd, Mueller WM. Long-term treatment with vagus nerve stimulation in patients with refractory epilepsy. The Vagus Nerve Stimulation Study Group E01-E05[J]. Neurology, 1999, 53(8): 1731-1735. DOI:10.1212/wnl.53.8.1731 |
| [30] |
Rothhammer V, Mascanfroni ID, Bunse L, et al. Type Ⅰ interferons and microbial metabolites of tryptophan modulate astrocyte activity and central nervous system inflammation via the aryl hydrocarbon receptor[J]. Nat Med, 2016, 22(6): 586-597. |
 2022, Vol. 42
2022, Vol. 42


