2. 首都医科大学附属北京同仁医院放射科, 北京 100730;
3. 北京市疾病预防控制中心放射卫生防护所, 北京 100013
2. Department of Radiology, Beijing Tongren Hospital, Captial Medical University, Beijing 100730, China;
3. Institute of Radiological Protection, Beijing Center for Disease Prevention and Control, Beijing 100013, China
根据世界卫生组织(WHO)国际癌症研究机构(International Agency for Research on Cancer,IARC)发布的2020年全球最新癌症数据中,乳腺癌已成为当今世界的第一大癌症[1]。数字乳腺X射线摄影(digital mammography,DM)是目前发现和诊断早期乳腺癌最有效的手段之一。而DM也会给受检者带来辐射风险,该风险与受照剂量密切相关,因此对受检者的受照剂量进行准确评估至关重要[2]。乳房腺体含量的准确评估是乳腺剂量个体化评估的前提[3]。另一方面,腺体含量也是乳腺癌的一项重要的风险因子,也对乳腺癌的检出有一定影响[4]。自2009年在美国康涅狄格州通过第一部乳腺腺体含量报告法案后,截至2018年,美国的36个州现已拥有此类立法。这使得提供可靠的乳腺腺体含量估计显得尤为重要。
目前针对腺体含量的研究主要将腺体含量使用质量百分比和体积百分比两种方式进行表述[2]。乳房纤维腺体区域中腺体的质量百分比为乳腺质量密度,又叫腺体百分含量(percentage mass glandularity,PMG)。全乳区域中纤维腺体的体积百分比为乳腺体积密度(volumetric breast density,VBD)。北美放射协会(American College of Radiology,ACR)制定的乳腺影像报告和数据系统(breast imaging reporting and data system,BI-RADS)标准采用了质量百分比的方式对乳房腺体含量进行分级[5]。Mahr等[6]、Graff[7]、Wang等[8]在进行精细乳腺模型建模时采用PMG对腺体含量进行表征。部分研究分析临床DM图像采用VBD进行表示[9-13]。
2013年,Ellison-Loschmann等[14]研究了新西兰女性VBD在年龄和人种上的差异。2014年,天津医科大学闫晔在博士论文中研究了中国女性PMG的等级分布情况[15],其评估方法是根据BI-RADS进行腺体含量分型判断,未给出具体的PMG值,分析探讨了影响中国女性腺体含量分布的相关因素。由于VBD评估方法的多样性和样本量的限制,不同国家地区、不同人种间VBD分布差异尚无系统的评价比较,不同种族女性VBD的差异结论尚不统一。本文根据VBD探讨我国女性乳腺腺体含量分布规律,对DM乳腺剂量个体化评估具有重要价值。
资料与方法1. 临床资料:回顾性收集2010年1月—2016年12月在北京市某三甲医院接受乳腺X射线摄影筛查诊断的女性患者1 140例,每例患者DM图像包含双侧乳房的头尾位(cranio caudal,CC)与内外斜位(mediolateral oblique,MLO)的图像。排除有手术史者、乳房有植入假体者、基本信息收录不全者。
2. 摄影参数及数据获取方法:采用美国Hologic Selenia全野数字乳腺X射线摄影机常规加压对乳房CC位及MLO位进行摄像,采用自动曝光模式,根据乳房大小、加压后的乳房厚度及腺体致密程度自动调节X射线的剂量进行乳腺X射线摄影筛查。乳腺X射线摄影机采用非晶硒平板探测器,像素尺寸70 μm,源像距65 cm,焦点尺寸0.3 mm,照射野18 cm × 24 cm,附加滤过材料钼(Mo)和铑(Rh)厚度均为0.03 mm,靶材料为钼(Mo)。
腺体含量主要的评估方法分为定量和定性两大类研究方法。定量研究主要是借助计算机成像系统和半自动诊断系统计算VBD或PMG。定性研究主要是根据放射医师经验将腺体含量分为密度大小不同的几个等级。本研究主要采用第1种方法进行VBD的测定,而Wolfe[16]、Tabár和Dean [17]、Boyd等[18]和BI-RADS[5]分类方法主要采用第2种方法。
Volpara是新西兰Volpara Health公司基于乳腺X射线摄影图像定量评估VBD的工具。本研究使用Volpara1.5.1来对乳腺X射线摄影的图像进行分析,采用算法分析根据图像灰度值得到VBD。Volpara软件结合了X射线成像技术分析,利用图像灰度值识别腺体、脂肪等区域,可以对照射图像中的乳房成分进行精确的体积测量,是估计患者乳腺平均腺体剂量(mean glandular dose,MGD)的首选VBD测量工具[19]。
受检者的VBD计算采用MLO位和CC位图像获取的乳腺腺体体积平均值。乳腺腺体体积计算时采用左右乳房平均值。
3. 数据整理:Volpara对VBD进行了分级(volpara density grade,VDG): VDG1为VBD≤4.5%,VDG2为4.5% < VBD≤7.5%, VDG3为7.5% <VBD≤15.5%,VDG4为VBD>15.5%[20],分别和BI-RADS的4个分级对应。
4. 统计学处理:本研究采用SPSS 24.0软件进行数据分析,Origin 19.0软件用于绘图。计量资料符合正态分布,数据以x±s表示。两组间均数比较采用两独立样本t检验,多组间均数比较经方差齐性检验采用单因素方差分析。计数资料组间比较采用Pearson χ2检验。线性回归模型评估乳房压迫厚度(compressed breast thickness,CBT)、乳房体积(breast volume,BV)、腺体体积(glandular volume,GV)和VBD随受检者年龄的变化,并进行相关分析,Pearson相关系数用于描述两连续变量间的相关关系,Spearman相关系数用于描述非连续变量间的相关关系。P < 0.05为差异有统计学意义。
结果1.数据结果及分析:受检女性的年龄范围21~79岁,平均年龄为(49.0±9.7)岁,CBT、BV、GV、VBD的均值分别为(46.48±11.21)mm、(491.77±256.96)cm3、(63.31±36.44)cm3和14.57%±7.24 %。由于本研究中受检者年龄的均值和中位数均为49岁,因此,将全部受检者按年龄分为两组,分别为 < 50岁组和≥50岁组。各年龄组受检者的CBT、BV、GV以及VBD占比情况见表 1。两个年龄组受检者的CBT、BV、GV、VBD存在明显差异,50岁及以上受检者的CBT和BV明显>50岁以下受检者(t= -8.99、-7.92,P < 0.001),而BV和VBD明显 < 50以下受检者(t= 8.11、18.49,P < 0.001)。
|
|
表 1 不同年龄组受检者乳腺X射线摄影检查结果(x±s) Table 1 Mammography results in different age groups (x±s) |
通过Volpara系统对VBD进行分级,从而将VBD分为4组,即VDG1(VBD≤4.5%),VDG2(4.5% < VBD≤7.5%),VDG3(7.5% < VBD≤15.5%)和VDG4(VBD>15.5%)。如表 2所示,VBD分级在两年龄组间的构成也存在明显差异(χ2=217.78,P < 0.001)。Spearman相关性分析显示年龄与VDG分级存在负相关关系(r=-0.47,P < 0.001),对年龄进行分层后,在 < 50岁组和≥50岁组中,VDG分级和年龄依然存在较弱但在统计学上显著的负相关关系(r= - 0.12、- 0.29,P < 0.05)。
|
|
表 2 不同年龄组VBD分级VDG的构成情况及其与年龄的相关性分析 Table 2 The proportion of VDG in different age groups and its correlation with age |
为进一步分析年龄因素对受检者CBT、BV、GV、VBD和VDG分级的影响,对年龄分组进行细化:即 < 40岁组,40~49岁组,50~59岁组以及≥ 60岁组,其CBT分别为(43.43±10.62)、(43.76± 10.25)、(49.34±11.21)和(49.67±11.56)mm;BV分别为(451.12±263.02)、(425.87±224.69)、(540.83±263.46)和(579.12±258.31)cm3;GV分别为(72.38±41.63)、(71.19±40.85)、(57.91±30.27)和(46.64±21.34)cm3;VBD分别为17.58%±6.41%、18.15%±7.39%、11.80%±5.52%、9.10%±5.02%。上述各指标在4个年龄组间的差异均有统计学意义(F=27.10、22.34、25.70、122.03,P < 0.001)。年龄在60岁及以上的受检者的VBD最低(t=-12.56、-15.27、-4.57,P < 0.001),VBD与年龄呈负相关(r=0.47,P < 0.001),受检者VBD有随着年龄的增加而降低的趋势。VDG分级在各年龄组中的构成情况如图 1所示,4个年龄组中的VDG分级构成差异具有统计学意义(χ2=217.78,P < 0.001)。
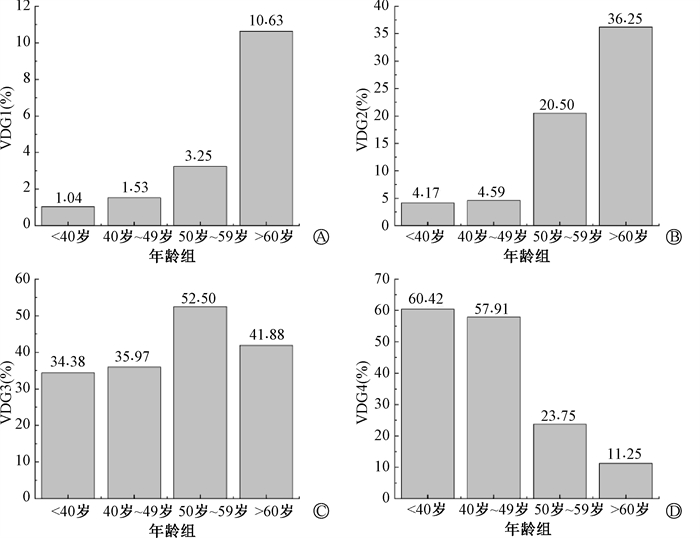
|
注:VDG1. VBD≤4.5%;VDG2. 4.5% < VBD≤7.5%;GV. VDG3. 7.5% < VBD≤15.5%;VDG4. VBD>15.5%;VBD. 乳腺体积密度。4个年龄组间VDG分级存在差异,χ2=263.37, P < 0.001 图 1 VDG各分级在各年龄组中的百分比构成情况 A. VDG1;B. VDG2;C. VDG3;D. VDG4 Figure 1 The proportion of VDG in each age group A. VDG1;B. VDG2;C. VDG3;D. VDG4 |
|
|
表 3 CBT、BV、GV和VBD与年龄关系的线性回归分析 Table 3 Linear regression analysis of the influence of age on CBT, BV, GV and VBD |
将CBT、BV、GV、VBD作为因变量,年龄作为自变量进行线性回归分析,结果表明年龄对CBT、BV、GV、VBD存在明显影响(t= 7.86、6.77、-17.91、-9.34,P < 0.001)。CBT和BV随着年龄的增加而增加,年龄每增加1岁,CBT和BV分别增加0.23 mm和0.20 cm3;GV和VBD随着年龄的增加而下降,年龄每增长1岁,GV和VBD分别降低0.27 cm3和0.47 %。
讨论从数据分析结果来看,受检者CBT和BV随着年龄的增加而增加,GV和VBD随着年龄的增加而下降。随着年龄的增长,尤其是当年龄到达50岁以上时,4.5% < VBD≤7.5%和VBD≤4.5%女性所占比重迅速上升,主要原因是年龄增长带来激素水平下降,乳腺的功能在逐渐下降,更多的腺体组织被脂肪组织代替,因此使得乳房的致密程度在下降。
VBD可作为乳腺癌风险评估模型中一个非常重要的候选参数。各地区分布同时受到环境因素和遗传因素的双重影响。流行病学研究显示,VBD与其他一些乳腺癌风险因素有相关性,例如年龄、体质量指数(body mass index, BMI)、激素替代疗法(hormone replacement therapy,HRT)和生育因素等[21-22]。一般认为,VBD与BMI因素呈负相关;初产年龄越大,生育次数越少,以及绝经后HRT的应用,都会造成VBD增大[21-23]。VBD是一个可变的指标,可以通过改变生活方式等措施影响VBD进而影响乳腺癌发生风险。
研究人员分析了由中国抗癌协会发起于2008年7月1日至2010年12月30实施的多模式独立筛选试验的数据[24],得出了绝经状态和生育次数与乳腺腺体含量呈负相关关系,乳腺早期良性疾病和初产年龄偏晚与乳腺腺体含量正相关的结论。他们还和美国乳腺癌监测联盟的数据做了对比。数据发现,对于中国女性,年龄 < 50岁的乳房致密人群占比94.8%,年龄≥50岁的乳房致密人群占比83.1%,而对于美国女性,年龄 < 50岁的乳房致密人群占比88.3%,年龄≥50岁的乳房致密人群占比84.9%。结果表明,年轻的中国女性乳房比年轻的美国女性乳房更致密,而老年女性的情况则相反。
迄今为止,国际上关于不同种族VBD差异的研究很少。之前大多数关于乳腺X射线摄影VBD种族差异的研究都是在美国进行[25-26],荷兰[27]和新西兰[14]的研究同样使用了Volpara来获得VBD。本研究结合美国的一项关于VBD和人种的研究[28],发现亚裔女性的VBD显著高于其他人种,中国女性VBD主要集中于VDG3、VDG4,VBD更高。荷兰及新西兰人种女性VBD主要集中于VDG1、VDG2,VBD整体偏低。亚裔美、非裔美、白人的VBD集中于VDG2、VDG3。与其他人种(包括荷兰、新西兰、亚裔美和非裔美)相比,中国女性乳房更为致密。在美国的研究中,大多数报告称非洲裔美国女性的腺体含量低于美国白人女性[29]。同样本研究发现亚裔女性相较于太平洋女性拥有更高的VBD,很可能是由于体内脂肪的差异造成的。有研究表明,VBD可能不能很好地对种族进行预测,因为该参数指标受到乳房大小的很大影响,并且乳房大小也同样显示出明显的种族差异[29],两个指标可能会在种族预测上相互干扰。未来探索的另一个关键领域将是,VBD的差异是否可以解释中国和其他国家之间乳腺癌风险的种族差异。值得一提的是,由于中国南北方饮食和生活习惯的差异,女性乳腺体积密度在中国不同地域之间也存在着很大差异。乳腺体积密度对于乳腺剂量学是一个非常重要的参数。由于乳房三维解剖结构在乳房剂量测定的早期并不明确,目前针对乳腺剂量学的研究,Dance等[2]提出的均质乳房模型仍占主导地位。但是这种简单模型并不能代表乳房的真实结构,更无法准确表示出在乳腺X射线摄影过程中剂量的实际分布。近年来,数字乳腺体层合成摄影(digital breast tomosynthesis,DBT)和数字乳腺计算机断层成像(digital breast computed tomography,DBCT)技术的发展使得研究者可以获得乳房内部精细结构的三维信息。随着乳房组织自动分类算法的研究[30],研究者可以获得准确的乳腺体积密度。结合蒙特卡罗方法或考虑精细解剖结构的乳腺剂量转换系数,对于患者特异性MGD估计也将成为可能。但是由于乳腺X射线摄影二维图像提供信息有限,想要改进现有的乳腺体积密度评估方法,获取更准确的乳腺体积密度,则需要更为准确的DBT组织分类算法做进一步的验证[2]。
本研究局限于仅有一家医院的数据,获得信息有限,未来可通过更多中国不同地区医院数据的分析,来获得更准确的研究结论。其次,根据前面的分析,对于一次完整的X射线摄影,左侧乳腺和右侧乳腺的头尾位和内侧斜位,它们的摄影参数是不一致的,但4种数据又不是完全独立的,本研究尚未能将它们综合起来赋予权重考虑。另外,本研究的资料收集时间覆盖范围为6~7年,在这期间随着乳腺X射线摄影条件和方法的发展,工作人员的技术能力和工作质量的变化等都会影响结论的可靠性。未来可根据更加丰富的样本信息,预测估计中国女性年龄和VBD之间的关系,在进行乳腺X射线摄影检测之前初步判断患者的VBD,进而选取合适的压迫方式、曝光参数和提前评估乳腺在X射线摄影中所受到的剂量。
利益冲突 无本研究具有独立性与科学性,研究设计、收集、分析和文章撰写均由本文的共同作者完成,共同作者间无利益冲突关系,本研究与商业机构间无财务往来
志谢 感谢北京达影科技有限公司吴涛博士和Volpara公司提供的帮助
作者贡献声明 王佳豪、胡安康负责整理分析数据,起草论文;邱睿、牛延涛、李君利负责数据审核和论文修改;康天良、冯泽臣负责完成摄影图像获取和整理
| [1] |
Cao W, Chen HD, Yu YW, et al. Changing profiles of cancer burden worldwide and in China: a secondary analysis of the global cancer statistics 2020[J]. Chin Med J (Engl), 2021, 134(7): 783-791. DOI:10.1097/CM9.0000000000001474 |
| [2] |
Dance DR, Sechopoulos I. Dosimetry in x-ray-based breast imaging[J]. Phys Med Biol, 2016, 61(19): R271-R304. DOI:10.1088/0031-9155/61/19/R271 |
| [3] |
Wang WJ, Qiu R, Ren L, et al. Detailed breast model and its application to glandular dose estimation in mammography[J]. Atom Energy Sci Tech, 2016, 50(11): 2085-2091. DOI:10.7538/yzk.2016.50.11.2085 |
| [4] |
Destounis SV, Santacroce A, Arieno A. Update on breast density, risk estimation, and supplemental screening[J]. AJR Am J Roentgenol, 2020, 214(2): 296-305. DOI:10.2214/AJR.19.21994 |
| [5] |
Dorsi CJ, Sickles EA, Mendelson EB, et al. Breast imaging reporting and data system: ACR BI-RADS-breast imaging atlas[R]. Reston VA: American College of Radiology, 2013.
|
| [6] |
Mahr DM, Bhargava R, Insana MF. Three-dimensional in silico breast phantoms for multimodal image simulations[J]. IEEE Trans Med Imaging, 2012, 31(3): 689-697. DOI:10.1109/tmi.2011.2175401 |
| [7] |
Graff CG. A New, Open-Source, Multi-modality digital breast phantom[C]. San Diego: Physics of Medical Imaging, 2016. DOI: 10.1117/12.2216312.
|
| [8] |
Wang WJ, Qiu R, Ren L, et al. Monte Carlo calculation of conversion coefficients for dose estimation in mammography based on a 3D detailed breast model[J]. Med Phys, 2017, 44(6): 2503-2514. DOI:10.1002/mp.12210 |
| [9] |
Huang SY, Boone JM, Yang K, et al. The effect of skin thickness determined using breast CT on mammographic dosimetry[J]. Med Phys, 2008, 35(4): 1199-1206. DOI:10.1118/1.2841938 |
| [10] |
Huang SY, Boone JM, Yang K, et al. The characterization of breast anatomical metrics using dedicated breast CT[J]. Med Phys, 2011, 38(4): 2180-2191. DOI:10.1118/1.3567147 |
| [11] |
Yaffe MJ, Boone JM, Packard N, et al. The myth of the 50-50 breast[J]. Med Phys, 2009, 36(12): 5437-5443. DOI:10.1118/1.3250863 |
| [12] |
Vedantham S, Shi L, Karellas A, et al. TU-E-217BCD-05:Dedicated breast CT: skin thickness measurements in a diagnostic population[J]. Med Phys, 2012, 39(6Part24): 3914-3915. DOI:10.1118/1.4735977 |
| [13] |
Vedantham S, Shi L, Karellas A, et al. Dedicated breast CT: fibroglandular volume measurements in a diagnostic population[J]. Med Phys, 2012, 39(12): 7317-7328. DOI:10.1118/1.4765050 |
| [14] |
Ellison-Loschmann L, McKenzie F, Highnam R, et al. Age and ethnic differences in volumetric breast density in new zealand women: a cross-sectional study[J]. PLoS One, 2013, 8(7): e70217. DOI:10.1371/journal.pone.0070217 |
| [15] |
闫晔. 中国女性乳腺腺体密度分布及其影响因素的研究[D]. 天津: 天津医科大学, 2014. Yan Y. Distribution of mammographic density and its influential factors among chinese women[D]. Tianjin: Tianjin Medical University, 2014. |
| [16] |
Wolfe JN. Breast patterns as an index of risk for developing breast cancer[J]. AJR Am J Roentgenol, 1976, 126(6): 1130-1137. DOI:10.2214/ajr.126.6.1130 |
| [17] |
Tabár L, Dean PB. Mammographic parenchymal patterns. Risk indicator for breast cancer?[J]. JAMA, 1982, 247(2): 185-189. |
| [18] |
Boyd NF, Byng JW, Jong RA, et al. Quantitative classification of mammographic densities and breast cancer risk: results from the canadian national breast screening study[J]. J Natl Cancer Inst, 1995, 87(9): 670-675. DOI:10.1093/jnci/87.9.670 |
| [19] |
Teo I, Whelehan P, Macaskill JE, et al. Volpara as a measurement tool for breast volume[J]. J Plast Reconstr Aesthet Surg, 2016, 69(4): 581-582. DOI:10.1016/j.bjps.2015.11.024 |
| [20] |
Gubern-Mérida A, Kallenberg M, Platel B, et al. Volumetric breast density estimation from full-field digital mammograms: a validation study[J]. PLoS One, 2014, 9(1): e85952. DOI:10.1371/journal.pone.0085952 |
| [21] |
Phipps AI, Buist DS, Malone KE, et al. Breast density, body mass index, and risk of tumor marker-defined subtypes of breast cancer[J]. Ann Epidemiol, 2012, 22(5): 340-348. DOI:10.1016/j.annepidem.2012.02.002 |
| [22] |
Shieh Y, Scott CG, Jensen MR, et al. Body mass index, mammographic density, and breast cancer risk by estrogen receptor subtype[J]. Breast Cancer Res, 2019, 21(1): 48. DOI:10.1186/s13058-019-1129-9 |
| [23] |
Schousboe JT, Kerlikowske K, Loh A, et al. Personalizing mammography by breast density and other risk factors for breast cancer: analysis of health benefits and cost-effectiveness[J]. Ann Intern Med, 2011, 155(1): 10-20. DOI:10.7326/0003-4819-155-1-201107050-00003 |
| [24] |
Dai H, Yan Y, Wang P, et al. Distribution of mammographic density and its influential factors among Chinese women[J]. Int J Epidemiol, 2014, 43(4): 1240-1251. DOI:10.1093/ije/dyu042 |
| [25] |
Sieh W, Rothstein JH, Klein RJ, et al. Identification of 31 loci for mammographic density phenotypes and their associations with breast cancer risk[J]. Nat Commun, 2020, 11(1): 5116. DOI:10.1038/s41467-020-18883-x |
| [26] |
Moore JX, Han Y, Appleton C, et al. Determinants of mammographic breast density by race among a large screening population[J]. JNCI Cancer Spectr, 2020, 4(2): pkaa010. DOI:10.1093/jncics/pkaa010 |
| [27] |
van der Waal D, den Heeten GJ, Pijnappel RM, et al. Comparing visually assessed BI-RADS breast density and automated volumetric breast density software: A cross-sectional study in a breast cancer screening setting[J]. PLoS One, 2015, 10(9): e0136667. DOI:10.1371/journal.pone.0136667 |
| [28] |
Ko SY, Kim EK, Kim MJ, et al. Mammographic density estimation with automated volumetric breast density measurement[J]. Korean J Radiol, 2014, 15(3): 313-321. DOI:10.3348/kjr.2014.15.3.313 |
| [29] |
Tseng M, Byrne C, Evers KA, et al. Acculturation and breast density in foreign-born, U.S. Chinese women[J]. Cancer Epidemiol Biomarkers Prev, 2006, 15(7): 1301-1305. DOI:10.1158/1055-9965.EPI-06-0159 |
| [30] |
Pike R, Sechopoulos I, Fei B. A minimum spanning forest based classification method for dedicated breast CT images[J]. Med Phys, 2015, 42(11): 6190-6202. DOI:10.1118/1.4931958 |
 2022, Vol. 42
2022, Vol. 42


