2. 河南省肿瘤医院放疗科, 郑州 450008;
3. 清丰县中心医院肿瘤科, 清丰 457300
2. Department of Radiation Oncology, Henan Cancer Hospital, Zhengzhou 450008, China;
3. Department of Oncology, Central Hospital of Qingfeng County, Qingfeng 457300, China
严重急性呼吸系统综合征冠状病毒2(SARS-CoV-2)是一种RNA病毒,自2019年底开始,该病毒所诱发的新型冠状病毒肺炎在全球大流行[1]。新型冠状病毒肺炎的临床表现具有个体差异,临床证据显示,中重型肺炎感染者往往合并急性呼吸窘迫综合征(ARDS),死亡率明显高于轻度肺炎患者[2]。一旦出现ARDS,活化的免疫细胞进入肺循环,诱导产生大量的促炎细胞因子和趋化因子,这些介质启动炎症级联反应,最终导致心脏、肺、肝脏和肾脏等重要器官的快速、广泛损伤[3-4]。糖皮质激素、机械通气和氧疗在重症新型冠状病毒肺炎的治疗中发挥了重要的作用[5]。康复(RECOVERY)协作组证实,在接受有创机械通气或氧疗的新型冠状病毒肺炎患者中,地塞米松可明显改善28 d总生存率,而无需呼吸支持的患者中,糖皮质激素无显著疗效[6]。值得注意的是,地塞米松可能引起抑郁、焦虑、内分泌失调、液体潴留、骨质疏松、骨坏死和真菌感染等不良反应[7]。此外,瑞德西韦和其他潜在抗病毒药物陆续开展了临床试验,结果并不理想[8]。新型抗炎药物的开发是一个耗费时间和巨资的过程,因此,有必要重新考虑一些传统的抗炎疗法。一个世纪以前,低剂量全肺照射曾短暂用于治疗细菌性和病毒性肺炎[9]。现有证据表明,低剂量全肺照射在抑制炎症级联方面发挥作用,这使得其有可能成为治疗新型冠状病毒肺炎的一种策略[10]。目前,已有一些临床试验报告了低剂量全肺照射在新型冠状病毒肺炎患者中的疗效[11-15]。然而,这些研究的结果存在争议。本研究采用Meta分析的方法,针对世界卫生组织(WHO)分型的中重型新冠肺炎患者,评价低剂量全肺照射在改善新型冠状病毒肺炎疗效中是否发挥作用,为后续临床工作提供参考。
资料与方法1.纳入和排除标准:文献纳入研究类型为随机对照试验(RCT),无论是否使用盲法。研究对象为临床确诊且需要住院的中重度新型冠状病毒肺炎患者。干预措施为治疗组采用低剂量全肺照射,对照组采用最佳支持治疗。结局指标为疗效评价,包括临床康复率(指低剂量全肺照射后,临床症状明显缓解,机体功能基本恢复,且连续12 h无需氧疗的患者比例[11])、经口气管插管率、影像学改善率(根据ARDS胸部影像评分量表,对比入院与低剂量全肺照射后胸部CT或X光片,将结果分为改善、稳定或加重[11])和28 d总生存期(指从实施低剂量全肺照射开始28 d内患者存活情况)。排除标准:未接受低剂量全肺照射;无对照组;报告数据缺失,联系作者亦无法取得;数据再次发表;非中文或英文文献。
2.文献检索策略:对2019年12月至2022年5月所有与低剂量全肺照射在新型冠状病毒肺炎中的应用文献进行了全面系统的检索。所使用数据库包括Pubmed、Embase、the Cochrane Library、Web of Science、Google scholar、Scoupus、中国知网、万方数据库、维普数据库。中文检索词包括“放疗”、“照射”、“放射治疗”、“低剂量放疗”、“低剂量照射”、“全肺”、“双肺”、“COVID-19”、“肺炎”、“冠状病毒肺炎”、“SARS-CoV-2”;英文检索词包括“radiotherapy”、“irradiation”、“radiation therapy”、“low dose radiotherapy”、“low dose radiation therapy”、“low dose irradiation”、“whole lung”、“bilateral lung”、“COVID-19 pneumonia”、“COVID pneumonia”、“coronavirus pneumonia”和“SARS-CoV-2 pneumonia”。
3.文献筛选、数据提取和纳入研究质量评价:文献筛选和数据提取由两位评价员独立进行,交叉核对。如果存有分歧,全体人员参与讨论,直到达成最终共识。采用预先制定的表格提取以下基本资料:第一作者、在线发表的年份、研究设计类型、样本量、试验组和对照组、干预后观察到的临床结果。当所纳入文章中数据缺失时,尝试联系通讯作者以获得。
4.纳入研究的偏倚风险评价:采用Cochrane手册针对RCT的偏倚风险评价工具[16],由2名评价员评价纳入研究的偏倚风险。
5.统计学处理:采用Revman 5.3软件进行分析。从纳入的研究中提取OR值,用Mantel-Haenszel方法进行分析。使用Chi-test和I2检验来评估所提取数据的异质性,显著异质性定义为P<0.01或I2≥50%。I2在0~30%之间定义为弱异质性,I2在30%~50%之间定义为中度异质性。当所纳入的研究存在中度或高度异质性时,Meta分析采用随机效应模型;否则,采用固定效应模型。P<0.05为差异有统计学意义。
结果1. 文献检索结果:经过初步检索,共获得202篇文献。经过进一步评估与筛选,最终有5篇临床对照研究纳入本次Meta分析[11-15]。文献筛选流程见图 1。
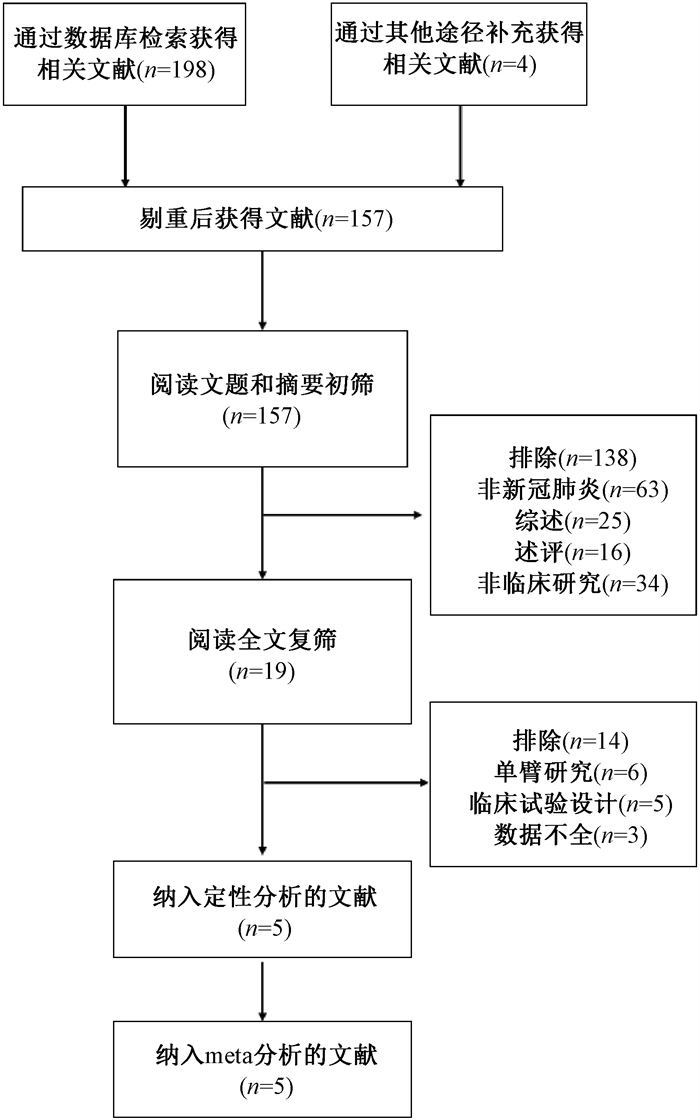
|
注:所检索的数据库及检出文献数如下:Pubmed(n=51)、Embase(n=29)、Cochrane Library(n=3)、Web of Science(n=58)、Google scholar(n=41)、Scoupus(n=1)、CNKI(n=8)、万方数据库(n=5)、维谱数据库(n=2) 图 1 文献筛选流程及结果 Figure 1 Literature screening process and the results |
2. 纳入研究的基本特征与偏倚风险评价结果:纳入的文献中,样本量最少为22例,最多为59例。所有研究都有相对统一的诊断标准。这些临床试验中使用的全肺照射的剂量包括0.5、1.0和1.5 Gy;其中,1.0 Gy是最常用的剂量。纳入研究的基本特征及质量评价见表 1。偏倚风险评价结果见表 2。
|
|
表 1 纳入研究的基本特征 Table 1 General characteristics of included studies |
|
|
表 2 纳入研究的偏倚风险评价结果 Table 2 Assessment of bias risk of the included studies |
3. Meta分析结果
(1) 临床康复率:共有3项研究报告了临床康复情况[11-12, 15]。随机效应模型显示,低剂量全肺照射组与对照组的临床康复率差异不明显(OR=0.48,95%CI:0.08~2.78,P=0.41),见图 2。
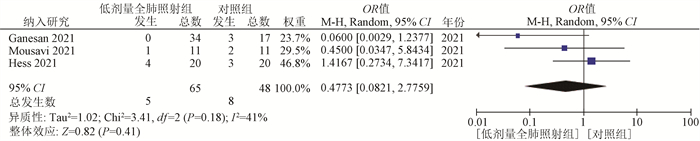
|
图 2 低剂量全肺照射组与支持治疗(对照组)治疗新型冠状病毒肺炎临床康复率比较的Meta分析 Figure 2 Meta-analysis of clinical recovery in the low dose whole lung irradiation group versus the supportive care (control group) for the treatment of COVID-19 pneumonia |
(2) 经口气管插管率:所纳入的5项研究的数据均报告了插管率。随机效应模型分析表明,低剂量全肺照射组与对照组插管率差异无统计学意义(OR=0.73,95%CI:0.29~1.81,P=0.49),见图 3。
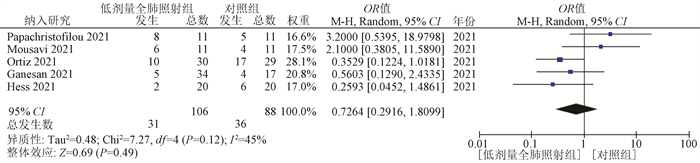
|
图 3 低剂量全肺照射组与支持治疗(对照组)治疗新型冠状病毒肺炎经口气管插管率比较的Meta分析 Figure 3 Meta-analysis of intubation rates in the low dose whole lung irradiation group versus the supportive care (control group) for the treatment of COVID-19 pneumonia |
(3) 28 d总生存率:所纳入的5项研究都包含有28 d总生存期。固定效应模型分析表明,低剂量全肺照射组与对照组相比,差异无统计学意义(OR= 0.56,95%CI:0.28~1.11,P=0.10),见图 4。
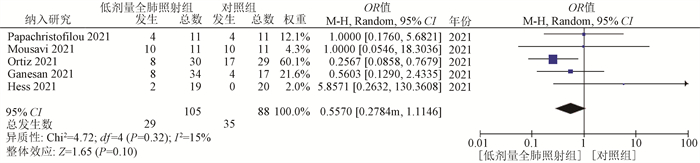
|
图 4 低剂量全肺照射组与支持治疗(对照组)治疗新型冠状病毒肺炎28 d总生存率比较的Meta分析 Figure 4 Meta-analysis of 28 d-overall survival in the low dose whole lung irradiation group versus the supportive care (control group) for the treatment of COVID-19 pneumonia |
(4) 影像学改善率:共有3篇文献描述了低剂量全肺照射后患者的影像学改善率[11-12, 15]。固定效应模型分析表明,低剂量全肺照射组和对照组的影像学改善情况相似,未观察到差异有统计学意义(OR = 0.69,95% CI: 0.24~1.98,P = 0.49),见图 5。

|
图 5 低剂量全肺照射组与支持治疗(对照组)治疗新型冠状病毒肺炎影像学改善率比较的Meta分析 Figure 5 Meta-analysis of radiographic improvement in the low dose whole lung irradiation group versus the supportive care (control group) for the treatment of COVID-19 pneumonia |
(5) 急性不良反应:有2项研究报告了急性不良反应。Hess等[11]报告了1例(10%)程度为一级的恶心反应。Papachristofilou等[13]报道,低剂量全肺照射后66%的患者淋巴细胞计数减少,而对照组10%患者发生淋巴细胞计数减少(t=0.45,P < 0.01)。
讨论本次Meta分析结果表明,低剂量全肺照射后的中重度新型冠状病毒肺炎患者未有临床获益。与支持治疗相比,低剂量全肺照射组患者的临床康复率、影像学改善率、气管插管率和28 d总生存率差异无统计学意义。
新型冠状病毒患者合并ARDS的主要原因是细胞因子风暴。白介素(IL)-1、IL-6和肿瘤坏死因子(TNF)-α等细胞因子升高,可导致包括肺部损伤在内的多器官衰竭[17]。在新型冠状病毒患者的外周血细胞计数中,可观察到淋巴细胞减少[18]。来自动物模型和人体研究表明,低剂量全肺照射可以控制细菌性肺炎[9]。低剂量全肺照射的生物学机制在既往研究中已经得到了阐述。大多数研究集中在全肺照射如何通过诱导巨噬细胞极化来调节炎症级联反应[19]。巨噬细胞的M1极化参与了炎症级联的启动和发展,表现为促炎表型;巨噬细胞M2极化则表现为抗炎表型[20]。Genard等[21]证明,巨噬细胞的极化与剂量有关,低剂量照射(< 1 Gy)可有效诱导巨噬细胞M2极化,而高剂量照射(>1 Gy)则引发巨噬细胞的M1极化。因此,全肺照射所诱发的炎症反应呈现为剂量依赖性。本次Meta分析纳入的研究中,仅Hess等[11]采用1.5 Gy的低剂量全肺照射,另有3项研究实施了1.0 Gy全肺照射[13-15],1项研究给予0.5 Gy全肺照射[12];由于剂量>1.0 Gy照射有利于巨噬细胞群体转变为促炎的M1表型;这可能是未发现患者有获益的原因之一。尽管本次Meta分析可纳入研究有限,无法进一步明确全肺照射的最佳剂量。然而,动物肺炎模型证实,与1.5 Gy相比,1.0 Gy的低剂量全肺照射对于改善肺炎相关症状更为有利[22]。
自2020年开始,低剂量全肺照射被重新考虑用于新型冠状病毒肺炎的治疗。X射线照射通常用于恶性肿瘤的治疗。直线加速器的广泛应用为实施低剂量全肺照射提供了可能。美国埃默里大学医院对10名重症新型冠状病毒肺炎患者实施单次低剂量全肺照射,90%的患者在照射的第1天就出现了氧合和精神状态的快速改善;出院前,血液学和胸部影像学检查均未发现辐射引起的不良反应[23]。来自伊朗的一项研究也证实对双肺进行低剂量照射后,80%的患者在24 h内表现出临床症状改善[24]。然而,后续临床试验对于低剂量全肺照射在中重度新型冠状病毒肺炎中是否有效,尚存有争议。本研究基于现有的证据,通过循证医学手段分析5项对照研究,结果显示,在新型冠状病毒肺炎中应用低剂量全肺照射并无明显获益。值得注意的是,研究纳入样本量少,而且纳入的研究中全肺照射的剂量也不同。因此,对本次Meta分析的结果应谨慎解释。目前,全球有9项临床试验仍在招募新型冠状病毒肺炎患者进行低剂量全肺照射。其中样本量较大的两项研究(NCT04466683和NCT04433949)分别招募100名和150名参与者,这些研究的结果可能为低剂量全肺照射在新型冠状病毒患者中的应用提供更多证据。
值得注意的是,本次Meta分析所纳入研究的样本量小,部分对照组患者由于症状加重而中途退出[11]或采用地塞米松干预[11-13, 15],这些可能是低剂量全肺照射效果不佳原因之一。其次,低剂量全肺照射的最佳时间窗尚不清楚。Mousavi等[15]的研究中,患者在合并临床症状至少1周后才分配至全肺照射组,此时患者已过炎症早期阶段。而在SARS-CoV-2感染的中晚期,细胞因子的持续表达导致广泛的肺损伤[17],这可能削弱了低剂量全肺照射的抗炎效果。据统计,在合并危险因素的中年患者(50~60岁)中,低剂量全肺照射引发第2肿瘤和冠状动脉事件的风险分别可达6%和3%[25]。本次Meta分析所纳入的研究中,近半数患者为中年患者,因此,低剂量全肺照射潜在的不良反应需要进一步随访。此外,尽管一切有助于缓解新型冠状病毒肺炎的措施都值得尝试,但对于低剂量全肺照射来说,其所涉及的伦理问题值得关注。
综上所述,本研究表明,低剂量全肺照射效果有限,并不能改善新型冠状病毒肺炎患者的临床康复率、经口气管插管率、影像学改善率和28 d总生存率。由于纳入的研究样本量相对较小,应谨慎地解释本次Meta分析结果。而且,是否存在一个特定的适合低剂量全肺照射的新型冠状病毒肺炎患者亚组,目前尚无答案。鉴于广泛的疫苗接种计划已被证实在新型冠状病毒的预防和治疗中有效,及其他正在开发的新型疗法、抗病毒药物,低剂量全肺照射的前瞻性研究的边际收益与潜在风险有必要重新评估。
利益冲突 无
作者贡献声明 李俊伟、罗辉负责制定选题、构思、数据搜集整理与撰写;胡永强、李少北、盛成阳负责部分文献的搜集与整理,协助论文撰写
| [1] |
He F, Deng Y, Li W. Coronavirus disease 2019:What we know?[J]. J Med Virol, 2020, 92(7): 719-725. DOI:10.1002/jmv.25766 |
| [2] |
Tang X, Du RH, Wang R, et al. Comparison of hospitalized patients with ARDS caused by COVID-19 and H1N1[J]. Chest, 2020, 158(1): 195-205. DOI:10.1016/j.chest.2020.03.032 |
| [3] |
Hirano T, Murakami M. COVID-19:a new virus, but a familiar receptor and cytokine release syndrome[J]. Immunity, 2020, 52(5): 731-733. DOI:10.1016/j.immuni.2020.04.003 |
| [4] |
杨晨茜, 瞿娇, 刘怡彤, 等. 新型冠状病毒肺炎的免疫失衡及干预策略[J]. 中国药理学通报, 2020, 36(4): 445-453. Yang CX, Qu J, Liu YT, et al. Immune imbalance mechanism and intervention strategy in patients with coronavirus disease 2019 (COVID-19)[J]. Chin Pharmacol Bull, 2020, 36(4): 445-453. DOI:10.3969/j.issn.1001-1978.2020.04.001 |
| [5] |
Pascarella G, Strumia A, Piliego C, et al. COVID-19 diagnosis and management: a comprehensive review[J]. J Intern Med, 2020, 288(2): 192-206. DOI:10.1111/joim.13091 |
| [6] |
Horby P, Lim WS, Emberson JR, et al. Dexamethasone in hospitalized patients with COVID-19[J]. N Engl J Med, 2021, 384(8): 693-704. DOI:10.1056/NEJMoa2021436 |
| [7] |
Polderman JA, Farhang-Razi V, Van Dieren S, et al. Adverse side effects of dexamethasone in surgical patients[J]. Cochrane Database Syst Rev, 2018, 11(11): CD011940. DOI:10.1002/14651858.CD011940.pub3 |
| [8] |
Pan H, Peto R, Henao-Restrepo AM, et al. Repurposed antiviral drugs for COVID-19-interim WHO solidarity trial results[J]. N Engl J Med, 2021, 384(6): 497-511. DOI:10.1056/NEJMoa2023184 |
| [9] |
Calabrese EJ, Dhawan G. How radiotherapy was historically used to treat pneumonia: could it be useful today?[J]. Yale J Biol Med, 2013, 86(4): 555-570. |
| [10] |
罗辉, 葛红, 聂文娜, 等. 低剂量放疗在新型冠状病毒肺炎治疗中的应用[J]. 中华放射医学与防护杂志, 2021, 41(2): 151-154. Luo H, Ge H, Nie WN, et al. Application of low dose radiation therapy in the treatment of COVID-19 pneumonia[J]. Chin J Radiol Med Prot, 2021, 41(2): 151-154. DOI:10.3760/cma.j.issn.0254-5098.2021.02.013 |
| [11] |
Hess CB, Eng TY, Nasti TH, et al. Whole-lung low-dose radiation therapy (LD-RT) for non-intubated oxygen-dependent patients with COVID-19-related pneumonia receiving dexamethasone and/or remdesevir[J]. Radiother Oncol, 2021, 165: 20-31. DOI:10.1016/j.radonc.2021.10.003 |
| [12] |
Ganesan G, Ponniah S, Sundaram V, et al. Whole lung irradiation as a novel treatment for COVID-19:final results of the prospective randomized trial (WINCOVID trial)[J]. Radiother Oncol, 2022, 167: 133-142. DOI:10.1016/j.radonc.2021.12.024 |
| [13] |
Papachristofilou A, Finazzi T, Blum A, et al. Low-dose radiation therapy for severe COVID-19 pneumonia: a randomized double-blind study[J]. Int J Radiat Oncol Biol Phys, 2021, 110(5): 1274-1282. DOI:10.1016/j.ijrobp.2021.02.054 |
| [14] |
Ortiz CS, Hernández D, Trujillo C, et al. The clinical efficacy of low-dose whole-lung irradiation in moderate-to-severe COVID-19 pneumonia: RTMX-20 trial[J]. Radiother Oncol, 2022, 166: 133-136. DOI:10.1016/j.radonc.2021.11.013 |
| [15] |
Mousavi Darzikolaee N, Kolahdouzan K, Abtahi H, et al. Low-dose whole-lung irradiation in severe COVID-19 pneumonia: a controlled clinical trial[J]. J Med Radiat Sci, 2021, 68(4): 396-406. DOI:10.1002/jmrs.542 |
| [16] |
Sterne J, Savović J, Page MJ, et al. RoB 2:a revised tool for assessing risk of bias in randomised trials[J]. BMJ, 2019, 366: l4898. DOI:10.1136/bmj.l4898 |
| [17] |
Li X, Geng M, Peng Y, et al. Molecular immune pathogenesis and diagnosis of COVID-19[J]. J Pharm Anal, 2020, 10(2): 102-108. DOI:10.1016/j.jpha.2020.03.001 |
| [18] |
Gao J, Tian Z, Yang X. Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies[J]. Biosci Trends, 2020, 14(1): 72-73. DOI:10.5582/bst.2020.01047 |
| [19] |
Rödel F, Frey B, Manda K, et al. Immunomodulatory properties and molecular effects in inflammatory diseases of low-dose X-irradiation[J]. Front Oncol, 2012, 2: 120. DOI:10.3389/fonc.2012.00120 |
| [20] |
Li J, Yao ZY, She C, et al. Effects of low-dose X-ray irradiation on activated macrophages and their possible signal pathways[J]. PLoS One, 2017, 12(10): e0185854. DOI:10.1371/journal.pone.0185854 |
| [21] |
Genard G, Lucas S, Michiels C. Reprogramming of tumor-associated macrophages with anticancer therapies: Radiotherapy versus chemo-and immunotherapies[J]. Front Immunol, 2017, 8: 828. DOI:10.3389/fimmu.2017.00828 |
| [22] |
Jackson MR, Stevenson K, Chahal SK, et al. Low-dose lung radiation therapy for COVID-19 lung disease: A preclinical efficacy study in a bleomycin model of pneumonitis[J]. Int J Radiat Oncol Biol Phys, 2022, 112(1): 197-211. DOI:10.1016/j.ijrobp.2021.08.029 |
| [23] |
Hess CB, Nasti TH, Dhere VR, et al. Immunomodulatory low-dose whole-lung radiation for patients with coronavirus disease 2019-related pneumonia[J]. Int J Radiat Oncol Biol Phys, 2021, 109(4): 867-879. DOI:10.1016/j.ijrobp.2020.12.011 |
| [24] |
Ameri A, Rahnama N, Bozorgmehr R, et al. Low-dose whole-lung irradiation for COVID-19 pneumonia: Short course results[J]. Int J Radiat Oncol Biol Phys, 2020, 108(5): 1134-1139. DOI:10.1016/j.ijrobp.2020.07.026 |
| [25] |
Shuryak I, Kachnic LA, Brenner DJ. Lung cancer and heart disease risks associated with low-dose pulmonary radiotherapy to COVID-19 patients with different background risks[J]. Int J Radiat Oncol Biol Phys, 2021, 111(1): 233-239. DOI:10.1016/j.ijrobp.2021.04.018 |
 2022, Vol. 42
2022, Vol. 42
