2. 北京大学第三医院肿瘤放疗科, 北京 100191
2. Department of Radiation Oncology, Peking University Third Hospital, Beijing 100191, China
唾液腺导管癌(salivary duct carcinoma,SDC)是一种侵袭性腺癌,发病率非常低,2/3的患者就诊时为中晚期,治疗以手术及术后放疗为主,但48%的患者18个月内出现以远处转移为主的进展[1],5年无进展生存仅为29%[2-3]。因此,如何降低局部晚期SDC的远处转移率是一项非常严峻的挑战。是否应根据临床分期、高危因素等情况来强化全身治疗方案,值得探讨。目前已证实,人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)在乳腺癌和胃癌中靶向治疗的临床价值[4-5]。而HER-2在SDC中有26%~40% 的阳性率[6],其临床意义尚需进一步探讨。Ki-67抗原与肿瘤的侵袭性相关,与化疗的敏感性亦相关[7],在SDC中尚无相关研究。本研究通过回顾性分析河南省肿瘤医院收治的52例Ⅲ~ⅣA期唾液导管癌患者,探讨Ki-67和HER-2在Ⅲ~ⅣA期SDC不同预后中的临床价值。
资料与方法1. 临床资料:选取2012年1月至2020年12月期间在郑州大学附属肿瘤医院接受手术及术后放疗、有明确组织病理学诊断的初治SDC患者。纳入标准:按照美国癌症联合委员会(American Joint Committee on Cancer, AJCC)第8版分期标准,诊断为Ⅲ~ⅣA期且卡氏评分≥75分;行根治性手术且完成术后放疗的患者。排除标准:仅行局部活检术、肿瘤侵犯颅底无法手术者、淋巴结广泛转移(N3)或全身广泛转移,未行手术或放疗,既往合并其他恶性肿瘤的患者、资料不完整者。共52例患者纳入研究,其中原发于腮腺的34例,颌下腺13例,舌下腺及其他小唾液腺5例。临床及病理资料见表 1。
|
|
表 1 52例Ⅲ~ⅣA期SDC患者临床特征 Table 1 Clinical characteristics of 52 cases of stage Ⅲ-ⅣA SDC |
2.治疗:所有患者均进行原发灶的根治性手术加同侧颈部Ⅱ±Ⅲ~Ⅳ区淋巴结清扫术,T1~2N1的患者行同侧颈部Ⅱ±Ⅲ区淋巴结清扫术,T3~T4A的患者行同侧颈部Ⅱ~Ⅳ区淋巴结清扫术,N2C的患者行双侧颈部Ⅱ~Ⅳ区淋巴结清扫术,原发于颌下腺的切除原发灶并行颈部I区淋巴结清扫。术后标本常规病理检查。采用链霉素抗生物素蛋白-过氧化物酶连接(SP)法行免疫组织化学检测雄激素受体(androgen receptor,AR)、雌激素受体(estrogen receptor,ER)、HER-2蛋白和Ki-67阳性指数,部分患者HER-2蛋白采用双探针荧光原位杂交(fluorescence in situ hybridization, FISH)检测。术后4~6周内进行术后放疗,20例采用三维适形放疗,32例采用适形调强放疗,放疗靶区结合术前影像包含原发灶瘤床及颈部Ⅱ~Ⅳ区范围(其中腮腺靶区上界颧弓,下界下颌骨下缘,前界咬肌前缘,后界颞骨岩部,对侧颈部淋巴结阳性则包含双侧颈部Ⅱ~Ⅳ区),常规分割模式放疗1.8~2.2 Gy/次,放疗剂量50~70 Gy。其中,16例患者进行了术后同步放化疗,化疗方案是多西紫衫醇+顺铂(60~75 mg/m2,每21天为1个周期)11例,顺铂+氟尿嘧啶(顺铂60~75 mg/m2,氟尿嘧啶750 mg/m2每21天为1个周期)2例,曲妥珠单抗靶向治疗3例,平均化疗周期2个(1~3个)。
3. 免疫组织化学分析及结果评价:AR和ER阳性判定为细胞核内出现棕黄色颗粒,≥l%的肿瘤细胞核染色为阳性。HER-2蛋白采用DAKO Hercept Test评分系统评价。阴性(0)无染色或≤10%的浸润癌细胞呈现不完整的、微弱细胞膜染色;(1+)>10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色。可疑阳性(2+)>10%浸润癌细胞呈现弱至中等强度的、完整细胞膜染色或≤10%的浸润癌细胞呈现强而完整的细胞膜染;阳性(3+)>10% 的浸润癌细胞呈强、完整、均匀的细胞膜染色。FISH进行HER-2蛋白阳性的判定根据2019年美国临床肿瘤学会与美国病理医师学会(ASCO/CAP)指南HER-2免疫组织化学评分标准判定。HER-2为红色信号,第17号染色体着丝粒(CEP17)为绿色信号。当HER-2/CEPl7的比值t>2.0或HER-2平均拷贝数>6.0,则为阳性扩增。Ki-67阳性指数指定位于细胞核,细胞核内出现棕黄色颗粒,通过计数至少l 000个肿瘤细胞,测定Ki-67阳性细胞的百分率。
4. 随访:通过门诊、住院、电话等方式进行,在治疗后前2年每3~4个月1次,第3~5年每6个月1次,在5年之后每年1次。每次随访包括专科体检及影像学检查(头颈部MRI/CT、胸部CT、腹部B超)。随访截止日期为2022年5月30日,中位随访时间为37.6(10.7~77.5)个月。主要观察指标:局部区域无复发生存(local-regional recurrence-free survival,LRRFS)、无远处转移生存(distant metastasis-free survival,DMFS)、无进展生存(progression-free survival,PFS)、总生存(overall survival,OS)。其中,无进展生存期指自手术日至肿瘤出现进展或因肿瘤死亡的时间。不良反应评价采用不良事件常用术语评定标准4.0版。
5. 统计学处理: 采用SPSS 26. 0软件进行分析。χ2或Fisher′s精确概率法检验组间比较,Kaplan-Meier法生存分析,Cox模型多因素预后分析。P < 0.05为差异有统计学意义。
结果1. 总体疗效:至随访结束,有8例(15.4%)局部区域复发,15例(28.8%)远处转移,9例(17.3%)局部复发伴远处转移,其中肺转移19例(86.3%),其次是骨、肾上腺转移。1年LRRFS、DMFS、PFS、OS率分别为86.5%、73.1%、65.4%和98.1%,2年LRRFS、DMFS、PFS、OS率分别为67.3%、55.8%、46.2%和82.7%,可纳入的3年LRRFS、DMFS、PFS、OS率分别为42.9%、39%、33.3%和56.4%。总生存曲线见图 1。
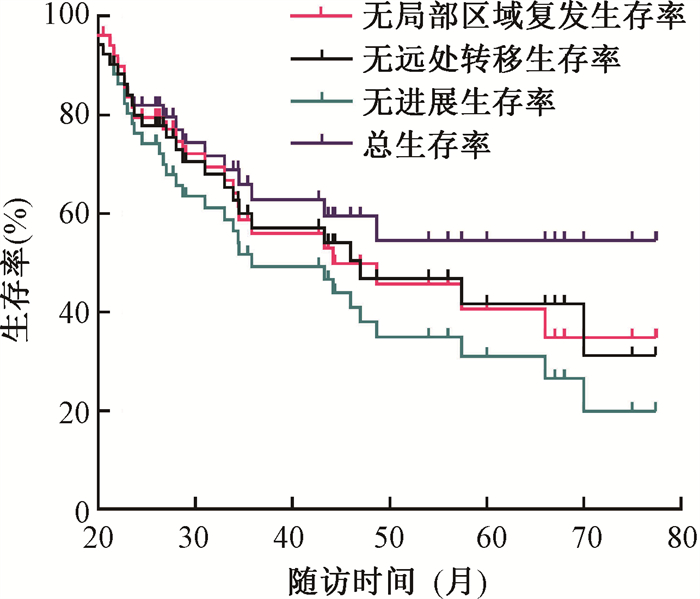
|
图 1 52例Ⅲ~ⅣA期SDC患者术后放疗的生存曲线 Figure 1 Survival curve of 52 cases with Ⅲ-ⅣA SDC after postoperative radiotherapy |
2. 各因素在不同生存分层中的结果:结果列于表 2。肿瘤发生的部位、性别、N分期、神经侵犯、治疗模式、AR和ER的表达水平与Ⅲ~ⅣA期SDC的预后无关(P>0.05);年龄≥65岁的患者在3年OS中差异有统计学意义(χ2= 5.37,P < 0.05);T分期在3年PFS中差异有统计学意义(χ2=9.29, P < 0.05);TNM分期在2年DMFS、3年PFS和OS中差异均有统计学意义(χ2=7.10、9.75、5.28,P < 0.05);放疗剂量在2年LRRFS中差异有统计学意义(χ2=4.44,P < 0.05),说明放疗剂量≥60 Gy在LRRFS方面更有优势;Ki-67阳性指数在2年LRRFS、2年PFS和3年OS中差异均有统计学意义(χ2=10.09、13.94、12.26,P < 0.05);HER-2蛋白在1年LRRFS、2年DMFS和PFS中差异有统计学意义(χ2=6.57、6.99、7.08,P < 0.05)。
|
|
表 2 主要因素在52例Ⅲ~ⅣA期SDC患者不同生存中的结果 Table 2 The important factors in different survival of 52 patients with stage Ⅲ-ⅣA SDC |
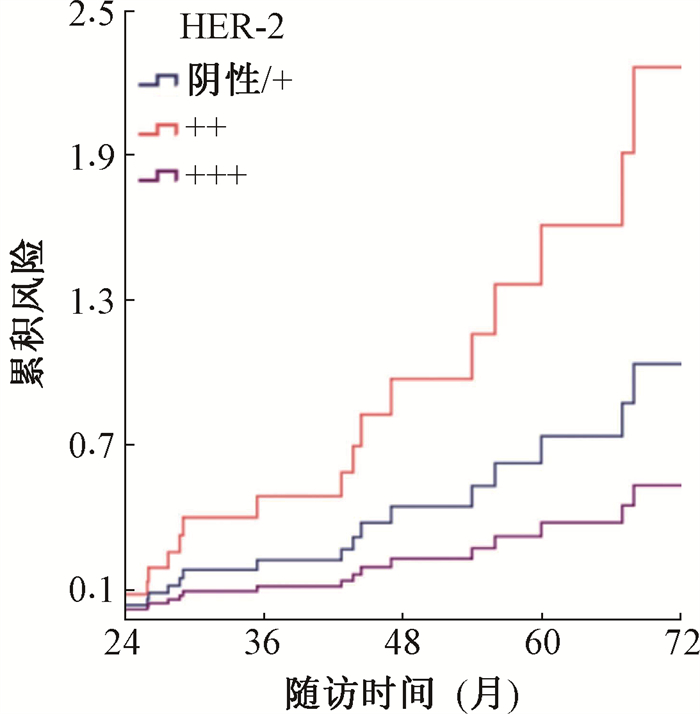
3. Cox多因素预后分析结果:将年龄、T分期、TNM分期、脉管癌栓、放疗剂量、Ki-67阳性指数和HER-2蛋白纳入Cox回归分析,结果列于表 3。由表 3可知,年龄、Ki-67阳性指数和HER-2蛋白是独立的预后不良因素(t=5.16、9.84、8.23,P < 0.05)。从累积风险图 2和图 3中可以看出Ki-67≥60% 和HER-2(3+)风险更高,且Ki-67≥ 60%风险最高。
|
|
表 3 52例Ⅲ~ⅣA期SDC患者预后的多因素分析 Table 3 Multivariate analysis of 52 cases of stage Ⅲ-ⅣA SDC prognosis |

|
图 2 不同Ki-67阳性指数在预后中的累积风险 Figure 2 Cumulative risk of different Ki-67 positive indexes in prognosis |
|
图 3 不同HER-2表达水平在预后中的累积风险 Figure 3 Cumulative risk of different HER-2 expression levels in prognosis |
4. 治疗失败后再次治疗情况及主要不良反应:32例治疗失败的患者中5例放弃治疗,6例行二次手术及化疗,9例行姑息性放疗及化疗,8例仅行化疗,2例行化疗联合曲妥珠单抗治疗,2例仅曲妥珠单抗靶向治疗,化疗主要是多西紫衫醇联合顺铂方案。术后出现面神经损伤的28例(53.8%);放疗后出现中度口干的20例(38.4%);化疗后出现Ⅲ~Ⅳ级血液学不良反应的仅有2例(12.5%)。
讨论本研究中Ⅲ~ⅣA期SDC患者1年、2年PFS率相比OS率明显较低,表明局晚期SDC标准治疗后失败率非常高,也说明这部分患者的治疗强度不足。1年、2年DMFS均低于LRRFS,表明局晚期SDC远处转移风险高于局部复发风险。Kusafuka等[8]和Otsuka等[9]报道的3年PFS率分别是38.2%和48.5%,主要的治疗失败也是远处转移。因此,强化唾液腺导管癌患者的全身治疗迫在眉睫。
肿瘤的TNM分期大多与预后是相关的。日本的一项研究报道Ⅳ期和阳性淋巴结≥10个是SDC独立的预后不良因素[8]。但本研究中TNM分期在组间比较显示与预后有关,多因素分析中与预后没有相关性,可能与入组的病例仅为Ⅲ~ⅣA期有关,组间差异不够有关。神经受累和脉管癌栓亦未发现与预后有关,上述因素在术后放疗加入标准治疗前是预后不良因素[10-11],但是随着手术及术后放疗的进行,目前多数的回顾性分析中也未见有与预后相关的报道[12]。
SDC在组织学上相似于乳腺的浸润性导管癌,已证实Ki-67在乳腺癌的诊治与预后判断等方面具有重要的临床参考价值[13]。目前,Ki-67在SDC中没有统一的判定标准,有国内和国外的研究以Ki-67阳性指数30%或40%为界[14],分析其与预后无关。本研究以Ki-67阳性指数60%和30%为界分为高、中和低表达3组,高表达组(Ki-67≥60%)在无远处转移生存和无进展生存方面明显更差,分析显示高表达的Ki-67是Ⅲ~ⅣA期SDC的独立预后不良因素。那么对于Ki-67高表达的局晚期SDC患者是否常规进行全身化疗呢?现阶段大多数的化疗药物都是作用在DNA复制环节或以细胞周期调节基因为目标靶点[15]。而Ki-67不仅能维持DNA结构的功能,还与细胞周期调节基因及其产物有关[9]。因此,理论上Ki-67高增值指数的肿瘤进行化疗是有效的。韦晓霞等[16]研究认为高Ki-67阳性指数的浸润性乳腺癌患者对新辅助化疗更为敏感。所以,本研究认为对于Ki-67高表达的局晚期SDC患者可以考虑常规使用化疗药物。
AR目前证实在SDC中呈高表达状态,AR阳性的患者预后较好[17]。现阶段开展的关于阻断AR的相关临床研究,尚无该项治疗有效的一致性研究报告[18]。本研究中AR阳性率高达84.6%,但与预后无相关性。有研究发现,EZH2和H3K27 me3高表达可能是AR靶向治疗疗效不佳的因素[19]。同时SDC的患者男性居多可能也是该治疗受限的原因。因此,SDC的患者是否进行AR的靶向治疗证据不足,尚存在争议。
HER-2是重要的原癌基因之一,在调控细胞的生长、凋亡和分化中发挥至关重要的作用[4-5]。本研究中HER-2(3+)的表达率40.4%,与Son等[6]报道的20%~46%相符。HER-2的表达与局部区域无复发生存、无远处转移生存和无进展生存有关,多因素分析显示HER-2(3+)的患者预后更差,是SDC的独立预后因素。之前的部分临床研究曲妥珠单抗或拉帕他尼进行HER-2靶向治疗的临床试验中未能显示出显著的临床疗效[20],分析原因可能与入组的只有部分患者的HER-2阳性表达有关。近年研究表明,新的HER-2靶向药物恩美曲妥珠单抗以及曲妥珠单抗和帕妥珠单抗的组合在HER-2阳性的SDC患者中,治疗反应率达到90%和60%[21-22]。本研究中共有3例HER-2(3+)的患者术后放疗后使用曲妥珠单抗进行巩固治疗,目前2例均处于无进展生存状态。因此,SDC是否使用HER-2靶向治疗,需要结合HER-2表达水平。
综上所述,Ⅲ~ⅣA期唾液腺导管癌仅进行根治性手术及术后放射治疗的远处转移率较高,Ki-67阳性指数和HER-2阳性是其独立的预后不良因素。
利益冲突 无本研究未因进行该研究接受任何不正当的职务或财务利益, 在此对研究的独立性和科学性予以保证
作者贡献声明 卢晓旭和吴慧负责数据整理和论文撰写;王俊杰负责指导论文总体规划修改;孙学明和黄蓉负责数据采集
| [1] |
Walvekar RR, Filho PAA, Seethala RR, et al. Clinicopathologic features as stronger prognostic factors than histology or grade in risk stratification of primary parotid malignancies[J]. Head Neck, 2011, 33(2): 225-231. DOI:10.1002/hed.21433 |
| [2] |
Roh JL, Lee JI, Choi SH, et al. Prognostic factors and oncologic outcomes of 56 salivary duct carcinoma patients in a single institution: high rate of systemic failure warrants targeted therapy[J]. Oral Oncol, 2014, 50(11): e64-e66. DOI:10.1016/j.oraloncology.2014.08.010 |
| [3] |
Jayaprakash V, Merzianu M, Warren GW, et al. Survival rates and prognostic factors for infiltrating salivary duct carcinoma: Analysis of 228 cases from the Surveillance, Epidemiology, and End Results database[J]. Head Neck, 2014, 36(5): 694-701. DOI:10.1002/hed.23350 |
| [4] |
黄灵潇, 姚文秀. Her-2基因与乳腺癌靶向治疗[J]. 国际肿瘤学杂志, 2014, 41(10): 760-763. Huang LX, Yao WX. Her-2 gene and breast cancer targeted therapy[J]. J Int Oncol, 2014, 41(10): 760-763. DOI:10.3760/cma.j.issn.1673-422X.2014.10.013 |
| [5] |
彭湃, 易善永, 赵玲. HER-2阴性胃癌的分子靶向治疗[J]. 国际肿瘤学杂志, 2016, 43(12): 943-946. Peng P, Yi SY, Zhao L. Molecular targeted therapy for HER-2 negative gastric cancer[J]. J Int Oncol, 2016, 43(12): 943-946. DOI:10.3760/cma.j.issn.1673-422X.2016.12.016 |
| [6] |
Son E, Panwar A, Mosher CH, et al. Cancers of the major salivary gland[J]. J Oncol Pract, 2018, 14(2): 99-108. DOI:10.1200/JOP.2017.026856 |
| [7] |
Menon SS, Guruvayoorappan C, Sakthivel KM, et al. Ki-67 protein as a tumour proliferation marker[J]. Clin Chim Acta, 2019, 491: 39-45. DOI:10.1016/j.cca.2019.01.011 |
| [8] |
Kusafuka K, Sato Y, Nakatani E, et al. The implicated clinical factors for outcomes in 304 patients with salivary duct carcinoma: Multi-institutional retrospective analysis in Japan[J]. Head Neck, 2022, 44(6): 1430-1441. DOI:10.1002/hed.27034 |
| [9] |
Otsuka K, Imanishi Y, Tada Y, et al. Clinical outcomes and prognostic factors for salivary duct carcinoma: A multi-institutional analysis of 141 patients[J]. Ann Surg Oncol, 2016, 23(6): 2038-2045. DOI:10.1245/s10434-015-5082-2 |
| [10] |
Johnston ML, Huang SH, Waldron JN, et al. Salivary duct carcinoma: treatment, outcomes, and patterns of failure[J]. Head Neck, 2016, 38(Suppl 1): E820-E826. DOI:10.1002/hed.24107 |
| [11] |
Maxwell JH, Ferris RL, Gooding W, et al. Extracapsular spread in head and neck carcinoma: impact of site and human papillomavirus status[J]. Cancer, 2013, 119(18): 3302-3308. DOI:10.1002/cncr.28169 |
| [12] |
Giridhar P, Venkatesulu BP, Yoo R, et al. Demography, patterns of care, and survival outcomes in patients with salivary duct carcinoma: an individual patient data analysis of 857 patients[J]. Future Sci OA, 2022, 8(4): FSO791. DOI:10.2144/fsoa-2021-0052 |
| [13] |
刘月平. 国际乳腺癌Ki-67工作组Ki-67评估更新的主要内容解读[J]. 中华病理学杂志, 2021, 50(7): 704-709. Liu YP. Interpretation of Ki-67 assessment update of international Ki-67 in breast cancer working group[J]. Chin J Pathol, 2021, 50(7): 704-709. DOI:10.3760/cma.j.cn112151-20210303-00179 |
| [14] |
赵芳, 宋琛, 卫拴昱, 等. 涎腺导管癌AR、HER-2和Ki-67蛋白的表达及分子分型[J]. 山西医科大学学报, 2020, 51(1): 26-32. Zhao F, Song C, Wei SY, et al. Molecular classification and expression of AR, HER-2 and Ki-67 proteins in salivary duct carcinoma[J]. J Shanxi Med Univers, 2020, 51(1): 26-32. DOI:10.13753/j.issn.1007-6611.2020.01.005 |
| [15] |
Chen X, He C, Han D, et al. The predictive value of Ki-67 before neoadjuvant chemotherapy for breast cancer: a systematic review and meta-analysis[J]. Future Oncol, 2017, 13(9): 843-857. DOI:10.2217/fon-2016-0420 |
| [16] |
韦晓霞, 张锐, 蒲天婕, 等. Ki-67对浸润性乳腺癌患者新辅助化疗疗效的预测作用分析[J]. 中华病理学杂志, 2017, 46(12): 817-821. Wei XX, Zhang R, Pu TJ, et al. Ki-67 expression and its effect on response to neo-adjuvant chemotherapy in invasive breast cancer[J]. Chin J Pathol, 2017, 46(12): 817-821. DOI:10.3760/cma.j.issn.0529-5807.2017.12.001 |
| [17] |
Williams L, Thompson LD, Seethala RR, et al. Salivary duct carcinoma: the predominance of apocrine morphology, prevalence of histologic variants, and androgen receptor expression[J]. Am J Surg Pathol, 2015, 39(5): 705-713. DOI:10.1097/PAS.0000000000000413 |
| [18] |
Udager AM, Chiosea SI. Salivary duct carcinoma: An update on morphologic mimics and diagnostic use of androgen receptor immunohistochemistry[J]. Head Neck Pathol, 2017, 11(3): 288-294. DOI:10.1007/s12105-017-0798-x |
| [19] |
Saigusa N, Hirai H, Tada Y, et al. The role of the EZH2 and H3K27me3 expression as a predictor of clinical outcomes in salivary duct carcinoma patients: A large-series study with emphasis on the relevance to the combined androgen blockade and HER2-targeted therapy[J]. Front Oncol, 2021, 11: 779882. DOI:10.3389/fonc.2021.779882 |
| [20] |
Agulnik M, Cohen EW, Cohen RB, et al. Phase Ⅱ study of lapatinib in recurrent or metastatic epidermal growth factor receptor and/or erbB2 expressing adenoid cystic carcinoma and non adenoid cystic carcinoma malignant tumors of the salivary glands[J]. J Clin Oncol, 2007, 25(25): 3978-3984. DOI:10.1200/JCO.2007.11.8612 |
| [21] |
Li BT, Shen R, Offin M, et al. Ado trastuzumab emtansine in patients with HER2 amplified salivary gland cancers (SGCS): results from a phase Ⅱ basket trial[J]. J Clin Oncol, 2019, 37(15suppl): 6001-1. DOI:10.1200/jco.2019.37.15_suppl.6001 |
| [22] |
Kurzrock R, Bowles DW, Kang H, et al. Targeted therapy for advanced salivary gland carcinoma based on molecular profiling: results from MyPathway, a phase ⅡA multiple basket study[J]. Ann Oncol, 2020, 31(3): 412-421. DOI:10.1016/j.annonc.2019.11.018 |
 2022, Vol. 42
2022, Vol. 42


