2. 郑州大学实验动物中心, 郑州 450003
2. Experimental Animal Center of Zhengzhou University, Zhengzhou 450003, China
放射性肺损伤是胸部放射治疗最常见的并发症之一,其病理表现包括前期炎症反应和后期的放射性纤维化,最终因呼吸衰竭而导致死亡。如何预防或降低放射肺纤维化的发生,是目前迫切需要解决的问题[1-2]。研究发现,肺Ⅱ型上皮细胞通过异分化为间质样细胞参与肺纤维化的形成。其中,人肺表面活性物质相关蛋白C(prosurfactant protein C,proSP-C)仅特异表达于Ⅱ型肺上皮细胞表面,故而作为Ⅱ型肺泡细胞特异性标志物[3];此外,Ⅰ型肺泡上皮细胞标志物同源结构域蛋白X (homeodomain only protein X,HOPX) 在纤维化肺病中的肺泡损伤与修复中也扮演着重要的角色[4]。在肺纤维化的早期肺泡损伤和修复过程中HOPX表达上调,但在中后期,由于损伤的肺泡未能被再生修复,故HOPX在肺纤维化中的表达水平持续降低,从而导致肺再生过程失败[5]。因此,HOPX也可能是肺纤维化进展变化中的潜在指标[6]。此外,E-钙黏蛋白(E-cadherin)是典型的上皮细胞的标记物,其表达水平直接反应上皮结构的整体状态。而波形蛋白(vimentin) 作为一种Ⅲ型中间丝蛋白,是上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)的细胞标志物。转化生长因子β1(transforming growth factor β1,TGF-β1)和β-连环蛋白(β-catenin)与诱导肺纤维化的发生密切相关[7-9]。研究证实,正常的肺组织经过辐射损伤后,肺泡内出现明显充血水肿,通过免疫调节和血管内皮细胞分泌IL-6、lin28、vimentin、TGF-β1因子以及激活GSK-3β/β-catenin和Wnt/β-catenin信号通路等过程促进肺损伤的病理进程,诱导成纤维细胞增生并合成基质蛋白,进而发展为肺间质纤维化[10-13]。既往研究发现,当生物组织接受0.5 Gy以下的低剂量电离辐射时可诱导正常组织产生适应性保护作用,进而对后续的治疗剂量的辐射产生耐受[14-15]。基于此,该实验复制放射性肺损伤小鼠模型,探索低剂量预照射对治疗剂量的辐射的适应性作用及其潜在机制,为临床的治疗提供可靠的实验依据。
材料与方法1. 实验动物及分组:320只5周龄C57BL/6j雌性小鼠[北京维通利华实验动物技术有限公司,动物饲养许可证号:SCXK(京)2021-0011],适应性饲养1周,用随机数表法,将其分为对照组(0 Gy)、低剂量组(0.5 Gy)、高剂量组(20 Gy)和低剂量预照射组(0.5 Gy+20 Gy),每组80只。该动物实验伦理由河南省实验动物中心医学伦理委员会审核通过(伦理号:ZZU-LAC2021060412)。
2. 照射流程:将6周龄低剂量组和低剂量预照射组的小鼠于充分清醒的状态下放入固定装置中进行全身0.5 Gy的低剂量X射线照射(河南省人民医院放疗科,美国Sun Nuclear公司,型号:5932XM,能量6 MV,剂量率0.0083 cGy/min,时间60 min,源皮距0.5 m)。照射后继续饲养,自由获取食物和水。2周后将高剂量组和低剂量预照射组的小鼠通过腹膜内注射50 mg/kg的1%戊巴比妥钠麻醉后,胸腹部朝上,身体充分伸展,然后仅胸部接受单剂量20 Gy的X射线照射(河南省人民医院放疗科,美国Sun Nuclear公司,型号:6632XM,能量6 MV,剂量率100 cGy/min,时间20 min,源皮距0.5 m,图 1)。而8周龄的对照组小鼠则进行模拟照射(0 Gy)。

|
注:小鼠麻醉后固定于木板上, 光带投射部位为照射区域 图 1 C57BL/6j雌性小鼠胸部X射线照射图 Figure 1 Picture of C57BL/6j female mice with chests irradiated with X-rays |
3.照射后小鼠的观察及标本的采集与处理:照射后每周记录小鼠体重和观察生理行为,以及记录意外死亡的小鼠。同时在照射后按设计的时间点(24 h、1个月、3个月和5个月)处理照射组和对照组小鼠,每个时间点处理小鼠20只/组。取小鼠肺组织,左肺组织固定在4%多聚甲醛用于制作蜡块,用于组织学染色研究。而右肺即刻液氮冰冻后放入-80℃冰箱保存,用于分子生物学研究分析。
4. HE和Masson三色染色:组织切片按照HE染色试剂盒和Masson染色试剂盒(均为北京索莱宝科技有限公司)说明书染色,光学显微镜(日本电子光学公司,6745-AF516C)下观察和扫描小鼠肺部不同时间点的病理学变化,其中Masson三色染色中胶原蛋白被染成蓝色。
5. RT-qPCR:利用TRIzol法并按照试剂盒(美国Invitrogen公司)说明书提取肺组织的总RNA,使用微量分光光度计(上海尤尼柯仪器有限公司)在A260/A280处测量RNA含量,再用反转录试剂盒(上海近岸科技有限公司)将mRNA反转录为cDNA。最后,使用NovoStart SYBR qPCR SuperMix Plus (Novoprotein)试剂盒(上海近岸科技有限公司)进行RT-qPCR测定目的基因的表达水平,数据用2-ΔΔCt法进行分析。引物序列详见表 1。
|
|
表 1 实时定量PCR引物序列 Table 1 Primer sequences used for Real-time quantitative PCR assay |
6. Western blot半定量: 将小鼠肺组织加入细胞裂解液提取总蛋白,采用蛋白质定量检测(BCA)试剂盒(郑州信诺斯生物科技有限公司)检测各组样品蛋白浓度。将等量各组蛋白样品上样至十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶(郑州信诺斯生物科技有限公司),进行电泳分离,然后通过电转移到预激活的聚偏二氟乙烯(PVDF)膜(美国Millipore公司)。将膜分别与一抗anti-proSP-C、anti-HOPX、anti-E-cadherin、anti-β-catenin、anti-vimentin抗体(美国Abcam公司)在4℃条件下孵育过夜。复温1 h后,等渗缓冲盐溶液(郑州润研商贸有限公司)清洗3次,加二抗(美国Abcam公司)室温孵育120 min,清洗,使用增强型化学发光试剂盒(上海优宁维生物科技股份有限公司)在UVItec ALLIANCE 4.7凝胶成像系统扫描蛋白条带,并对蛋白条带进行灰度值分析计算。以β-肌动蛋白作为参照物,各目标蛋白灰度值与β-肌动蛋白灰度值比值代表蛋白相对表达水平。
7.统计学处理:所有数据使用GraphPad Prism 8.4.3软件进行处理。符合正态分布的计量资料以x±s表示。两组之间比较采用独立样本t检验。P<0.05为差异有统计学意义。
结果1.HE染色结果:对照组的HE染色显示肺组织中肺泡充盈适度,肺泡毛细血管结构清晰,肺泡壁无塌陷及破裂,且未见红细胞渗出和纤维化病灶(图 2)。低剂量组除有轻微炎症反应外,与对照组相比无明显改变。高剂量组在照射后各个时间点小鼠均出现肺泡内出血,透明膜及上皮细胞增生, 肺泡间隔增厚,肺泡壁中Ⅱ型上皮细胞显著增多,可见巨噬细胞吞噬颗粒等早期放射性肺炎的病理改变,随着照射后时间的递增,病理改变越为明显,尤其是照射后3个月部分小鼠可出现局部纤维病变,照射后5个月几乎所有小鼠肺内出现广泛纤维化(图 2)。然而,与高剂量组相比,低剂量预照射组各个时间点的小鼠肺组织炎性细胞浸润和肺泡结构损伤均有不同程度的减轻,仅个别小鼠可在照射后5个月肺周边出现小范围纤维化病变(图 2)。这表明低剂量预照射可诱导正常肺细胞对高剂量X射线一定程度的耐受性。
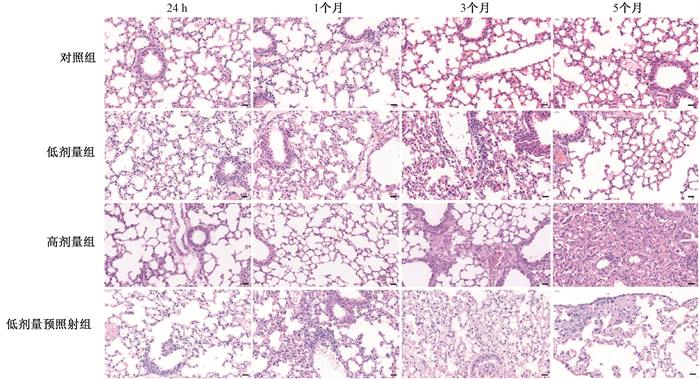
|
图 2 各组小鼠照射后,不同时间点肺组织病理变化HE ×400 Figure 2 Histopathological images of mice lung tissues at different time points after irradiation HE ×400 |
2. Masson三色染色结果:与对照组相比,高剂量组照射后1个月气管旁胶原蛋白堆积明显增多,照射后3个月肺内出现局灶纤维化,5个月后肺内则出现广泛纤维化;而低剂量预照射组,与高剂量组比较,照射后不同时间段肺内胶原蛋白堆积明显减少(图 3)。
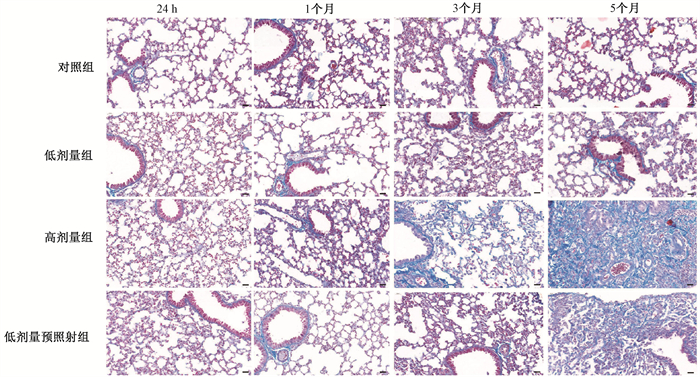
|
图 3 各组小鼠照射后,不同时间点肺组织中胶原蛋白分布Masson ×400 Figure 3 The distribution of collagen in mice lung tissues at different time points after irradiation Masson ×400 |
3. 小鼠肺组织中proSP-C、HOPX、E-cadherin、vimentin、TGF-β1和β-catenin mRNA的表达水平:早期(24 h)的低剂量组、高剂量组以及低剂量预照射组proSP-C相比对照组均有不同程度地上调(t=3.40、13.73、7.87,P<0.05)。高剂量组的proSP-C随照射后时间增加而逐渐减少,而低剂量预照射组proSP-C呈波动改变,在照射后3个月达最高峰。与高剂量组不同,照射后5个月时,低剂量预照射组proSP-C高于对照组,差异有统计学意义(t=3.92,P<0.05)。与对照组相比,在照射24 h的HOPX, 低剂量组、高剂量组以及低剂量预照射组的HOPX均被上调(t=11.72、0.45、4.95,P<0.05)。从24 h到3个月,低剂量组和低剂量预照射组HOPX均高于对照组,差异有统计学意义(t=3.75~11.72,P<0.05)。已知TGF-β1、β-catenin和vimentin为上皮间质转化指标,也是纤维化的标记物。在照射后5个月,高剂量组TGF-β1表达水平达到顶峰,分别为对照组、低剂量组和低剂量预照射组的13.6、10.7和5.8倍。照射后5个月时,低剂量预照射组与对照组相比被上调,差异有统计学意义(t=4.31,P<0.05),见表 2。
|
|
表 2 小鼠照射后不同时间肺纤维化相关因子mRNA表达水平(x±s) Table 2 Expression levels of mRNA in the lungs of mice at different time points after irradiation(x±s) |
4. 小鼠肺组织中proSP-C、HOPX、E-cadherin、vimentin和β-catenin蛋白的表达变化:高剂量组的proSP-C水平随照射后时间增加而逐渐降低,与其RT-qPCR结果相一致。在照射3个月和5个月时的低剂量预照射组proSP-C与对照组相比,差异有统计学意义(t=13.47、13.73,P<0.05)。在照射后24 h和1个月的低剂量预照射组vimentin蛋白水平高于高剂量组看,差异有统计学意义(t=6.54、4.28,P < 0.05)。此外,在照射后5个月,高剂量组β-catenin高于低剂量预照射组,差异有统计学意义(t=5.11,P < 0.05),见图 4和表 3。
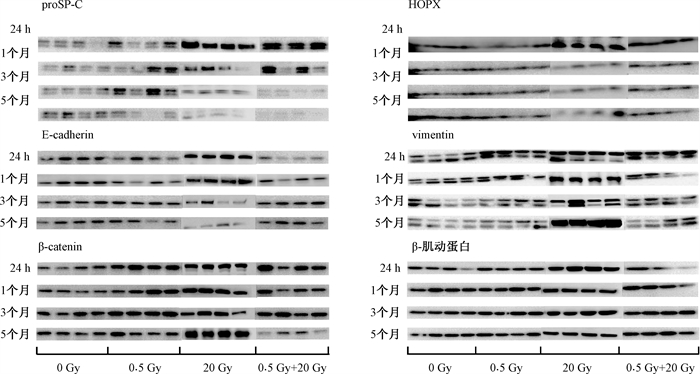
|
图 4 各组小鼠在受照后不同时间肺纤维化相关因子蛋白条带图 Figure 4 Pulmonary fibrosis-associated factor protein stripes in various groups of mice at different time points after irradiation |
|
|
表 3 小鼠照射后不同时间肺纤维化相关因子蛋白表达水平(x±s) Table 3 Expression levels of proteins in the lungs of mice at different time points after irradiation(x±s) |
讨论
放射性肺损伤是指生物接受放射时,靶组织附近的正常组织由于累积的放射剂量高于生物效应阈值而受到不同程度的损伤,这种损伤是由多种细胞介导并释放炎症相关因子,并且由免疫机制协同调控的复杂的病理过程[16]。而上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)是上皮细胞被特定生长因子激活后,上皮细胞失去极性,细胞连接紧密性下降,迁移能力增强,随之而来的是细胞表型发生变化,转化为具有间质表型细胞的生物学过程,在损伤部位愈合及多种器官纤维化中起着关键性作用[17-18]。
研究发现,与高剂量辐射相比,组织或细胞对低剂量辐射的反应有着本质上的区别。Zhang等[19]研究发现,低剂量预照射可调控炎性因子的表达,而降低糖尿病诱导的心脏炎症和相关病理变化。因此,低剂量辐射可能成为预防糖尿病心血管并发症的新方法。此外,诸多研究显示,当生物组织接受0.5 Gy以下的低剂量电离辐射时可激活生物防御系统,包括抗氧化和免疫功能,进而诱导正常组织产生适应性保护作用,这可能是预防或减轻放射性损伤的有效方法[14, 20]。基于此,本研究观察0.5 Gy预照射是否可以保护C57BL/6j雌性小鼠正常肺组织免受20 Gy X射线导致的放射性肺损伤,以及肺纤维化相关因子表达情况。
该形态学方面研究显示,高剂量组在照射1个月后细支气管旁胶原蛋白堆积明显增多,照射后3个月肺内出现局部纤维化,至5个月时肺内出现广泛纤维化。而低剂量预照射组的肺组织在照射后各个时间点的病理变化都不及高剂量组严重。表明0.5 Gy低剂量预照射后在一定程度上减轻20 Gy高剂量X射线对肺的损伤作用,这可能与肺组织被低剂量辐射诱导产生适应性保护作用有关。在分子生物学层面,早期(24 h)的照射组proSP-C mRNA水平均比对照组高,提示射线有激活Ⅱ型肺上皮干细胞的作用。此外,由于vimentin上调为肺泡上皮细胞的损伤和重塑所必需,且损伤后期vimentin主要参与纤维化形成[21],在照射后早期(24 h和1个月),低剂量预照射组vimentin蛋白水平显著高于高剂量组, 提示预照射有升高vimentin表达的作用, 可能是增强肺泡上皮细胞损伤早期修复能力。TGF-β1 mRNA检测结果显示在照射后5个月,高剂量组TGF-β1 mRNA水平比低剂量组高出10.7倍,提示TGF-β1对射线较敏感,也显示低剂量预照射似乎可以抵消高剂量射线对TGF-β1的诱导作用。β-catenin mRNA和蛋白结果也印证了相似作用。这与先前的肺纤维化预防研究结果相一致,即TGF-β1可通过Wnt/β-catenin诱发促纤维化分子产生,其结果导致Ⅱ型肺上皮细胞异分化为间质细胞[18-19]。这与先前低剂量预照射可有效抑制小鼠肝脏纤维化和糖尿病诱导的心脏炎症和心脏损伤的病理进展基本一致[14, 19]。
综上所述,可推测低剂量预照射组肺组织损伤程度低于高剂量组的原因可能是由于低剂量预照射给予正常肺组织抵御随后高剂量照射的能力,该能力可能是通过减低EMT相关因子表达,减少肺Ⅱ型上皮干细胞的异分化而达到预防或减轻放射性肺损伤的作用。本研究创新性探索了低剂量预照射有减轻高剂量辐射导致肺损伤的作用,其结果可为临床预防肺纤维化提供新的思路,但放射性肺损伤的防护机制是体内外多种理化及生物因素作用下的复杂过程,有关更深入的调控机制尚待进一步研究。
利益冲突 本研究未因进行该研究接受任何不正当的职务或财务利益,再此对研究的独立性和科学性予以保证。本文全体作者声明不存在任何利益冲突
作者贡献声明 赵文迪负责动物照射、实验及论文撰写;田健负责课题实施、论文修改;轩丹丹、张秀丽、李春梅参与实验操作,收集数据;周建炜指导论文修改
| [1] |
Hanania AN, Mainwaring W, Ghebre YT, et al. Radiation-induced lung injury: assessment and management[J]. Chest, 2019, 156(1): 150-162. DOI:10.1016/j.chest.2019.03.033 |
| [2] |
Xia C, Shi W, Zhang Y, et al. Prevention and treatment of radiation-induced lung injury[J]. Future Med Chem, 2020, 12(23): 2161-2173. DOI:10.4155/fmc-2019-0162 |
| [3] |
Zhang QM, Ouyang WX, Chai XQ, et al. Expression of lung surfactant proteins SP-B and SP-C and their regulatory factors in fetal lung of GDM rats[J]. Curr Med Sci, 2018, 38(5): 847-852. DOI:10.1007/s11596-018-1952-8 |
| [4] |
Ota C, Ng-Blichfeldt JP, Korfei M, et al. Dynamic expression of HOPX in alveolar epithelial cells reflects injury and repair during the progression of pulmonary fibrosis[J]. Sci Rep, 2018, 8(1): 12983. DOI:10.1038/s41598-018-31214-x |
| [5] |
Alsafadi HN, Staab-Weijnitz CA, Lehmann M, et al. An ex vivo model to induce early fibrosis-like changes in human precision-cut lung slices[J]. Am J Physiol Lung Cel Mol Physiol, 2017, 312(6): L896-L902. DOI:10.1152/ajplung.00084.2017 |
| [6] |
Chen Y, Feng J, Zhao S, et al. Long-term engraftment promotes differentiation of alveolar epithelial cells from human embryonic stem cell derived lung organoids[J]. Stem Cells Dev, 2018, 27(19): 1339-1349. DOI:10.1089/scd.2018.0042 |
| [7] |
Kim KK, Sheppard D, Chapman HA. TGF-β1 signaling and tissue fibrosis[J]. Cold Spring Harb Perspect Biol, 2018, 10(4): a022293. DOI:10.1101/cshperspect.a022293 |
| [8] |
Hou X, Yin S, Ren R, et al. Myeloid-cell-specific IL-6 signaling promotes microRNA-223-enriched exosome production to attenuate NAFLD-associated fibrosis[J]. Hepatology, 2021, 74(1): 116-132. DOI:10.1002/hep.31658 |
| [9] |
Zhang X, Liu Y, Shao R, et al. Cdc42-interacting protein 4 silencing relieves pulmonary fibrosis in STZ-induced diabetic mice via the Wnt/GSK-3β/β-catenin pathway[J]. Exp Cell Res, 2017, 359(1): 284-290. DOI:10.1016/j.yexcr.2017.07.018 |
| [10] |
Loboda A, Sobczak M, Jozkowicz A, et al. TGF-β1/Smads and miR-21 in renal fibrosis and inflammation[J]. Mediators Inflamm, 2016, 2016: 8319283. DOI:10.1155/2016/8319283 |
| [11] |
Liu N, Feng J, Lu X, et al. Isorhamnetin inhibits liver fibrosis by reducing autophagy and inhibiting extracellular matrix formation via the TGF-β1/Smad3 and TGF-β1/p38 MAPK pathways[J]. Mediators Inflamm, 2019, 2019: 6175091. DOI:10.1155/2019/6175091 |
| [12] |
Lv Q, Wang J, Xu C, et al. Pirfenidone alleviates pulmonary fibrosis in vitro and in vivo through regulating Wnt/GSK-3β/β-catenin and TGF-β1/Smad2/3 signaling pathways[J]. Mol Med, 2020, 26(1): 49. DOI:10.1186/s10020-020-00173-3 |
| [13] |
Liu X, Gao S, Xu H. lncRNAPCAT29 inhibits pulmonary fibrosis via the TGF-β1-regulated RASAL1/ERK1/2 signal pathway[J]. Mol Med Rep, 2018, 17(6): 7781-7788. DOI:10.3892/mmr.2018.8807 |
| [14] |
Kataoka T. Study of antioxidative effects and anti-inflammatory effects in mice due to low-dose X-irradiation or radon inhalation[J]. J Radiat Res, 2013, 54(4): 587-596. DOI:10.1093/jrr/rrs141 |
| [15] |
Yonezawa M. Induction of radio-resistance by low dose X-irradiation[J]. Yakugaku Zasshi, 2006, 126(10): 833-840. DOI:10.1248/yakushi.126.833 |
| [16] |
Beach TA, Groves AM, Williams JP, et al. Modeling radiation-induced lung injury: lessons learned from whole thorax irradiation[J]. Int J Radiat Biol, 2020, 96(1): 129-144. DOI:10.1080/09553002.2018.1532619 |
| [17] |
Song P, Zheng JX, Xu J, et al. β-catenin induces A549 alveolar epithelial cell mesenchymal transition during pulmonary fibrosis[J]. Mol Med Rep, 2015, 11(4): 2703-2710. DOI:10.3892/mmr.2014.3013 |
| [18] |
Dituri F, Mancarella S, Cigliano A, et al. TGF-β as multifaceted orchestrator in HCC progression: signaling, EMT, immune microenvironment, and novel therapeutic perspectives[J]. Semin Liver Dis, 2019, 39(1): 53-69. DOI:10.1055/s-0038-1676121 |
| [19] |
Zhang C, Jin S, Guo W, et al. Attenuation of diabetes-induced cardiac inflammation and pathological remodeling by low-dose radiation[J]. Radiat Res, 2011, 175(3): 307-321. DOI:10.1667/RR1950.1 |
| [20] |
Hess CB, Buchwald ZS, Stokes W, et al. Low-dose whole-lung radiation for COVID-19 pneumonia: Planned day 7 interim analysis of a registered clinical trial[J]. Cancer, 2020, 126(23): 5109-5113. DOI:10.1002/cncr.33130 |
| [21] |
Li F, Surolia R, Li H, et al. Autoimmunity to vimentin is associated with outcomes of patients with idiopathic pulmonary fibrosis[J]. J Immunol, 2017, 199(5): 1596-1605. DOI:10.4049/jimmunol.1700473 |
 2022, Vol. 42
2022, Vol. 42


