2. 山东省诸城市妇幼保健院病理科,诸城 262200;
3. 河北中医学院第一附属医院外二科,石家庄 050011;
4. 河北中医学院第一附属医院肿瘤二科,石家庄 050011
2. Department of Pathology, Zhucheng Maternal and Child Health Hospital of Shandong Province, Zhucheng 262200, China;
3. Department of Surgery, First Affiliated Hospital of Hebei University of Traditional Chinese Medicine, Shijiazhuang 050011, China;
4. First Affiliated Hospital of Hebei University of Traditional Chinese Medicine Second Department of Oncology, Shijiazhuang 050011, China
食管癌为我国高发恶性肿瘤之一,整体预后较差[1]。依据肿瘤位于食管的不同解剖部位,分为颈、胸上段、胸中段和胸下段食管癌4种类型,其中颈、胸上段食管癌约占食管癌发病率的15%[2]。由于颈、胸上段食管的解剖位置、与周边组织器官关系较为紧密、术后消化道重建较为困难和术后并发症发生率较高等原因[3-4],颈、胸上段食管癌患者治疗上主要选择根治性放化疗。接受根治性放化疗颈、胸上段食管癌患者的主要治疗失败原因为复发或和远处转移,而如何提高其预后,是临床肿瘤医师共同关注的问题。目前相关研究显示其影响因素众多[5-6],其中放射治疗靶区的精确程度和照射方式为临床上较重要的影响因素[7-8]。随着调强放疗在临床上的普及,近年来,由其发展而来的同步加量调强放射治疗(simultaneous integrated boost intensity modulated radiotherapy,SIB-IMRT)在肿瘤放疗上的作用得到了许多研究的认可[9-10],在食管癌方面也同样如此[11-12]。本研究主要比较SIB-IMRT与常规调强放疗(conventional intensity-modulated radiotherapy,C-IMRT)对颈、胸上段食管癌患者长期预后是否存在差异。
资料与方法1.一般临床资料:2011年1月至2014年12月在诸城市人民医院放疗科接受根治性放化疗的食管癌患者中进行病例筛选,共有172例患者符合入组条件。入组标准:①患者病理证实为食管鳞状细胞癌,依据治疗前基线检查及2009年美国癌症联合会(AJCC)第7版TNM分期标准,患者均为颈段或胸上胸段食管癌,且分期为Ⅰ~Ⅲ期。②所有患者均接受IMRT或和联合化疗治疗。③治疗前均未接受抗肿瘤相关的新辅助治疗。④KPS评分>80。⑤无其他影响治疗的重大疾病。排除标准:①双原发癌或食管多中心起源癌者。②有穿孔和大出血风险者;③合并远处脏器转移者等。本研究获得医院伦理委员会认证,且入组患者均签署了治疗知情同意书。其中,男性106例,女性66例;年龄为39~78岁,中位63岁;颈、胸上段食管癌分别为27例和145例;治疗前食管钡餐造影显示食管病变长度为1.5~11.6 cm,中位5.0 cm;依据我国食管癌非手术临床分期标准[13],临床Ⅰ、Ⅱ和Ⅲ期患者分别为43、58和71例。依据治疗前的基线检查全组患者食管肿瘤周围组织、器官受侵共60例,其中下咽受侵11例,甲状腺受侵3例,大气道受侵16例,主动脉受侵7例,喉返神经受侵23例。其余一般临床资料详见表 1。
|
|
表 1 影响172例颈胸上段食管癌患者预后的单因素分析 Table 1 Univariate analysis of 172 patients with cervical and upper thoracic esophageal cancer |
2. 放射治疗:患者采取仰卧位,热塑体膜固定体位,于CT模拟机下扫描定位,层厚为3~5 mm,扫描范围为颅底水平上3 cm至膈肌水平。靶区定义:①大体肿瘤靶区(gross tumor volume,GTV)包括食管原发性肿瘤和影像学或病理学确定的转移淋巴结。②临床靶区(clinical target volume,CTV)包括病灶周围的亚临床病变,如食管肿瘤侵及下咽,CTV上界为颅底,否则为食管肿瘤上界的2~3 cm;CTV的下界在食管肿瘤下界的2~3 cm,否则则为隆突下方1.5 cm。③计划靶区(planned target volume,PTV)在CTV外均匀外扩3~5 mm。④同时勾画颈段和胸上段食管相应淋巴结引流区为PTV1。
全组患者中有64例接受SIB-IMRT,另108例接受C-IMRT。C-IMRT:前程95%PTV1接受剂量为45~52 Gy/25~26次,中位50 Gy;前程结束后再缩野至PTV,患者最终95%PTV接受剂量为56~ 64 Gy,中位62 Gy。SIB-IMRT:要求95%PTV1接受处方剂量为50.4~54 Gy/28~30次,中位50.4 Gy;要求95%PTV接受剂量为60~64 Gy/28~ 30次,200~215 cGy/次,5次/周,中位62 Gy。正常组织的剂量:双肺接受20 Gy剂量照射的体积(V20) < 30%,接受30 Gy剂量照射的体积(V30) < 20%;心脏接受30 Gy剂量照射的体积(V30) < 40%,接受40 Gy剂量照射的体积(V40) < 30%;脊髓最大受照剂量 < 45 Gy。
3.化疗:全组共有86例患者接受了化疗,其中29例患者行PF方案治疗(顺铂和5-氟尿嘧啶),57例患者行TP方案治疗(紫杉醇和顺铂)。化疗周期数为2~6个,中位4个。
4.食管周围组织受侵和治疗后失败:将局部区域复发和远处脏器转移统称为治疗失败,其中局部或区域复发主要包括食管局部和区域淋巴结复发,确定食管复发需电子胃镜的咬检病理证实,颈部或锁骨上区等浅表淋巴结转移需经针吸活检病理证实;其余区域淋巴结转移或和远处脏器转移及食管肿瘤周围组织、器官是否受侵的诊断须有CT、MRI、PET/CT或B超等影像学检查依据。
5.近期疗效和不良反应评价:参照实体肿瘤评价标准(RECIST1.1版),分为完全缓解(complete response, CR):所有目标病灶消失;部分缓解(partial response, PR):基线病灶长径总和缩小≥30%;稳定(stable disease, SD):基线病灶长径总和有缩小但未达PR,或有增加但未达PD;进展(progressive disease, PD):基线病灶长径总和增加≥20%,或出现新病灶。参照美国肿瘤放射治疗协作组织(RTOG)不良反应评价标准第3版,进行放射性食管炎、放射性肺炎及血液学等不良反应的评价和分级。
6.随访:随访方式以电话随访、门诊复查为主,结合病例资料查阅。自患者放射治疗之日起,随访截止日期为2020年12月31日。患者第1年每3~6个月复查1次,随后每6~12个月复查1次。失访3例,随访率为98.3%,失访病例以末次随访日期按死亡统计。
7.统计学处理:采用SPSS 22.0软件进行统计分析,计数资料应用χ2检验;应用Kaplan-Meier法计算总生存(overall survival, OS)率和无进展生存(progress-free survival,PFS)率,并用Log\|rank法检验和单因素预后分析;Cox多因素分析模型进行影响患者OS和PFS的独立性预后的分析。为减少偏差和混杂变量对不同照射方式患者预后的影响,对C-IMRT和SIB-IMRT两组患者进行了倾向性评分匹配(propensity score matching, PSM)分析。P<0.05为差异有统计学意义。
结果1.全组患者预后:全组患者的1、3、5年OS率和PFS率分别为79.6%、44.6%、24.1%和61.5%、35.0%、18.4%,中位OS和PFS时间分别为30个月(95%CI 20.93~39.07个月)和20个月(95%CI 15.94~24.06个月)。
2.预后影响因素分析:单因素分析结果显示,食管病变周围组织器官是否受侵、病变长度、cT分期、cN分期、cTNM分期、化疗、GTV-最大横径、照射方式和近期疗效等9项指标既与患者OS(χ2=4.00~23.61,P<0.05),又与PFS有关(χ2= 3.87~20.98,P<0.05,表 1)。其他因素例如性别、年龄、病变部位、放疗剂量和GTV体积等与患者OS和PFS无关。PSM前不同照射方式的OS和PFS曲线见图 1。
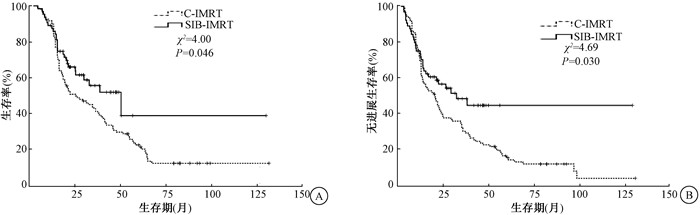
|
图 1 PSM前不同照射方式的生存曲线图(A)和无进展生存曲线图(B) Figure 1 Survival curves (A) and progression-free survival curves (B) of different irradiation methods before PSM |
将以上单因素分析中对患者OS和PFS有显著性影响的指标分别纳入COX多因素分析模型进行独立性影响因素的分析,结果显示,食管病变周围组织器官是否受侵、cN分期、化疗和GTV-最大横径等4项指标为影响患者OS的独立性因素(P < 0.001、P=0.013、0.005、0.002),食管病变周围组织器官是否受侵、cN分期、化疗、GTV-最大横径和近期疗效等5项指标是影响患者PFS的独立性因素(P < 0.001、P=0.017、0.034、0.002、0.036),详见表 2。
|
|
表 2 影响172例颈胸上段食管癌患者预后的多因素分析 Table 2 Multivariate analysis of OS and PFS in 172 patients with upper cervical and upper thoracic esophageal cancer |
3. 不同照射方式的PSM分析结果:将c-IMRT和SIB-IMRT两组患者的一般临床资料进行比较。结果显示,两组患者在食管病变周围组织器官是否受侵和cTNM分期上构成比差异有统计学意义(χ2=4.38、8.11,P=0.036、0.017)。为减少一些偏差和混杂变量对不同照射方式患者预后的影响,以便对不同照射组进行更合理的比较,对C-IMRT和SIB-IMRT两组患者进行了PSM分析,并定义SIB-IMRT为试验组,以Cox多因素分析的独立性预后指标:食管病变周围组织器官是否受侵、cN分期、化疗和GTV-最大横径为协变量,进行随机的1 ∶1匹配,结果显示各组有54例患者,再次对两组患者进行一般临床资料的构成比进行比较,食管病变周围组织器官是否受侵和cTNM分期等各项指标构成比差异均无统计学意义(P>0.05)。
4. PSM分析后的多因素分析:将可能影响患者预后的一般临床指标纳入Cox多因素分析模型,对影响患者OS和PFS的独立性预后指标分别分析。结果显示,食管病变周围组织器官是否受侵、cN分期、cTNM分期、处方剂量、GTV-最大横径和照射方式等6项指标为影响患者OS的独立性因素(P < 0.001、P=0.008、0.014、0.021、0.010、0.008),食管病变周围组织器官是否受侵、cN分期和GTV-最大横径等3项指标既是影响患者PFS的独立性因素(P < 0.001、P=0.044、0.013),详见表 3。
|
|
表 3 影响108例颈胸上段食管癌患者OS的多因素分析 Table 3 Multivariate analysis of OS in 108 patients with cervical and upper thoracic esophageal cancer |
5. PSM分析后的失败模式分析:108例患者治疗后失败65例(60.2%),其中单纯局部区域复发44例(40.7%)、单纯远处转移13例(12.0%),有8例(7.4%)为局部区域复发合并远处转移。C-IMRT和SIB-IMRT两组患者出现治疗失败的患者分别为38例(38/54, 70.4%)和27例(27/54, 50.0%),两组患者治疗失败发生率差异有统计学意义(χ2=4.68,P=0.031)。
C-IMRT和SIB-IMRT两组患者中出现单纯局部区域复发的患者分别为29例和13例,出现单纯远处转移的患者分别为6例和7例,两者均有的分别为4例和4例。两组患者间的局部区域复发发生率(61.1% vs. 31.5%)差异有统计学意义(χ2=9.53,P=0.002)。
6、PSM分析后的不良反应分析:患者治疗期间最常见的不良反应为放射性食管炎(0~3级发生率分别为14.8%、43.5%、33.3%和8.3%)和白细胞抑制(0~3级发生率分别为55.6%、14.8%、22.2%和7.4%),≥2级放射性肺炎发生率仅为11.1%,且较为严重的血红蛋白抑制(≥2级发生率为3.7%)和血小板抑制(≥2级发生率为1.9%)少见,患者治疗期间及治疗均未出现≥4级的不良反应。
依据不同照射方式进行分组比较,两组患者的放射性食管炎、血红蛋白抑制和血小板抑制发生率差异无统计学意义(χ2=6.35、1.29、4.16,P=0.077、0.524、0.125);c-IMRT组的≥1级的放射性肺炎发生率(35.2%)高于SIB-IMRT(14.9%)组(χ2=6.16,P=0.046),而≥2级的白细胞抑制低于后者(16.7%vs.42.6%;χ2=12.77,P=0.005)。
讨论颈、胸上段食管癌发病率较与其他部位食管癌的发病率低,但由于其处于特殊解剖位置,及其临床上较常见的侵犯范围,例如下咽、甲状腺及喉返神经等,使得对于颈、胸上段食管癌患者是采用手术拟或非手术治疗尚存在不同的意见[4, 14]。鉴于其术后较为常见和严重的并发症,治疗指南推荐对于颈、胸上段食管癌患者应用根治性放化疗(definitive chemoradiation therapy,dCRT),且推荐放疗剂量为50.4 Gy[15],但接受dCRT食管癌患者的主要治疗失败模式为局部区域复发,且中国食管癌患者的病理类型主要为鳞状细胞癌,其生物学行为与头颈部鳞癌有相似之处,因此,我国食管癌的放疗剂量倾向于60~70 Gy[16-17]。随着IMRT在临床上的广泛应用,使颈、胸上段食管癌患者在实现放疗剂量提高的同时,周围正常组织也可得到相应地保护。本研究的结果与既往相关研究结果相似。Zhang等[18]对250例(颈、胸上段食管癌患者分别为54例和196例)接受IMRT的患者预后进行了分析,患者3年OS和DFS分别为42%和29.3%,中位值分别为22.60和14.52个月。Zhu等[19]对30例接受IMRT的颈、胸上段食管癌的预后进行了分析,结果显示患者3和5年OS分别为50%和35%。
既往相关研究已经证实,食管癌患者接受IMRT与三维适形放射治疗相比,具有较多优势[20-21]。近年来,在IMRT基础上衍生出来的SIB-IMRT技术已在乳腺癌和直肠癌等肿瘤显示出较好的治疗效果[22-23],在食管癌上也常有报道。本研究中的172例患者全部接受IMRT治疗,但不同靶区的放疗剂量不尽相同,据此将患者分为C-IMRT和SIB-IMRT两组,为了消除两组患者不同构成比可能引起的偏倚,进行了PSM分析,以进一步为颈、胸上段食管癌患者筛选出最为合适的治疗方式。本研究最终的独立性影响因素分析结果显示,照射方式为影响PSM后患者OS的独立影响因素。与C-IMRT相比,SIB-IMRT在肿瘤局部剂量和治疗时间上均有较高优势。众所周知,接受dCRT的食管癌患者主要治疗失败模式为局部区域复发,而较高的放射治疗剂量与局部控制率有关。本研究对两组患者的治疗后失败进行了进一步分析,结果显示,与C-IMRT相比,SIB-IMRT在总的失败率和局部区域复发率上均较低。Welsh等[24]的研究证实,与C-MRT相比,SIB-IMRT具有较好的肿瘤局部剂量和保护周围正常组织的优势。Gao等[25]的研究也进一步证实了选择性增加肿瘤单次局部剂量可以提高食管癌患者的预后。本研究结果显示,总的照射剂量也是影响患者OS的独立性影响因素,照射剂量较高组患者的预后较好。为评估在现代放疗技术基础上对于食管癌dCRT患者不同放射剂量的临床获益情况,Sun等[21]进行了一项Meta分析,共纳入12项研究,包括10 896例患者,结果显示,高剂量组患者的OS(HR=0.79,95%CI 0.70~0.90,P < 0.001)和局部控制率(OR=0.59,95%CI0.46~0.76,P < 0.001)均更优,而且对于食管鳞状细胞癌患者的优势更加明显;其亚组分析进一步表明,60 Gy为较好的分界值,而50.4 Gy未显示出分界效果。Zhang等[18]的研究中,放疗剂量<60 Gy (28.2%)和≥60 Gy (71.8%)组患者的中位OS和PFS分别为17.64、34.46个月和10.94、17.28个月,差异有统计学意义,同时其结果显示较高组患者近期疗效(CR+PR)显著优于剂量较低组(P < 0.05)。从本研究结果和既往研究结果可以看出,与C-IMRT相比SIB-IMRT对于颈、胸上段食管癌患者更具有生存优势,且建议放疗剂量≥60 Gy。
值得注意的是,照射方式并不是影响本组患者PFS的独立预后因素,这可能与本研究的研究重点不同于其他SIB-IMRT研究有关。既往相关研究重点在于比较不同瘤床区剂量对患者的预后影响,而本研究更注重照射技术,两组患者淋巴结引流区和瘤床区总体剂量差异不大,中位剂量相当,因此对于局部区域控制差异性不大,但SIB-IMRT技术很好地解决了治疗时间的问题。
影响接受dCRT食管癌患者的预后影响因素众多,其中分期对患者预后的影响已得到了广泛性认同。本研究结果显示,除cN分期和cTNM分期外,与T分期密切相关的GTV-最大横径和食管肿瘤周围组织受侵情况也为患者的独立预后影响因素。GTV-最大横径越大,食管肿瘤向周围组织、器官侵犯越严重,一般预示肿瘤细胞横向侵入食管壁越严重,肿瘤的侵袭性也更强,分期更晚。既往研究显示,肿瘤侵犯深度可以预测患者的预后[26]。Qin等[27]对1 450例接受放疗的食管癌患者进行回顾性分析,结果显示,肿瘤直径为患者PFS的独立影响因素。Chen等[28]对153例食管癌患者进行分析,同样得出肿瘤直径为预测患者预后的独立因素。因此,对于临床上肿瘤浸润深度较深、肿瘤直径较大的食管癌患者应予以足够的重视和更加积极的治疗措施。
由于本研究为回顾性、单中心的临床研究,在病例收集及治疗上存在一定的偏倚,这可能在一定程度上影响了研究的结果;PSM后两组患者的病例数偏少,可能影响失败模式和不良反应的评价等。
综上所述,IMRT对颈、胸上段食管癌患者行之有效;SIB-IMRT在一定程度上可提高和改善了颈、胸上段食管癌患者的预后;建议放疗剂量≥60 Gy;传统的分期仍是患者的预后影响因素,而肿瘤局部因素应该得到重视。但仍需要进行前瞻性的大宗病例随机对照研究进一步佐证。
利益冲突 所有研究者未因进行该研究而接受任何不正当的职务或财务津贴,并对研究的独立性和科学性予以保证
作者贡献声明 郭宁设计研究方案,收集数据并撰写论文;王巍伟负责病例的病理信息登记和随访;王勇和孙磊协助提供符合入组的病例和随访;孙云朝负责数据统计和统计设计;郭娜为论文设计提供总体思路并修改论文
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [2] |
白文文, 周志国, 甄婵军, 等. 159例颈及胸上段食管癌调强放疗长期疗效分析[J]. 中华放射医学与防护杂志, 2016, 36(1): 28-34. Bai WW, Zhou ZG, Zhen CJ, et al. Long-term efficacy of 159 cases of cervical and upper esophageal carcinoma treated with intensity modulated radiotherapy[J]. Chin J Radiol Med Prot, 2016, 36(1): 28-34. DOI:10.3760/cma.j.issn.0254-5098.2016.01.005 |
| [3] |
Kumabe A, Zenda S, Motegi A, et al. Long-term clinical results of concurrent chemoradiotherapy for patients with cervical esophageal squamous cell carcinoma[J]. Anticancer Res, 2017, 37(9): 5039-5044. DOI:10.21873/anticanres.11919 |
| [4] |
Buckstein M, Liu J. Cervical esophageal cancers: challenges and opportunities[J]. Curr Oncol Rep, 2019, 21(5): 46-52. DOI:10.1007/s11912-019-0801-7 |
| [5] |
Esmati E, Maddah Safaei A, Ghalehtaki R, et al. Outcomes of definitive chemoradiotherapy for cervical and upper thoracic esophageal cancers: a single-institution experience of a rare cancer[J]. J Gastrointest Cancer, 2019, 50(3): 380-385. DOI:10.1007/s12029-018-0081-8 |
| [6] |
Ristau J, Thiel M, Katayama S, et al. Simultaneous integrated boost concepts in definitive radiation therapy for esophageal cancer: outcomes and toxicity[J]. Radiat Oncol, 2021, 16(1): 23. DOI:10.1186/s13014-021-01749-x |
| [7] |
Ma JB, Song YP, Yu JM, et al. Feasibility of involved-field conformal radiotherapy for cervical and upper-thoracic esophageal cancer[J]. Onkologie, 2011, 34(11): 599-604. DOI:10.1159/000334194 |
| [8] |
Liu M, Zhao K, Chen Y, et al. Evaluation of the value of ENI in radiotherapy for cervical and upper thoracic esophageal cancer: a retrospective analysis[J]. Radiat Oncol, 2014, 9: 232. DOI:10.1186/s13014-014-0232-4 |
| [9] |
尤静, 杨丹, 李东明, 等. 同步推量调强放疗在局部晚期非小细胞肺癌中的应用[J]. 中国肺癌杂志, 2019, 22(11): 696-701. You J, Yang D, Li DM, et al. Application of simultaneous integrated boost intensity modulated radiotherapy in locally advanced non-small cell lung cancer[J]. Chin J Lung Cancer, 2019, 22(11): 696-701. DOI:10.3779/j.issn.1009-3419.2019.11.03 |
| [10] |
Jirkovska M, Novak T, Malinova B, et al. Three-dimensional conformal radiotherapy versus intensity modulated radiotherapy with simultaneous integrated boost in the treatment of locally advanced head and neck carcinoma[J]. Neoplasma, 2019, 66(5): 830-838. DOI:10.4149/neo_2018_181209N941 |
| [11] |
Gao LR, Wang X, Han W, et al. A multicenter prospective phase Ⅲ clinical randomized study of simultaneous integrated boost intensity-modulated radiotherapy with or without concurrent chemotherapy in patients with esophageal cancer: 3JECROG P-02 study protocol[J]. BMC Cancer, 2020, 20(1): 901. DOI:10.1186/s12885-020-07387-y |
| [12] |
Chen D, Menon H, Verma V, et al. Results of a phase 1/2 trial of chemoradiotherapy with simultaneous integrated boost of radiotherapy dose in unresectable locally advanced esophageal cancer[J]. JAMA Oncol, 2019, 5(11): 1597-1604. DOI:10.1001/jamaoncol.2019.2809 |
| [13] |
中国非手术治疗食管癌临床分期专家小组. 非手术治疗食管癌的临床分期标准(草案)[J]. 中华放射肿瘤学杂志, 2010, 19(3): 179-180. Chinese Expert Group on Clinical Staging of Non-surgical Treatment of Esophageal Cancer. Clinical staging criteria for non-surgical treatment of esophageal cancer (draft)[J]. Chin J Radiat Oncol, 2010, 19(3): 179-180. DOI:10.3760/cma.j.issn.1004-4221.2010.03.001 |
| [14] |
Cao CN, Luo JW, Gao L, et al. Primary radiotherapy compared with primary surgery in cervical esophageal cancer[J]. JAMA Otolaryngol Head Neck Surg, 2014, 140(10): 918-926. DOI:10.1001/jamaoto.2014.2013 |
| [15] |
Ajani JA, D'Amico TA, Almhanna K, et al. Esophageal and esophagogastric junction cancers, version 1.2015[J]. J Natl Compr Cane Netw, 2015, 13(2): 194-227. DOI:10.6004/jnccn.2015.0028 |
| [16] |
Yu W, Cai XW, Liu Q, et al. Safety of dose escalation by simultaneous integrated boosting radiation dose within the primary tumor guided by (18)FDG-PET/CT for esophageal cancer[J]. Radiother Oncol, 2015, 114(2): 195-200. DOI:10.1016/j.radonc.2014.12.007 |
| [17] |
Conroy T, Galais MP, Raoul JL, et al. Definitive chemoradiotherapy with FOLFOX versus fluorouracil and cisplatin in patients with oesophageal cancer (PRODIGE5/ACCORD17): final results of a randomised, phase 2/3 trial[J]. Lancet Oncol, 2014, 15(3): 305-314. DOI:10.1016/S1470-2045(14)70028-2 |
| [18] |
Zhang JQ, Zhang WC, Zhang BZ, et al. Clinical results of intensity-modulated radiotherapy for 250 patients with cervical and upper thoracic esophageal carcinoma[J]. Cancer Manag Res, 2019, 11: 8285-8294. DOI:10.2147/CMAR.S203575.eCollection2019 |
| [19] |
Zhu WG, Yu CH, Han JH, et al. Feasibility and short-term efficacy of simplified intensity-modulated radiotherapy and concurrent chemotherapy for neck and upper thoracic esophageal carcinoma[J]. Chin J Cancer, 2009, 28(12): 1265-1269. DOI:10.5732/cjc.009.10215 |
| [20] |
Ishida Y, Sakanaka K, Fujii K, et al. Intensity-modulated radiotherapy for cervical esophageal squamous cell carcinoma without hypopharyngeal invasion: dose distribution and clinical outcome[J]. J Radiat Res, 2019, 60(4): 517-526. DOI:10.1093/jrr/rrz019 |
| [21] |
Sun X, Wang L, Wang Y, et al. High vs. low radiation dose of concurrent chemoradiotherapy for esophageal carcinoma with modern radiotherapy techniques: a Meta-analysis[J]. Front Oncol, 2020, 10: 1222. DOI:10.3389/fonc.2020.01222 |
| [22] |
Owens R, Mukherjee S, Padmanaban S, et al. Intensity-modulated radiotherapy with a simultaneous integrated boost in rectal cancer[J]. Clin Oncol (R Coll Radiol), 2020, 32(1): 35-42. DOI:10.1016/j.clon.2019.07.009 |
| [23] |
Lee HH, Chen CH, Luo KH, et al. Five-year survival outcomes of intensity-modulated radiotherapy with simultaneous integrated boost (IMRT-SIB) using forward IMRT or Tomotherapy for breast cancer[J]. Sci Rep, 2020, 10(1): 4342. DOI:10.1038/s41598-020-61403-6 |
| [24] |
Welsh J, Palmer MB, Ajani JA, et al. Esophageal cancer dose escalation using a simultaneous integrated boost technique[J]. Int J Radiat Oncol Biol Phys, 2012, 82(1): 468-474. DOI:10.1016/j.ijrobp.2010.10.023 |
| [25] |
Gao HM, Shen WB, Xu JR, et al. Effect of SIB-IMRT-based selective dose escalation of local tumor on the prognosis of patients with esophageal cancer[J]. Int J Clin Oncol, 2021, 26(9): 1640-1649. DOI:10.1007/s10147-021-01943-7 |
| [26] |
Iizuka T, Isono K, Kakegawa T, et al. Parameters linked to ten-year survival in Japan of resected esophageal carcinoma. Japanese Committee for Registration of Esophageal Carcinoma Cases[J]. Chest, 1989, 96(5): 1005-1011. DOI:10.1378/chest.96.5.1005 |
| [27] |
Qin Q, Ge X, Wang X, et al. Stage Ⅲ esophageal squamous cell carcinoma patients with three-dimensional conformal or intensity-modulated radiotherapy: a multicenter retrospective study[J]. Front Oncol, 2020, 10: 580450. DOI:10.3389/fonc.2020.580450 |
| [28] |
Chen CZ, Chen JZ, Li DR, et al. Long-term outcomes and prognostic factors for patients with esophageal cancer following radiotherapy[J]. World J Gastroenterol, 2013, 19(10): 1639-1644. DOI:10.3748/wjg.v19.i10.1639 |
 2022, Vol. 42
2022, Vol. 42


