2. 河北省人民医院神经内科,石家庄 050051;
3. 河北医科大学第四医院呼吸内科,石家庄 050011
2. Department of Neurology, Hebei General Hospital, Shijiazhuang 050051, China;
3. Department of Respiratory, the Fourth Hospital of Hebei Medical University, Shijiazhuang 050011, China
炎症反应在肿瘤的发生、发展和转移过程中发挥着重要的作用,同时也会影响机体的免疫监视以及对治疗的反应[1]。近年来,应用炎症指标来预测肿瘤患者预后成为研究热点,相关研究表明中性粒细胞与淋巴细胞比值(neutrophil-lymphocyte ratio,NLR)、血小板与淋巴细胞比值(platelet-lymphocyte ratio,PLR)等炎症指标与食管癌患者预后相关[2-3],但这些指标较为单一,预测患者预后的作用有限。系统免疫炎症指数(systemic immune-inflammation index,SII)作为由中性粒细胞、血小板、淋巴细胞组合而成的新型炎症指标已被证实与多种实体瘤预后相关[4-7],但应用SII预测食管癌放疗疗效及预后生存的研究相对较少。本研究回顾性分析248例行根治性放疗的食管癌患者预后与SII之间的关系,并联合临床分期这一传统预后因素,为非手术食管癌患者预后生存提供准确有效的预测指标。
资料与方法1. 病例资料:选取2014年1月至2016年12月于河北医科大学第四医院放疗科行根治性放化疗或放疗的食管癌患者。入组标准:胃镜咬检病理证实为食管鳞状细胞癌;卡氏评分≥70;除外远处脏器转移;预计生存期>3个月。排除标准:放疗前血液学检查结果数据缺失;患有急慢性感染、血液系统疾病或自身免疫性疾病;既往接受过放疗、化疗或其他抗肿瘤治疗。共收集符合入组条件的食管癌患者248例,其中男146例,女102例,中位年龄67岁(41~88岁);病变部位:颈及胸上段84例,胸中段107例,胸下段57例;临床分期依据非手术治疗食管癌的临床分期标准草案[8]:Ⅰ期29例,Ⅱ期94例,Ⅲ期125例。本研究通过河北医科大学第四医院伦理委员会批准,所有患者均签署知情同意书。
2. 放疗靶区及计划方案:所有患者均采用6 MV X射线直线加速器调强放疗。参考定位CT等影像资料,勾画食管大体肿瘤靶区(GTV),标准为食管壁厚度>0.5 cm或不含气管腔直径>1.0 cm,临床靶区(CTV)为GTV上下外扩2.0~3.0 cm,轴向外扩0.6~0.8 cm,并根据解剖屏障适当修改,计划靶区(PTV)为CTV均匀外扩0.5~1.0 cm。勾画纵隔转移淋巴结(GTVnd),标准为淋巴结短径≥1.0 cm,食管旁、气管食管旁沟、心膈角、腹腔淋巴结勾画标准为长径≥0.5 cm,外扩1.0 cm为PTVnd。要求95% PTV及PTVnd处方剂量为54~66 Gy,1.8~2.06 Gy/次,中位处方剂量60 Gy。
3. 化疗方案:134例患者放疗同期接受1~2周期全身化疗,其中FP方案(氟尿嘧啶联合顺铂)45例,TP方案(紫杉醇联合顺铂)67例,S-1方案(替吉奥单药)22例,另114例患者因身体原因行单纯放疗。
4. 炎症指标计算:依据患者放疗前1周内外周血常规结果计算SII、NLR、PLR。计算公式为SII=血小板计数×中性粒细胞计数/淋巴细胞计数,NLR=中性粒细胞计数/淋巴细胞计数,PLR=血小板计数/淋巴细胞计数。
5. 随访与评价:所有患者均进行规律门诊复查及随访。放疗结束1个月内复查胸腹部CT及食管钡餐造影进行近期疗效评价,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)及疾病进展(PD),客观缓解率(ORR)=CR率+PR率。放疗后2年内每3个月复查1次,2年后每6个月复查1次,总生存时间为从病理诊断到患者死亡或末次随访,无进展生存时间为病理诊断起至疾病进展,失访患者以末次随访时间计算。
6. 统计学处理:应用SPSS 22.0统计软件进行数据分析。计数资料比较采用χ2检验或精确概率法,生存分析采用Kaplan-Meier法,单因素分析采用Log-rank χ2检验,多因素预后分析采用Cox回归模型。建立预测患者总生存的受试者工作特征(receiver operating characteristics, ROC)曲线计算约登指数(敏感度+特异度-1),确定放疗前SII、NLR、PLR的最佳临界值(最大约登指数对应值),ROC曲线下面积(AUC)比较采用Z检验。P<0.05为差异有统计学意义。
结果1. SII、NLR、PLR临界值的确定:全组患者放疗前SII、NLR和PLR均值分别为664.29±27.72、2.69±0.13和152.08±4.92。根据ROC曲线,确定放疗前SII、NLR和PLR最佳临界值分别为740.80、1.93和147.90,测量曲线下面积(AUC)分别为0.63(95%CI:0.55~0.71,P=0.003)、0.60(95%CI:0.52~0.68,P=0.029)和0.57(95%CI:0.49~0.66,P=0.095)。
2. SII与患者临床特征:依据放疗前SII临界值,将本组病例分为低SII组(<740.80)150例和高SII组(≥740.80)98例。低SII组患者NLR、PLR水平低于高SII组,差异有统计学意义(χ2=20.75、68.22,P<0.001),两组患者在年龄、性别、临床分期、放疗剂量及治疗方式等基线资料差异无统计学意义(P>0.05),见表 1。
|
|
表 1 2组食管癌患者一般临床资料比较 Table 1 Comparison of clinical data of two groups patients with esophageal cancer |
3. 近期疗效:低SII组患者放疗后CR、PR、SD、PD者分别为31、98、17、4例,高SII组CR、PR、SD、PD者分别为15、59、19、5例。低SII组的客观缓解率为86.0%(129/150),显著高于高SII组的75.5%(74/98),差异有统计学意义(χ2=4.39,P=0.036)。
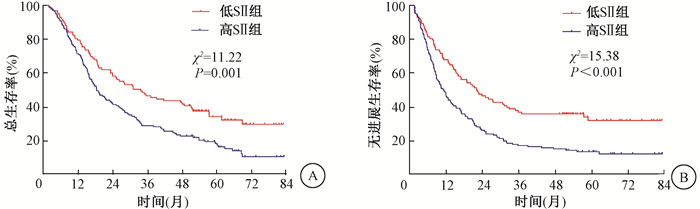
4. 生存分析:所有病例随访截至2020年12月31日,失访2例,随访率99.2%。全组1、3、5年总生存(OS)率分别为74.6%、36.3%、24.3%,中位OS为23.2个月(95%CI 17.99~28.41),1、3、5年无进展生存(PFS)率分别为54.8%、25.4%、20.6%,中位PFS为14.3个月(95%CI 11.35~17.31)。低SII组和高SII组患者1、3、5年OS率分别为78.6%、45.6%、32.3%和71.0%、28.3%、16.4%,差异有统计学意义(χ2=11.22,P=0.001),两组1、3、5年PFS率分别为67.0%、36.9%、32.0%和45.5%、17.5%、12.5%,差异有统计学意义(χ2=15.38,P<0.001),见图 1。
|
图 1 248例食管癌患者不同水平疗前SII对预后的影响 A.总生存率;B.无进展生存率 Figure 1 Effects of SII on prognosis in 248 esophageal cancer patients A. Overall survival; B. Progression-free survival |
5. 预后影响因素分析:单因素分析显示患者年龄、病变长度、T分期、TNM分期、放疗剂量、治疗方式、放疗前NLR、SII与OS及PFS显著相关(χ2=4.24~16.76,P<0.05),见表 2。分别以OS及PFS为因变量,将单因素分析有统计学意义的因素作为自变量纳入Cox风险比例模型,结果显示,TNM分期、治疗方式和放疗前SII为患者OS和PFS的独立影响因素(HR=1.39~1.60,P<0.05),见表 3。
|
|
表 2 248例食管癌患者总生存和无进展生存的单因素分析 Table 2 Univariate analysis of overall survival and progression-free survival of 248 esophageal cancer patients |
|
|
表 3 248例食管癌患者总生存和无进展生存的多因素分析 Table 3 Multivariate analysis of overall survival and progression-free survival of 248 esophageal cancer patients |
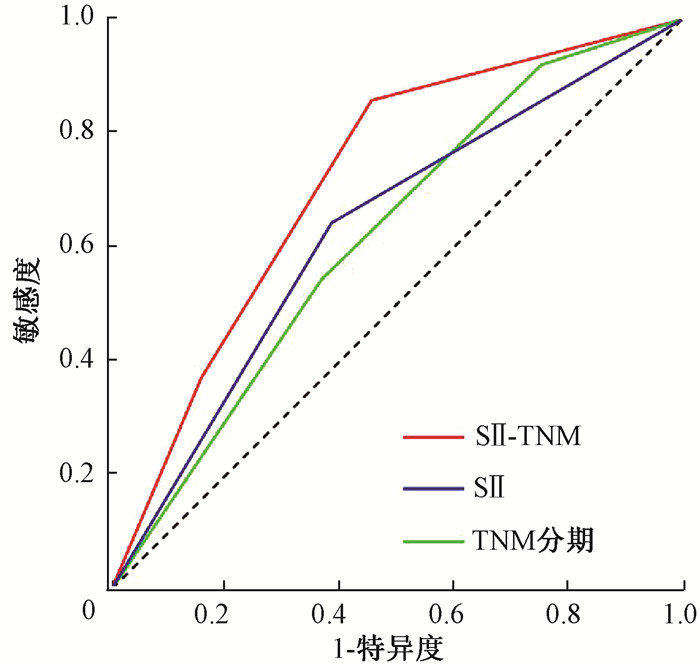
6.SII联合TNM分期的预测价值:将SII与TNM分期这两项预后指标联合分析(SII-TNM)并进行分组:低SII且TNM分期为Ⅰ~Ⅱ期为SII-TNM=2,82例;高SII且TNM分期为Ⅰ~Ⅱ期或低SII且TNM分期为Ⅲ期为SII-TNM=1,109例;高SII且TNM分期为Ⅲ期为SII-TNM=0,57例。不同SII-TNM分组患者行生存分析结果显示,SII-TNM=2组的1、3、5年OS和PFS率均显著优于SII-TNM=1组及SII-TNM=0组,差异有统计学意义(χ2=13.68、13.43,P=0.001),见表 4。绘制预测OS的ROC曲线,SII-TNM、TNM分期的AUC值分别为0.70(95%CI:0.61~0.80,P<0.001)、0.62(95%CI:0.53~0.71,P=0.006),SII-TNM预测效能优于SII及TNM分期(Z=2.48,P=0.013;Z=2.57,P=0.010),见图 2。
|
|
表 4 不同水平SII联合TNM分期(SII-TNM)对248例食管癌患者预后的影响 Table 4 Effects of SII combined TNM staging on the prognosis of 248 esophageal cancer patients |
|
图 2 预测248例食管癌患者总生存的ROC曲线 Figure 2 ROC curve for predicting the overall survival of 248 esophageal cancer patients |
讨论
炎症细胞作为肿瘤微环境的重要组成部分,可促进肿瘤的发生、增殖和迁移,同时也会影响机体的免疫监视和对治疗的反应。淋巴细胞是人体免疫的重要成分,同时也存在于肿瘤微环境中,是影响肿瘤预后的重要因素[9]。越来越多的研究表明,系统免疫炎症指数(SII)升高与肺癌、胰腺癌、结直肠癌等多种实体瘤预后不良相关[4-7],而关于SII与非手术食管癌患者预后关系的研究较少。陈清清等[10]回顾性分析了118例行根治性放疗的老年食管癌患者,依据ROC曲线计算放疗前SII的临界值为686.90,结果显示放疗前高SII为影响OS的独立危险因素(HR=2.62,P<0.001)。本研究对248例接受根治性放疗的食管癌患者进行回顾性分析,结果发现放疗前低SII组患者OS及PFS均显著高于高SII组,且放疗前SII为OS和PFS的独立影响因素,与上述研究结果一致。同时本研究中低SII组患者近期疗效优于高SII组,说明SII评分对接受根治性放疗的食管癌患者近期疗效及远期预后的预测均具有重要的指导意义。SII由血小板、中性粒细胞、淋巴细胞组成,其中血小板、中性粒细胞计数增多或淋巴细胞计数减少均可引起SII升高。血小板增多诱导肿瘤血管生成,增强肿瘤细胞的侵袭性[11]。中性粒细胞增多可释放大量氧自由基,导致细胞DNA损伤,促进肿瘤的发生[12]。淋巴细胞是抗肿瘤免疫反应的重要组成要素,淋巴细胞减少预示免疫监视功能受损,有利于肿瘤的侵袭及转移[13]。因此,SII升高表明患者处于抗肿瘤炎症反应及免疫功能的失衡状态,疾病向促进肿瘤生成、转移方向进展,导致患者不良预后。
目前,临床主要依据TNM分期来评估患者预后,但经常发现具有相同TNM分期的食管癌患者之间存在明显的生存异质性,导致非手术食管癌患者TNM分期的应用受限且存在争议[14]。为了进一步深入探讨SII在食管癌放疗后预测生存的价值,将SII与TNM分期联合分析,结果显示,放疗前SII较低且临床分期偏早的患者预后较好,且联合指标的AUC值高于单一指标,表明预测价值更大。这提示在临床研究工作中开发新型生物标志物结合传统预后因素,可有效弥补非手术患者无法准确获得TNM分期的不足,对于更为准确判断患者预后提供一定的参考。
目前对于SII预测食管癌患者预后的临界值尚无定论,部分研究推荐值为387.65~686.90[10, 15]。本研究通过预测总生存的ROC曲线计算SII临界值为740.80,多因素分析显示,SII≥740.80为影响患者预后生存的独立危险因素,全组患者SII高达664.29±27.72。另外,从表 1可见高SII组中临床分期为Ⅲ期患者比例明显高于低SII组,表明非手术食管癌患者特别是局部晚期患者因肿瘤负荷较重,疗前普遍处于炎症反应活跃及免疫功能低下状态,同时也提示疗前可根据患者SII水平予以抗炎、提高免疫力等对症干预治疗可能对改善患者预后起到一定的积极作用。
化疗在食管癌的综合治疗中占有重要的地位,化疗药物在杀伤肿瘤细胞的同时可提高放疗敏感性,有效调节中性粒细胞等炎症介质水平,改善患者预后,因此同步放化疗已成为局部晚期不可手术食管癌的标准治疗手段[16]。本研究结果同样显示,同步放化疗为本组患者预后的独立影响因素。但同时化疗可显著抑制淋巴细胞等免疫效应细胞,导致免疫功能低下,一定程度上又促进肿瘤的复发和转移[17]。因此,考虑到放化疗期间SII受多重因素影响,不能准确反映食管癌患者长期的免疫炎症反应状态,本研究仅应用治疗前SII进行预后分析。这也提示后续研究工作中可根据放化疗期间及治疗后的SII来观察患者炎症反应水平及免疫状态的动态变化规律,优化使用化疗药物,从而使抗肿瘤治疗与免疫功能改善达到更好的平衡。
本研究也存在一些不足之处。首先,作为单中心回顾性研究,样本量偏小,病例的选择可能存在一定的偏倚。其次,未纳入C反应蛋白、白细胞介素等炎症指标进行预后评估。最后,本研究SII及联合指标的AUC值相对较低,如何构建预测价值更高的SII模型有待进一步研究。
综上所述,放疗前SII对于食管癌患者根治性放疗后疗效及预后有较高的预测价值,SII越高患者预后越差,SII与TNM分期联合预测的价值更高。今后还需要多中心大样本量前瞻性研究明确SII等炎症标志物在食管癌患者中的作用与价值。
利益冲突 所有人研究者未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证
作者贡献声明 闫可负责选题和文章撰写;魏菀怡、杜星语负责统计分析;杨洁、赵晗君、王晓斌负责收集整理病历资料;祝淑钗、沈文斌负责论文修改
| [1] |
Grivennikov SI, Greten FR, Karin M, et al. Immunity, inflammation, and cancer[J]. Cell, 2010, 140(6): 883-899. DOI:10.1016/j.cell.2010.01.025 |
| [2] |
Koh HK, Park Y, Koo T, et al. Neutrophil-to-lymphocyte ratio after definitive concurrent chemoradiotherapy predicts survival in patients with esophageal squamous cell carcinoma[J]. In Vivo, 2021, 35(2): 1133-1139. DOI:10.21873/invivo.12359 |
| [3] |
Chen LC, Li SH, Lo CM, et al. Platelet-to-lymphocyte ratio is an independent prognosticator in patients with esophageal squamous cell carcinoma receiving esophagectomy[J]. J Thorac Dis, 2019, 11(11): 4583-4590. DOI:10.21037/jtd.2019.11.06 |
| [4] |
Biswas T, Kang KH, Gawdi R, et al. Using the systemic immune-inflammation index (SⅡ) as a mid-treatment marker for survival among patients with stage-Ⅲ locally advanced non-small cell lung cancer (NSCLC)[J]. Int J Environ Res Public Health, 2020, 17(21): 7995-8008. DOI:10.3390/ijerph17217995 |
| [5] |
Jomrich G, Gruber ES, Winkler D, et al. Systemic immune-inflammation index (SⅡ) predicts poor survival in pancreatic cancer patients undergoing resection[J]. J Gastrointest Surg, 2020, 24(3): 610-618. DOI:10.1007/s11605-019-04187-z |
| [6] |
Yatabe S, Eto K, Haruki K, et al. Signification of systemic immune-inflammation index for prediction of prognosis after resecting in patients with colorectal cancer[J]. Int J Colorectal Dis, 2020, 35(8): 1549-1555. DOI:10.1007/s00384-020-03615-w |
| [7] |
Ozbek E, Besiroglu H, Ozer K, et al. Systemic immune inflammation index is a promising non-invasive marker for the prognosis of the patients with localized renal cell carcinoma[J]. Int Urol Nephrol, 2020, 52(8): 1455-1463. DOI:10.1007/s11255-020-02440-y |
| [8] |
中国非手术治疗食管癌临床分期专家小组. 非手术治疗食管癌的临床分期标准草案[J]. 中华放射肿瘤学杂志, 2010, 19(3): 179-180. Chinese Expert Group on Clinical Staging of Non-surgical Treatment of Esophageal Cancer. Draft standard for clinical staging of non-surgical treatment of esophageal cancer[J]. Chin J Radiat Oncol, 2010, 19(3): 179-180. DOI:10.3760/cma.j.ssn.1004-4221.2010.03.001 |
| [9] |
Iwahori K. Cytotoxic CD8+ Lymphocytes in the Tumor Microenvironment[J]. Adv Exp Med Biol, 2020, 1224: 53-62. DOI:10.1007/978-3-030-35723-8_4 |
| [10] |
陈清清, 崔红霞, 田野, 等. SⅡ-N评分模型预测老年食管癌预后的初步探讨[J]. 中华放射肿瘤学杂志, 2020, 29(8): 649-653. Chen QQ, Cui HX, Tian Y, et al. Preliminary study of SⅡ-N scoring model in predicting the prognosis of elderly patients with esophageal cancer[J]. Chin J Radiat Oncol, 2020, 29(8): 649-653. DOI:10.3760/cma.j.cn113030-20190822-00340 |
| [11] |
Stanger BZ, Kahn ML. Platelets and tumor cells: a new form of border control[J]. Cancer Cell, 2013, 24(1): 9-11. DOI:10.1016/j.ccr.2013.06.009 |
| [12] |
Wu L, Saxena S, Singh RK. Neutrophils in the tumor microenvironment[J]. Adv Exp Med Biol, 2020, 1224: 1-20. DOI:10.1007/978-3-030-35723-8_1 |
| [13] |
Conforti L. Potassium channels of T lymphocytes take center stage in the fight against cancer[J]. J Immunother Cancer, 2017, 5: 2. DOI:10.1186/s40425-016-0202-5 |
| [14] |
Inada M, Nishimura Y, Ishikawa K, et al. Comparing the 7th and 8th editions of the American Joint Committee on Cancer/Union for International Cancer Control TNM staging system for esophageal squamous cell carcinoma treated by definitive radiotherapy[J]. Esophagus, 2019, 16(4): 371-376. DOI:10.1007/s10388-019-00675-y |
| [15] |
Zhang H, Shang X, Ren P, et al. The predictive value of a preoperative systemic immune-inflammation index and prognostic nutritional index in patients with esophageal squamous cell carcinoma[J]. J Cell Physiol, 2019, 234(2): 1794-1802. DOI:10.1002/jcp.27052 |
| [16] |
Li C, Wang X, Wang L, et al. Clinical practice and outcome of radiotherapy for advanced esophageal squamous cell carcinoma between 2002 and 2018 in China: the multi-center 3JECROG Survey[J]. Acta Oncol, 2021, 60(5): 627-634. DOI:10.1080/0284186X.2021.1902564 |
| [17] |
Wei Q, Xu Q, Yuan X, et al. Immunological impact of chemotherapy on the tumor microenvironment in gastric cancer[J]. J Surg Oncol, 2021, 123(8): 1708-1715. DOI:10.1002/jso.26449 |
 2022, Vol. 42
2022, Vol. 42


