2. 南京医科大学附属苏州医院肿瘤放疗科,苏州215002
2. Department of Radiotherapy and Oncology, Nanjing Medical University Affiliated Suzhou Hospital, Suzhou 215002, China
食管癌最常见的病理类型是鳞状细胞癌[1]。食管癌容易出现局部区域淋巴结转移和远处血行转移,失去根治手术的机会,根据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)指南第7版,同步放化疗是晚期、不能手术或不愿手术食管癌患者的标准治疗方案[2],但总体预后仍然较差, 5年总生存率约为17%[3]。因此,寻找合适的预测疗效及预后的指标对治疗方案的制定有重要意义。目前,越来越多的证据表明,炎症和营养状态与恶性肿瘤患者的预后存在显著相关性,但既往报道多为单一的炎性指标或营养指标对预后的影响,为临床肿瘤医师提供的信息有限。因此,本研究旨在利用包括炎症和营养相关的综合预后模型-Naples预后评分(Naples Prognostic Score,NPS)模型,评估胸段食管鳞癌接受放化疗患者近期疗效及远期生存预后的影响。
资料与方法1. 一般临床资料:回顾性分析2014年1月至2017年12月在扬州大学附属泰兴人民医院接受根治性放化疗的胸段食管鳞癌患者的临床病理资料。纳入标准:①治疗前胃镜病理证实为鳞状细胞癌,行胸段食管癌根治性放化疗。②无远处淋巴结或器官转移,无食管瘘或穿孔征象。③无严重血液障碍性疾病,肝肾功能正常。④治疗前体力活动状态(performance status, PS)评分为0或1分。⑤治疗前1~2周有完整的炎症和营养相关的外周血实验检查资料,包括血清白蛋白、总胆固醇、中性粒细胞与淋巴细胞的比值(neutrophil-to-lymphocyte ratio,NLR),以及淋巴细胞与单核细胞的比值(lymphocyte-monocyte ratio,LMR)。⑥无其他肿瘤病史。共123例患者入组,其中男性94例,女性29例,年龄45~85岁,中位数67岁。患者一般临床病理资料见表 1,治疗方案通过医院伦理委员会论证,所有患者均已签署放疗或放化疗知情同意书。
|
|
表 1 123例胸段食管鳞癌患者的临床病理资料特点 Table 1 Clinicopathological characteristics of 123 patients with thoracic ESCC |
2. 数据收集及NPS计算方法:主要的实验室检查结果包括治疗前1~2周内检测的淋巴细胞计数、中性粒细胞计数、单核细胞计数、血清白蛋白(serum albumin,ALB)和总胆固醇(total cholesterol,TC)。其中,NLR为中性粒细胞计数与淋巴细胞计数的比值,LMR为淋巴细胞计数与单核细胞计数的比值。根据ALB、TC、NLR和LMR的中位值43.40 g/L、177.11 mg/dl、3.06、3.52,将患者分为高、低两组,最终NPS将患者分为0分组(18例)、1或2分组(60例)、3或4分组(45例)。
3.治疗方法:123例患者均采用三维适形放疗(three dimensional conformal RT, 3D-CRT),常规分割照射,1.8~2 Gy/次,5次/周。治疗处方剂量56~66 Gy/6~7周,中位剂量60 Gy;其中22例行单纯放疗,101例接受同步放化疗。化疗采用TP方案:顺铂25 mg/m2,第1~4天;紫杉醇135~175 mg/m2,第1天静脉滴注,同步化疗在放疗第2天开始使用,28 d为1个周期,共2个周期。
4. 近期疗效评价:治疗结束后3个月内行CT及上消化道钡餐复查,按实体瘤疗效评价标准(RECIST1.1版)评价食管原发肿瘤及区域转移淋巴结的治疗效果[4],分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。CR+PR为有效,SD+PD为无效。
5. 随访:采取门诊定期复诊及电话随访两种方式,所有入组患者治疗结束后第1年每3个月复查1次,随后2年每6个月复查1次,继而1年复查1次,最后随访时间为2020年12月。
6. 统计学处理:应用SPSS 25.0统计软件进行数据分析,近期疗效的影响因素采用logistic单因素及多因素分析;对生存率行Kaplan\|Meier法计算,并行log-rank检验,Cox回归模型评估预后因素。采用受试者工作特征曲线(receiver operating characteristic curve,ROC),分析NPS对患者近期疗效及预后的预测价值。P < 0.05为差异有统计学意义。
结果1.各组胸段食管鳞癌放化疗患者的治疗效果: 入组患者总体治疗有效率为65.0%,0分组、1或2分组和3或4分组的有效率分别为88.9%、73.3%和44.4%。单因素logistic回归分析显示,TNM分期(HR=1.633,95%CI 1.018~2.665,P=0.035)、治疗方式(HR=0.225,95%CI 0.119~ 0.427,P<0.001)、NLR(HR=4.002,95%CI 2.315~6.916,P<0.001)、LMR(HR=0.320,95%CI 0.186~0.550,P=0.001)和NPS(将NPS 0分组设为哑变量,NPS 1或2分组:HR=2.909,95%CI 1.633~13.363,P=0.017;NPS 3或4分组:HR=6.591,95%CI 2.121~15.207,P<0.001)与治疗效果密切相关,而年龄(HR=1.319,95%CI 0.810~2.147,P=0.265)和性别(HR=1.350,95%CI 0.771~2.363,P=0.293)与治疗效果无关;多因素logistic回归分析进一步显示,治疗方法、NLR与NPS是疗效的独立危险因素,见表 2。
|
|
表 2 123例食管鳞癌放化疗患者治疗效果的单因素和多因素logistic回归分析 Table 2 Univariate and multivariate logistic regression analysis of 123 ESCC patients treated with CRT or RT alone |
2.治疗前NPS对胸段食管鳞癌放化疗患者PFS时间和OS时间的影响:全组患者的中位PFS时间13个月(95%CI 11.873~14.127),1、2、3年PFS率分别为50.2%、27.1%和20.9%;NPS 0分组患者1、2、3年PFS率分别为94.4%、72.2%、66.7%,NPS 1或2分组患者1、2、3年PFS率分别为55.0%、38.3%、30.0%,NPS 3或4分组患者1、2、3年PFS率分别为40.0%、11.1%、6.7% (χ2=45.719, P<0.001,图 1)。
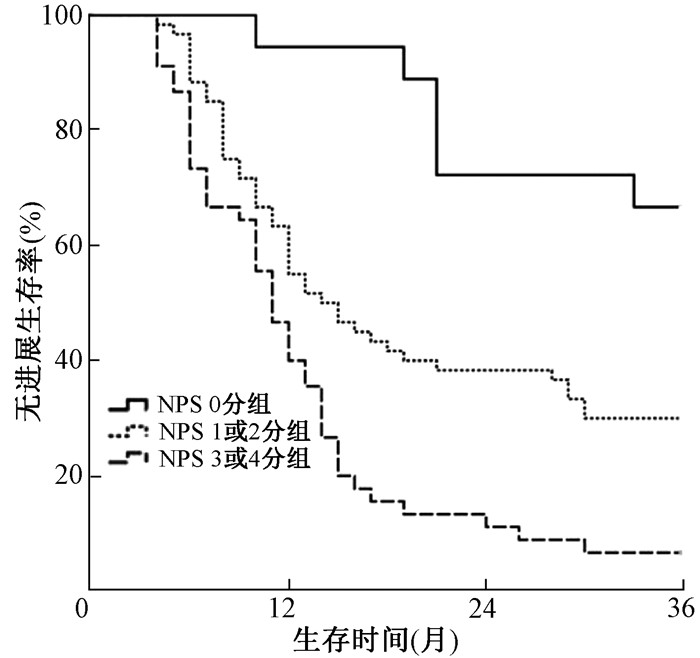
|
图 1 3组胸段食管鳞癌患者的无进展生存曲线 Figure 1 PFS curves of three groups of patients with thoracic esophageal squamous cell carcinoma |
全组患者的中位OS为23个月(95%CI 21.297~24.730),1、2、3年OS率分别为83.9%、44.0%和30.0%;而0分组患者1、2、3年OS率分别为100.0%、94.4%、88.9%,1或2分组患者1、2、3年OS率分别为93.3%、53.3%、40.0%,3或4分组患者1、2、3年OS率分别为68.9%、28.9%、13.3% (χ2=49.752, P<0.001,见图 2)。
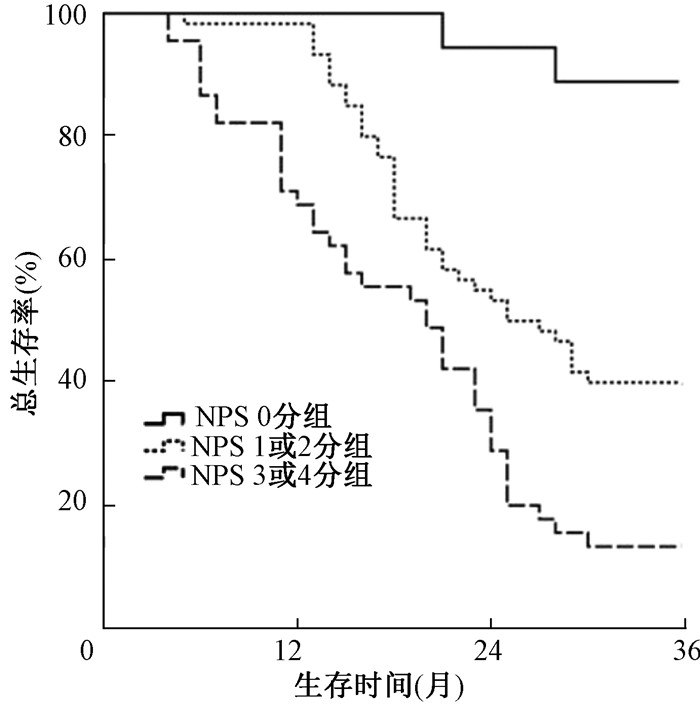
|
图 2 3组胸段食管鳞癌患者的总生存曲线 Figure 2 Overall survival curve for three groups of patients with thoracic ESCC |
3. 单因素和多因素生存分析:单因素生存分析显示,TNM分期、治疗方式、NLR、LMR和NPS(1或2分组和3或4分组)均与胸段食管鳞癌患者的PFS和OS均密切相关(HRPFS=1.480、0.364、2.129、0.635、3.316、6.599,P<0.05;HROS=1.149、0.308、2.306、0.609、3.316、6.599,P<0.05), 而年龄、性别的PFS和OS均无相关性(HRPFS=1.118、1.006,P>0.05;HROS=1.243、0.980,P>0.05)。Cox多因素分析结果显示,TNM分期、治疗方式、NLR与NPS(1或2分组和NPS 3或4分)是PFS的独立预后因素(HR=1.408、0.367、1.518、3.279、6.233;95%CI:1.069~1.854、0.261~0.516、1.078~2.139、1.405~7.653、2.439~15.875;P < 0.05);而TNM分期、治疗方式、NLR与NPS(NPS 1或2分组和NPS 3或4分组)也是OS的独立预后因素(HR=1.136、0.308、1.680、3.327、5.113;95%CI 1.009~1.386、0.215~0.440、1.169~2.415、1.412~7.476、1.879~14.165;P < 0.05),见表 3,4。
|
|
表 3 123例食管鳞癌放化疗患者无疾病进展生存时间的单因素Cox回归分析 Table 3 Univariate Cox analysis of 123 ESCC patients treated with CRT or RT alone |
|
|
表 4 123例食管鳞癌放化疗患者总生存时间的单因素Cox回归分析 Table 4 Univariate Cox analysis of 123 ESCC patients treated with CRT or RT alone |
3.受试者工作特征曲线对疗效和生存预后的预测:NLR和NPS预测疗效的曲线下面积(the area under the curve,AUC)分别为0.655(95%CI 0.590~0.721, P=0.002)和0.671(95%CI 0.606~0.735, P<0.001);NLR和NPS预测PFS的AUC分别为0.675(95%CI 0.597~0.754, P=0.001)和0.745(95%CI 0.674~0.816, P<0.001);NLR和NPS预测OS的AUC分别为0.663(95%CI 0.591~0.734, P=0.015)和0.730(95%CI 0.664~0.797, P<0.001),说明NPS在预测胸段食管鳞癌接受放化疗患者的近期疗效和远期生存时间方面优于NLR。
讨论食管鳞癌是中国最常见的病理类型,由于发病隐匿,初诊时大多为中晚期,失去根治手术的时机,放化疗为标准治疗方案,但即使同一临床分期、并且接受相同治疗手段的患者,近期疗效与远期生存仍存在巨大差异,究其原因是目前的TNM分期仅仅是根据肿瘤自身情况进行分层判断,而忽略了很多其他非肿瘤的临床因素,而这些因素可能对患者的治疗效果或预后判断产生重要影响。
目前普遍认为,肿瘤的发生、发展是一个多因素、多阶段的过程,其预后不但与肿瘤本身有关,而且与患者的全身炎性和营养状态密切相关。治疗前血清中的炎性标志物,例如LMR、NLR或血小板与淋巴细胞比率(platelet-to-lymphocyte ratio,PLR)与许多恶性肿瘤的进展和预后密切相关[5-6]。然而,单个炎症标志物对宿主的预后判断能力由于随机确定的阈值而存在潜在的误导作用。近年来,越来越多的研究报道NPS是一种基于炎症反应及营养状态的新的预后评分方法,2017年,Galizia等[7]分析了在接受结直肠癌手术的患者中NPS对生存预后影响的临床研究,该研究包括562例结直肠癌手术患者,结果显示NPS是PFS和OS的独立预测因子;而后NPS的预测价值在骨肉瘤、胃癌和胰腺癌患者中得到了进一步的报道[8-10]。众所周知,TC、ALB、NLR和LMR是临床上常见的生物学标志物,而NPS由以上标志物所构成,因此NPS是一种容易获得、简单可靠,并且包含炎性与营养相关指标的综合预后模型。鉴于NPS的临床意义和预后在胸段食管鳞癌放化疗患者中鲜有报道,因此, 本研究分析了123例胸段食管鳞癌患者治疗前NPS对放化疗疗效及预后的影响,其中单因素及多因素logistic回归分析发现NPS和NLR是影响疗效的独立危险因素,另外,在生存曲线中发现NPS 0分组、1或2分组和3或4分组患者的1、3、5年PFS率和OS率差异有统计学意义,并且单因素及多因素Cox回归均发现NPS和NLR是生存预后的独立危险因素,但受试者工作特征曲线进一步证实NPS对疗效及预后的预测价值优于NLR,这充分说明治疗前NPS对胸段食管鳞癌放化疗患者的疗效及预后具有更佳的指导意义,究其原因是NPS综合考虑了营养因素和炎症因素与肿瘤预后的关系,在NPS系统中,血清低ALB血症不仅是营养不良的一个标志,而且也是全身炎症表现的危险因素,不仅反映肝功能不全,而且反映患者的整体免疫水平较差[11];而低TC血症影响细胞膜的流动性,能够降低细胞表面受体的跨膜信号传递能力,导致免疫活性细胞不能有效识别及杀灭肿瘤细胞[12]。LMR由淋巴细胞和单核细胞组成,而NLR由中性粒细胞和淋巴细胞组成,均与许多恶性肿瘤的预后密切相关[5-6]。因此,基于TC、ALB、NLR和LMR而构建的新的预后评分系统,NPS能够更有效地预测胸段食管鳞癌放化疗患者的近期疗效和远期生存,并优于其他单一的炎症或营养相关标志物。
恶性肿瘤患者的疗效及生存预后与炎症和营养状态密切相关,但具体机制仍不十分清楚,可能与以下因素有关:①肿瘤相关炎性细胞是肿瘤微环境的构成因素之一,能够促进肿瘤细胞增殖、侵袭和转移,在肿瘤发生发展中起着重要作用[13]。②营养不良削弱了宿主的免疫功能,导致治疗过程中感染和转移的概率增加。③营养不良可以激活全身的炎性反应,导致免疫功能下降[14]。本研究的单因素和多因素分析均显示,NPS是胸段食管鳞癌放化疗患者疗效和预后的独立影响因素,这进一步证明包含炎症指标及营养指标的NPS在恶性肿瘤生存预后方面具有重要预测价值。
总之,NPS检测简便、经济,可以作为评估胸段食管鳞癌放化疗患者疗效及预后的一种有效指标。但本研究的病例数相对较少,且为单中心、回顾性研究,在此基础上应进一步设计前瞻性临床试验以进一步验证。
利益冲突 无
作者贡献声明 郭信伟、尹小祥负责资料的收集和论文撰写;孙红娟、周绍兵、刘阳晨提出选题方向;叶宏勋、冀胜军指导论文写作和修改
| [1] |
Lin Y, Totsuka Y, He Y, et al. Epidemiology of esophageal cancer in Japan and China[J]. J Epidemiol, 2013, 23(4): 233-242. DOI:10.2188/jea.je20120162 |
| [2] |
Rice TW, Rusch VW, Ishwaran H, et al. Cancer of the esophagus and esophagogastric junction: data-driven staging for the seventh edition of the American Joint Committee on Cancer/International Union Against Cancer Cancer Staging Manuals[J]. Cancer, 2010, 116(16): 3763-3773. DOI:10.1002/cncr.25146 |
| [3] |
Zhang Y. Epidemiology of esophageal cancer[J]. World J Gastroenterol, 2013, 19(34): 5598-5606. DOI:10.3748/wjg.v19.i34.5598 |
| [4] |
Nishino M, Jagannathan JP, Ramaiya NH, et al. Revised RECIST guideline version 1.1: What oncologists want to know and what radiologists need to know[[J]. AJR Am J Roentgenol, 2010, 195(2): 281-289. DOI:10.2214/AJR.09.4110 |
| [5] |
Yodying H, Matsuda A, Miyashita M, et al. Prognostic significance of neutrophil-to- lymphocyte ratio and platelet-to-lymphocyte ratio in oncologic outcomes of esophageal cancer: a systematic review and meta-analysis[J]. Ann Surg Oncol, 2016, 23(2): 646-654. DOI:10.1245/s10434-015-4869-5 |
| [6] |
Sun Y, Zhang L. The clinical use of pretreatment NLR, PLR, and LMR in patients with esophageal squamous cell carcinoma: evidence from a meta-analysis[J]. Cancer Manag Res, 2018, 10: 6167-6179. DOI:10.2147/CMAR.S171035 |
| [7] |
Galizia G, Lieto E, Auricchio A, et al. Naples Prognostic Score, based on nutritional and inflammatory status, is an independent predictor of long-term outcome in patients undergoing surgery for colorectal cancer[J]. Dis Colon Rectum, 2017, 60(12): 1273-1284. DOI:10.1097/DCR.0000000000000961 |
| [8] |
Yang Q, Chen T, Yao Z, et al. Prognostic value of pre-treatment Naples prognostic score (NPS) in patients with osteosarcoma[J]. World J Surg Oncol, 2020, 18(1): 24. DOI:10.1186/s12957-020-1789-z |
| [9] |
Galizia G, Auricchio A, de Vita F, et al. Inflammatory and nutritional status is a predictor of long-term outcome in patients undergoing surgery for gastric cancer[J]. Ann Ital Chir, 2019, 90: 404-416. |
| [10] |
Nakagawa N, Yamada S, Sonohara F, et al. Clinical implications of Naples prognostic score in patients with resected pancreatic cancer[J]. Ann Surg Oncol, 2020, 27(3): 887-895. DOI:10.1245/s10434-019-08047-7 |
| [11] |
Xiong JP, Long JY, Xu WY, et al. Albumin-to-alkaline phosphatase ratio: A novel prognostic index of overall survival in cholangiocarcinoma patients after surgery[J]. World J Gastrointest Oncol, 2019, 11(1): 39-47. DOI:10.4251/wjgo.v11.i1.39 |
| [12] |
de Martino M, Leitner CV, Seemann C, et al. Preoperative serum cholesterol is an independent prognostic factor for patients with renal cell carcinoma (RCC)[J]. BJU Int, 2015, 115(3): 397-404. DOI:10.1111/bju.12767 |
| [13] |
Mantovani A, Allavena P, Siea A, et al. Cancer-related inflammation[J]. Nature, 2008, 454(7203): 436-444. DOI:10.1038/nature07205 |
| [14] |
Sun KY, Xu JB, Chen SL, et al. Novel immunological and nutritional-based prognostic index for gastric cancer[J]. World J Gastroenterol, 2015, 21(19): 5961-5971. DOI:10.3748/wjg.v21.i19.5961 |
 2022, Vol. 42
2022, Vol. 42


