胆道癌主要包括胆囊癌和胆管癌。2018年美国约有12 190例新诊断病例和3 790例死亡病例[1]。由于据有较强的侵袭性,胆道癌通常以病期晚、局部浸润广泛和极高的转移潜力为特征[2-3]。胆道癌预后差,虽然手术切除是唯一的潜在治愈方法,但5年生存率仅为14%~24%[2-6]。由于此类癌症总是发生在肝门附近,即使在根治性切除术后,局部复发率仍较高[7-8]。因此,对于切除术后复发风险高的胆道癌,放疗可作为一种术后辅助治疗方式。部分回顾性研究评估可切除局部晚期胆道癌患者术后放疗的生存获益,但结论却相互矛盾[2-3, 6, 9],基于这些研究数据所推断的术后放疗对这类患者的疗效是有限的。本研究利用美国国家癌症研究所(SEER)数据库中西方胆道癌患者的临床和生存资料,评估术后放疗在可切除局部晚期胆道癌患者中的作用。
资料与方法 1、资料来源SEER数据库主要收集美国癌症患者的重要临床资料,可公开用于各类癌症的流行病学和生存分析等方面研究。根据国际肿瘤学疾病分类第3版(ICD-O-3)从SEER数据库(SEER * Stat 8.3.6)中筛选出2006—2016年确诊为胆道癌的病例(C22.1-24.9)。纳入年龄在12岁及以上局部晚期(包括T3~4任何N或任何T, N+)胆道癌患者。研究的时间和年龄范围根据AJCC TMN分期的可用时间和足够的随访时间而定。
2、纳入及排除标准纳入标准:病理确诊为胆道癌,且仅存在一个原发肿瘤;接受根治性切除伴或不伴辅助放疗;有随访结果;有存活状态记录;患者的性别、种族、病理分级、诊断年龄、TNM分期、诊断年份等信息明确。排除标准:术前或术中放疗;术前和术后放疗;放疗和手术的顺序未知;非第一原发肿瘤;未知生存时间;未知年龄、治疗方式、肿瘤TNM分期等。
3、资料收集从SEER数据库中获得所有入组患者的基本信息,包括性别、种族、诊断年龄、病理分级、诊断年份、TNM分期、治疗方式和癌症特异性生存率(cancer-specific survival, CSS)。CSS的定义是从诊断时间到癌症特异性死亡的时间。胆道癌导致的死亡被定义为事件,其他原因导致的死亡被视为截尾观察。SEER数据库中种族记录分为:白种人、黑种人和其他人种。疾病分期按照AJCC TMN分期系统。根据不同的治疗方案将患者分为单纯手术组和手术+放疗组。
4、统计学处理采用倾向评分匹配方法按1 ∶1匹配[10],匹配容差为0.02,用以均衡单纯手术组和手术+放疗组之间的差异性临床病理特征,进而使回顾性研究的选择偏差最小化。统计分析采用SPSS 22进行。临床病理变量的组间比较采用χ2检验,采用Kaplan-Meier法进行生存分析。使用Log-rank检验评估CSS及每个潜在预后因素之间的关联。多因素分析使用Cox风险回归模型。根据各种临床病理变量,使用Cox比例风险模型计算与治疗方式相关的CSS的多变量调整后的危险比(hazard ratio, HR)和95%置信区间(confidence interval, CI),并计算CSS效益趋势检验的P值。所有模型都针对性别(男性、女性)、种族(白人、黑人或其他)、病理分级(Ⅰ~Ⅱ级,Ⅲ~Ⅳ级)、T分期(T1~2期,T3~4期)、N分期(N0,N+)、年龄(≤69岁,≥70岁)进行调整。P < 0.05为差异有统计学意义。
结果 1、患者基线特征自2006年至2016年,从SEER数据库中筛选出符合标准的1 922例胆囊癌和3 408例肝外胆管癌患者,其中行术后放疗的胆囊癌患者587例,肝外胆管癌患者1 072例。倾向评分匹配前后,胆囊癌患者特征分析数据见表 1,肝外胆管癌患者特征分析数据见表 2。胆囊癌患者的中位年龄为69 (22~104) 岁,肝外胆管癌患者的中位年龄为65 (12~95)岁。倾向评分匹配前,胆囊癌患者单纯手术组和手术+放疗组之间基线特征存在显著差异,主要包括T分期,N分期和年龄。肝外胆管癌患者单纯手术组和手术+放疗组之间在N分期及年龄等基线特征方面存在显著差异。经倾向评分匹配后,胆囊癌及肝外胆管癌患者的基线特征在两组间达到平衡。
|
|
表 1 胆囊癌患者倾向评分匹配前后临床特征分析 Table 1 Clinic characteristics of gallbladder carcinoma patients before and after PSM |
|
|
表 2 肝外胆管癌患者倾向评分匹配前后临床特征分析 Table 2 Clinic characteristics of patients with extrahepatic biliary duct cancer before and after PSM |
2、倾向评分匹配后不同治疗方案对患者CSS的影响
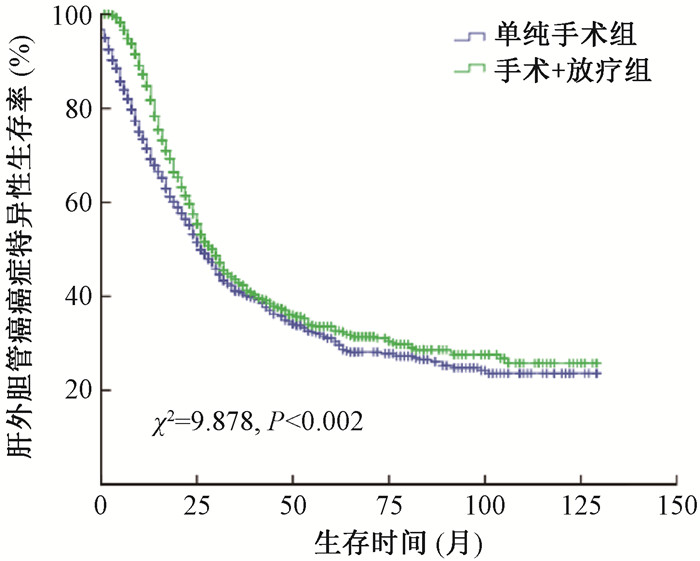
对于局部晚期胆囊癌患者,单纯手术组和手术+放疗组的5年癌症特异性生存率分别为17.5%和22.6% (χ2=35.73,P < 0.001),差异有统计学意义,见图 1。对于局部晚期肝外胆管癌患者,手术+放疗组的长期癌症特异性生存率显著优于单纯手术组,5年癌症特异性生存率分别为33.6%和30.4% (χ2=9.878,P=0.002),见图 2。调整相关协变量后,Cox多因素分析显示,病理分级、T分期、N分期、治疗方式和年龄均为胆囊癌患者和肝外胆管癌患者的独立预后因素,而种族仅为肝外胆管癌的独立预后因素,见表 3。

|
图 1 不同治疗方式局部晚期胆囊癌患者的癌症特异性生存率曲线 Figure 1 CSS curves of patients with locally advanced gallbladder cancer treated with different treatment schemes |
|
图 2 不同治疗方式局部晚期肝外胆管癌患者的癌症特异性生存率曲线 Figure 2 CSS curves of patients with locally advanced extrahepatic biliary duct cancer treated with different treatment schemes |
|
|
表 3 胆囊癌和肝外胆管癌患者多因素生存分析 Table 3 Multivariate survival analysis of patients with gallbladder cancer and those with extrahepatic biliary duct cancer |
3、不同临床病理特征中生存获益的差异
通过亚组分析,确定哪类患者可以从术后放疗中获益,结果列于表 4。在局部晚期胆囊癌患者中,T1~2期患者未能从术后放疗中获益(HR 0.794, 95% CI:0.604~1.044, P=0.099)。而在局部晚期胆道癌患者中,病理分级Ⅰ~Ⅱ级(HR 0.884, 95% CI:0.770~1.016, P=0.082)、N0 (HR 0.886, 95% CI:0.729~1.076, P=0.220)以及年龄≥70岁(HR 0.966, 95% CI:0.808~1.154, P=0.703)患者均未能从术后放疗中获益。
|
|
表 4 胆囊癌和肝外胆管癌患者与治疗方式相关的癌症特异性死亡多因素分析 Table 4 Multivariate analysis of cancer-specific death associated with treatment schemes for patients with gallbladder cancer and those with extrahepatic biliary duct cancer |
讨论
胆道癌患者在根治术后易发生局部复发,对于高复发风险患者(如淋巴结阳性和切缘阳性),建议在根治性切除术后进行局部治疗(如术后放疗)。由于胆道癌的发病率较低,患者术后放疗的安全性和有效性评估主要来自一些回顾性研究[6, 11]。相关研究通常包含胆囊癌患者或胆管癌患者,并没有对这两种癌症进行区分,然而两者的生物学特性并不相同。通过SEER数据库分别分析可切除局部晚期胆囊癌患者和肝外胆管癌患者的长期生存结果,结果显示术后放疗能改善可切除局部晚期胆囊癌和肝外胆管癌患者的5年癌症特异性生存率。研究还显示不同临床病理特征的疗效差异,T1-2期胆囊癌患者以及病理Ⅰ~Ⅱ级、N0及年龄≥70岁肝外胆管癌患者,未能从术后放疗中获益。
1973—2009年SEER数据库的研究发现,被诊断为局部晚期胆囊癌患者的比例逐渐增加[12]。对于这类患者,切缘阴性的根治性切除仍是唯一潜在治愈方法[13]。临床数据显示即使完全切除,部分胆囊癌患者仍然出现局部复发[8],这说明单纯手术是不够的。美国国立综合癌症网络(NCCN)指南建议,对于疾病分期超过T1b、阳性切缘或阳性区域淋巴结转移的胆囊癌患者应行辅助放疗[14],该建议的临床证据有限且主要基于一些回顾性研究。Wang等[15]利用SEER数据库的回顾性分析表明,胆囊癌全肿瘤切除术后放疗对患者有生存获益。Mojica等[16]进行的研究也得出一致的结果。而另外一些研究证实术后放疗对胆囊癌患者没有生存获益[17]。通过对上述研究分析后发现,上述研究中患者的临床和病理特征未进行倾向性评分匹配,这些研究的局限性可能导致某种治疗方式的作用被混淆。本研究使用倾向性评分匹配方法平衡两组患者临床病理特征后,在局部晚期胆囊癌和肝外胆管癌患者中,手术+放疗患者的长期CSS显著高于单纯手术组。这一结果与Hyder等[11]的回顾性倾向评分匹配研究结果一致,该研究发现手术+放疗组中位总生存期为18.0个月,显著优于单纯手术组,但术后放疗的生存获益不会持续较长时间。在亚组分析中发现,在诊断时有更多不良临床病理特征如T3-4分期或病理分级Ⅲ~Ⅳ级的患者,术后放疗生存获益更显著。Wang等[18]多因素Cox比例风险分析表明,胆囊癌切除术后T2或更晚分期的患者在术后放疗中获益更大。这可能由于T分期更晚,浸润范围更广,难以实现根治性切除,如行术后放疗,可取得较好的治疗效果。值得注意的是,本研究发现即使是在Ⅰ~Ⅱ级和N0级疾病中,辅助放疗也可提高患者的长期癌症特异性生存率。
1973年至2012年SEER数据库研究发现肝外胆管癌发病率稳定,而肝内胆管癌发病率呈上升趋势[19]。对于胆管癌患者,治愈的主要限制是手术切除后的局部复发。一项关于肝门部胆管癌的研究发现,接受术后放疗患者的OS显著高于仅接受手术的患者(24个月对比8个月,P < 0.01)[20]。利用SEER数据库进行的另一项研究表明,术后放疗对肝内胆管癌患者有生存获益[21]。然而,一项关于肝外胆管癌切除术后患者的回顾性分析表明辅助放疗对这些患者的生存不利[17]。本研究中发现,在倾向性评分匹配后局部晚期肝外胆管癌患者术后放疗可改善长期CSS。淋巴结阳性是多数肿瘤的不良预后因素。Tran等[3]建议对淋巴结阳性的肝内胆管癌患者应考虑术后放疗。一项荟萃分析表明对于淋巴结阳性的胆管癌患者,辅助放疗或放化疗是有益的[2],而对于淋巴结阴性的低风险患者,辅助治疗没有改善生存。与上述结果一致,在本研究中淋巴结阴性肝外胆管癌患者未观察到术后放疗的生存获益。
本研究存在一定的局限性。首先,数据库中没有重要的细节,如手术的类型、病理切除边缘、体力状况评分等病史。这些变量无法在研究中进行调整。其次,无法对具体的辐射技术进行评价,包括每日剂量、辐射场参数和总剂量等。再次,SEER数据库中没有关于化疗的具体信息,而一些研究表面术后同步放化疗可能带来生存获益[18]。最后,这项非随机回顾性分析中存在许多混杂变量,需使用倾向评分匹配来平衡单纯手术组和手术+放疗组患者的临床病理特征。尽管匹配过程使选择偏差最小化,但仍不能完全排除未知或无法测量混杂因素的可能性。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 叶爽负责整理数据、撰写论文;贝宴屏、章慧负责数据采集;郑璐、陈雪负责数据分析及图表制作;刘开泰负责选题构想和设计、论文修改
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7-30. DOI:10.3322/caac.21442 |
| [2] |
Horgan AM, Amir E, Walter T, et al. Adjuvant therapy in the treatment of biliary tract cancer: a systematic review and meta-analysis[J]. J Clin Oncol, 2012, 30(16): 1934-40. DOI:10.1200/JCO.2011.40.5381 |
| [3] |
Tran Cao HS, Zhang Q, Sada YH, et al. The role of surgery and adjuvant therapy in lymph node-positive cancers of the gallbladder and intrahepatic bile ducts[J]. Cancer, 2018, 124(1): 74-83. DOI:10.1002/cncr.30968 |
| [4] |
Anderson CD, Pinson CW, Berlin J, et al. Diagnosis and treatment of cholangiocarcinoma[J]. Oncologist, 2004, 9(1): 43-57. DOI:10.1634/theoncologist.9-1-43 |
| [5] |
Balachandran P, Agarwal S, Krishnani N, et al. Predictors of long-term survival in patients with gallbladder cancer[J]. J Gastrointest Surg, 2006, 10(6): 848-854. DOI:10.1016/j.gassur.2005.12.002 |
| [6] |
Gu B, Qian L, Yu H, et al. Concurrent chemoradiotherapy in curatively resected gallbladder carcinoma: a propensity score-matched analysis[J]. Int J Radiat Oncol Biol Phys, 2018, 100(1): 138-145. DOI:10.1016/j.ijrobp.2017.09.029 |
| [7] |
de Groen PC, Gores GJ, LaRusso NF, et al. Biliary tract cancers[J]. N Engl J Med, 1999, 341(18): 1368-1378. DOI:10.1056/NEJM199910283411807 |
| [8] |
Jarnagin WR, Ruo L, Little SA, et al. Patterns of initial disease recurrence after resection of gallbladder carcinoma and hilar cholangiocarcinoma: implications for adjuvant therapeutic strategies[J]. Cancer, 2003, 98(8): 1689-1700. DOI:10.1002/cncr.11699 |
| [9] |
Todoroki T, Ohara K, Kawamoto T, et al. Benefits of adjuvant radiotherapy after radical resection of locally advanced main hepatic duct carcinoma[J]. Int J Radiat Oncol Biol Phys, 2000, 46(3): 581-587. DOI:10.1016/s0360-3016(99)00472-1 |
| [10] |
Rosenbaum PR, Rubin DB. The bias due to incomplete matching[J]. Biometrics, 1985, 41(1): 103-116. DOI:10.2307/2530647 |
| [11] |
Hyder O, Dodson RM, Sachs T, et al. Impact of adjuvant external beam radiotherapy on survival in surgically resected gallbladder adenocarcinoma: a propensity score-matched Surveillance, Epidemiology, and End Results analysis[J]. Surgery, 2014, 155(1): 85-93. DOI:10.1016/j.surg.2013.06.001 |
| [12] |
Rahman R, Simoes EJ, Schmaltz C, et al. Trend analysis and survival of primary gallbladder cancer in the United States: a 1973-2009 population-based study[J]. Cancer Med, 2017, 6(4): 874-880. DOI:10.1002/cam4.1044 |
| [13] |
Dixon E, Vollmer CM Jr, Sahajpal A, et al. An aggressive surgical approach leads to improved survival in patients with gallbladder cancer: a 12-year study at a North American Center[J]. Ann Surg, 2005, 241(3): 385-394. DOI:10.1097/01.sla.0000154118.07704.ef |
| [14] |
Benson AB 3rd, D'Angelica MI, Abbott DE, et al. NCCN guidelines insights: hepatobiliary cancers, version 1.2017[J]. J Natl Compr Canc Netw, 2017, 15(5): 563-573. DOI:10.6004/jnccn.2017.0059 |
| [15] |
Wang SJ, Fuller CD, Kim JS, et al. Prediction model for estimating the survival benefit of adjuvant radiotherapy for gallbladder cancer[J]. J Clin Oncol, 2008, 26(13): 2112-2117. DOI:10.1200/JCO.2007.14.7934 |
| [16] |
Mojica P, Smith D, Ellenhorn J. Adjuvant radiation therapy is associated with improved survival for gallbladder carcinoma with regional metastatic disease[J]. J Surg Oncol, 2007, 96(1): 8-13. DOI:10.1002/jso.20831 |
| [17] |
Zhang H, Zhu J, Ke F, et al. Radiological imaging for assessing the respectability of hilar cholangiocarcinoma: a systematic review and Meta-analysis[J]. Biomed Res Int, 2015, 2015: 497942. DOI:10.1155/2015/497942 |
| [18] |
Wang SJ, Lemieux A, Kalpathy-Cramer J, et al. Nomogram for predicting the benefit of adjuvant chemoradiotherapy for resected gallbladder cancer[J]. J Clin Oncol, 2011, 29(35): 4627-4632. DOI:10.1200/JCO.2010.33.8020 |
| [19] |
Saha SK, Zhu AX, Fuchs CS, et al. Forty-year trends in cholangiocarcinoma incidence in the US: intrahepatic disease on the rise[J]. Oncologist, 2016, 21(5): 594-599. DOI:10.1634/theoncologist.2015-0446 |
| [20] |
Gerhards MF, van Gulik TM, González D, et al. Results of postoperative radiotherapy for resectable hilar cholangiocarcinoma[J]. World J Surg, 2003, 27(2): 173-179. DOI:10.1007/s00268-002-6434-1 |
| [21] |
Shinohara ET, Mitra N, Guo M, et al. Radiation therapy is associated with improved survival in the adjuvant and definitive treatment of intrahepatic cholangiocarcinoma[J]. Int J Radiat Oncol Biol Phys, 2008, 72(5): 1495-1501. DOI:10.1016/j.ijrobp.2008.03.018 |
 2021, Vol. 41
2021, Vol. 41


