2. 山东省肿瘤防治研究院(山东省肿瘤医院), 山东第一医科大学(山东省医学科学院)放疗科, 济南 250117;
3. 广西壮族自治区人民医院放疗科, 南宁 530021
2. Department of Radiotherapy, Shandong Cancer Hospital and Institute, Shandong First Medical University, and Shandong Academy of Medical Sciences, Jinan 250117, China;
3. Department of Radiotherapy, People's Hospital of Guangxi Zhuang Autonomous Region, Nanning 530021, China
鼻咽癌(nasopharyngeal carcinoma,NPC)是我国头颈部高发恶性肿瘤,全球发病率为1.5/10万,中国为2.3/10万[1]。放疗为NPC主要治疗方式,放疗成败的关键在于精确勾画大体肿瘤靶区(gross tumor volume, GTV)和转移淋巴结(lymph node)。多模态影像结合解剖与生物代谢信息可显著提高靶区的勾画精度[2-4]。
因原理和成像方式不同,不同图像在NPC GTV及淋巴结勾画中各有特点。计算机体层成像(CT)成像快,患者耐受性好,但软组织分辨能力差;磁共振成像(MRI)软组织分辨率高、对神经和颅内侵犯敏感性高,缺点在于扫描时间长、患者不易耐受。正电子发射计算机断层显像(PET-CT)将PET功能成像与CT解剖成像相结合,可评估并追踪NPC治疗中的代谢情况,但软组织分辨较差且高摄取区域部分容积效应显著[5-6],严重影响肿瘤靶区的勾画精度。
目前基于CT、MRI、18F-FDG PET-CT 3种图像进行鼻咽癌GTV和淋巴结勾画的对照研究鲜有报道。本研究拟对比分析CT、MRI、18F-FDG PET-CT 3种不同图像对鼻咽癌GTV及淋巴结勾画的差异,并以MRI为参考探讨基于PET自动勾画GTV时的最佳标准摄取值(standard uptake value,SUV)。
资料与方法 1、患者选择本研究已取得山东省肿瘤医院伦理委员会批准。选取2018年10月至2020年7月间,山东省肿瘤医院鼻咽癌初诊患者53例(男41例,女12例),中位年龄48岁,最大74岁,最小9岁。所有患者均行病理活检证实为鼻咽癌,角化性鳞状细胞癌、非角化癌、未分化癌分别有17、22、14例。根据美国癌症联合委员会(American Joint Committee on Cancer,AJCC)指南[7],将患者分为Ⅰ、Ⅱ、Ⅲ、ⅣA、ⅣB期,分别有4、9、24、15、1例。所有患者在治疗前已经签署知情同意书,均接受放射治疗。
2、模拟定位(1) CT模拟定位:所有患者均采取仰卧位,用头颈热塑面罩固定,在大孔径CT(Brilliance Bigbore CT,荷兰飞利浦公司)上进行CT模拟定位,扫描范围为额窦上缘至锁骨,扫描层厚3 mm,层间距3 mm,扫描模式为螺旋扫描。采用碘海醇完成强化扫描,剂量为2 ml/kg,注射速率为2 ml/s,注射50 s开始后扫描。
(2) MRI模拟定位:按与定位CT相同体位,用头颈热塑面罩固定,用GE 3.0 T超导型MR扫描仪(Discovery 750 W,美国GE公司)进行MRI模拟定位,6通道线圈,鼻咽常规采用快速自旋回波序列,进行T2压脂加权成像扫描。扫描参数:重复时间(repetition time,TR)7 059 ms,回波时间(echo time,TE)75 ms,矩阵384×384,视野(field of view,FOV)28 mm×28 mm,层厚3 mm,层间距0 mm。
(3) PET-CT扫描:使用PET扫描系统(Phillips Medical Systems,荷兰飞利浦公司),获得18F-FDG PET-CT图像。患者禁食>6 h,血糖 < 11 mmol/L,检查前禁用胰岛素。患者静脉注射4.4 MBq/kg的18F-FDG,1 h后进行CT和PET扫描。扫描范围为颅顶至双侧股骨上段。PET扫描参数:层厚4 mm,层间距4 mm,FOV 57.6 cm×57.6 cm,矩阵144×144,三维扫描。CT参数:层厚5 mm,层间距5 mm,FOV 60 cm×60 cm,矩阵512×512,螺旋扫描。
3、图像融合配准在MIM Maestro(6.8.2,美国MIM软件公司)软件中,使用基于边框辅助刚性配准的方法。在配准中,MRI为参考序列,CT、PET-CT为从属序列分别配准;在与PET相配准时以其自带的CT为配准基础。
4、靶区勾画和配准将增强CT、MRI T2压脂加权像、18F-FDG PET-CT图像均导入MIM Maestro。选择同一位研究者在3种不同图像中勾画GTV和转移淋巴结。
在MRI/CT中鼻咽癌阳性淋巴结定义: 横断面图像上淋巴结最小径≥10 mm(颌下和二腹肌淋巴结为11 mm);中央坏死或环形强化;同一区域内3个或3个以上的淋巴结呈簇状聚集,且最小直径≥8 mm;淋巴结的包膜外侵犯;咽后淋巴结:咽后外侧组淋巴结最小直径≥5 mm,任何可见的咽后内侧组淋巴结,任何大小的咽后淋巴结存在中心坏死。在PET中高摄取淋巴结勾画时取SUV为2.5[8-10]。
在CT、MRI、18F-FDG PET-CT(SUV=2.5)3种图像上分别依据标准勾画阳性淋巴结,分别命名为LymphCT、LymphMRI、LymphPET2.5,见图 1。
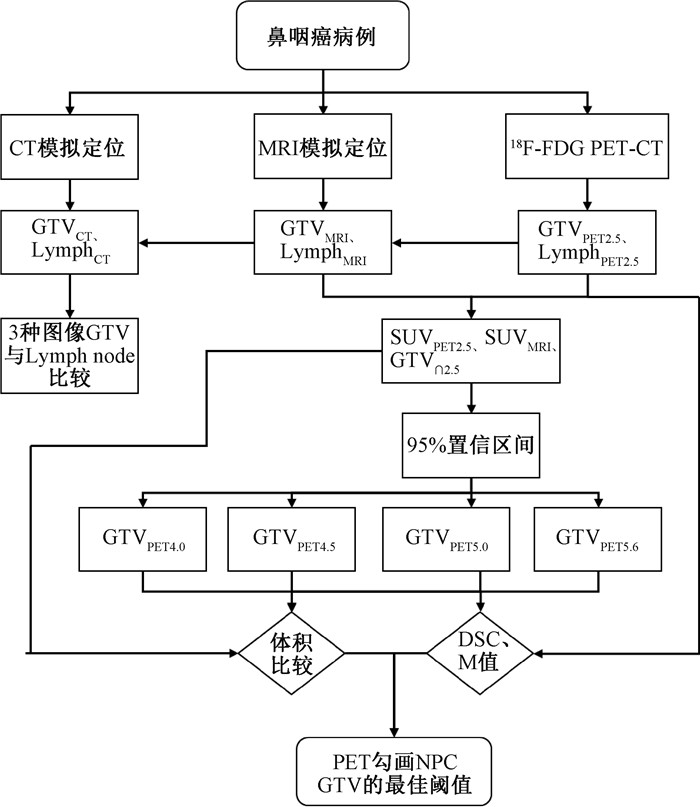
|
图 1 本研究的流程图 Figure 1 Flowchart of this study |
在CT、MRI、18F-FDG PET-CT(SUV=2.5)图像中勾画GTV并分别命名为GTVCT、GTVMRI、GTVPET2.5,将MRI与PET配准后,二者GTV相交部分定义为GTV∩2.5,不相交区域PET的SUV值命名为SUVMRI、SUVPET2.5;经过统计分析后,得到GTV∩2.5与SUVPET2.595%置信区间,选用了SUV=4.0、4.5、5.0、5.6在PET上自动勾画大体肿瘤区(GTVPET4.0、GTVPET4.5、GTVPET5.0、GTVPET5.6)。
5、数据测量与计算测量不同图像所勾画鼻咽癌GTV、淋巴结的体积。相似性系数(DSC)可以评估两种成像勾画体积的相似性,公式如下:
| $ {\rm{DSC = }}\frac{{2\left| {A \cap B} \right|}}{{\left| A \right| + \left| B \right|}} $ | (1) |
式中,A为在MRI中的勾画体积GTVMRI,cm3;B为在PET中不同阈值勾画体积,cm3。
为了进一步说明GTVMRI与PET中不同阈值勾画体积相交后得到区域与GTVMRI的差异,用M评估不同体积之间所占比例,公式如下:
| $ M = \frac{C}{A} $ | (2) |
式中,A为在MRI中的勾画体积即GTVMRI,cm3;C为PET-CT确定的各GTV与GTVMRI相交部分,cm3。
6、统计学处理数据以x±s形式表示。采用SPSS 17.0软件进行分析。3种图像GTV、淋巴结,不同阈值勾画GTV和DSC比较采用配对t检验;高摄取与无或低摄取淋巴结比较采用成组t检验。P<0.05为差异有统计学意义。
结果 1、基于CT、MRI、PET确定的GTV体积比较相对于CT、PET,MRI可以更好地显示肿瘤的边界与正常组织的差异。GTVMRI、GTVCT、GTVPET2.5平均体积分别为(28.20±23.05)、(27.72±23.08)和(35.85±33.22)cm3,GTVMRI较GTVCT平均增加了1.73%,差异无统计学意义(P>0.05),较GTVPET2.5减小21.34%,GTVMRI-GTVPET2.5、GTVCT-GTV PET2.5的差异均有统计学意义(t=-3.52、-2.88,P<0.05),详见表 1。
|
|
表 1 3种图像中的GTV比较 Table 1 Comparison of GTV in three types of images |
2、GTVMRI、GTVPET2.5、GTV∩2.5、SUVPET2.5的比较
GTV∩2.5的体积为(20.32±18.36)cm3,较GTVMRI、GTVPET2.5分别缩小27.94%、43.32%,减少的区域分布于边缘部分。GTV∩2.5的平均SUV分别较GTVMRI、GTVPET2.5高19.58%、16.48%;GTV∩2.5的SUV值和SUVPET2.595%置信区间分别为[5.59,6.67],[3.70,4.02],由此设定了阈值区间。
3、基于不同SUV值勾画的GTV比较GTVPET4.0、GTVPET4.5、GTVPET5.0、GTVPET5.6体积分别为GTV∩2.5的1.05、0.91、0.87、0.70倍,各GTV的M值中,GTVPET2.5最大(0.67±0.17),GTVPET5.6最小(0.33±0.22);GTVPET4.0的DSC值为0.78±0.27,与GTVPET2.5差异有统计学意义(t=2.88,P<0.05),详见表 2。四种阈值勾画的GTV与GTV∩2.5两两比较中,GTVPET4.0-GTV∩2.5差异无统计学意义(P>0.05),其余的差异均有统计学意义(t=-3.31、-7.64、-9.98,P<0.05),其中GTVPET4.0较GTVPET2.5减少40.47%( t=9.701,P<0.05),GTVPET4.0较GTV∩2.5增加4.8%,详见表 3。
|
|
表 2 GTVPET2.5至GTVPET5.6间的DSC和M值比较 Table 2 Comparison of DSCs and M values between GTVPET2.5 and GTVPET5.6 |
|
|
表 3 GTVPET4.0-PET5.6与GTV∩2.5比较(cm3) Table 3 Comparison between GTV PET4.0-PET5.6 and GTV∩2.5(cm3) |
4、基于MRI、CT、PET勾画淋巴结的体积比较
基于CT、MRI共勾画阳性淋巴结共200个,在PET上呈高摄取有128个,无或低摄取淋巴结有72个。高摄取淋巴结的体积(8.05±10.99)cm3为无或低摄取淋巴结体积(1.98±2.65)cm3的4.07倍,二者体积差异有统计学意义(t=5.50,P<0.05)。PET成像中LymphPET2.5(13.02±16.24)cm3体积分别是LymphMRI(8.09±11.08)cm3、LymphCT(6.95±8.92)cm3的1.61、1.87倍。基于CT、MRI、PET勾画淋巴结比较,LymphMRI-LymphPET2.5、LymphCT-LymphPET2.5差异均有统计学意义(t=-4.12、-5.18,P<0.05),LymphMRI-LymphCT差异无统计学意义(P>0.05)。
讨论放射治疗为鼻咽癌的主要治疗方式,多模态影像为鼻咽癌的精确放疗提供了多维信息[3],对肿瘤靶区的精确勾画及疗效提高具有重要意义。不同模态影像因成像原理和方式差异对肿瘤的显示存在较大的区别。本研究量化分析3种图像的鼻咽癌GTV差异,研究不同阈值下的GTV。
3种图像中GTVMRI与GTVCT基本相当,二者显著小于GTVPET2.5,这是因为MRI软组织分辨率在肿瘤边界的确定优于CT及PET[11-13],其次依据传统SUV=2.5自动勾画GTV病灶明显偏大,主要因为PET重建方式造成的空间分辨率不高及部分容积效应显著。PET-CT作为功能影像,已发挥了重要作用。有研究表明将PET-CT与MRI结合能较好指导鼻咽癌大体肿瘤区勾画,并且将PET-CT成像中的代谢信息引入GTVMRI,可实现肿瘤内部剂量安全提升,更好控制肿瘤[14-17],因此对于PET自动勾画最佳阈值的确定十分重要。
PET引导肿瘤的精确放疗已经取得良好的效果。Li等[18]针对食管癌使用4DCT、MRI、PET-CT勾画靶区的对照研究中发现使用SUV≥2.5勾画得到的体积与MRI成像中的体积相差较大,这与本研究的发现一致。林勤等[19]对鼻咽癌GTV使用不同阈值进行勾画后得出了应用最大SUV值的30%可以实现生物代谢肿瘤体积勾画,而周育夫等[20]则认为最大SUV值的40%勾画为临床较佳选择,二者的研究争议主要在于肿瘤边缘部分,这与本研究GTVMRI与GTVPET图像中GTV勾画边缘差异的发现相同。Ford等[21]在基于PET自动勾画中,设置阈值梯度,该研究表明阈值变化能导致勾画体积显著变化,并且合适的阈值依赖于病灶大小及图像重建参数。基于PET-CT图像行GTV勾画时,SUV值选择对GTV勾画的影响不能忽视,而MRI能更好的显示病灶的大小及边界,故MRI能提供较精确的边缘参考。
基于18F-FDG PET-CT勾画鼻咽癌GTV的研究中,大部分以最大摄取值的百分比来勾画靶区;就SUV值来讲,较少有研究使用绝对值进行对GTV研究[20, 22]。本研究中依据传统方法得到的GTV∩2.5,即为肿瘤病灶;由于PET图像的部分容积效应、MRI图像本身及勾画软件的分辨率等原因会造成对肿瘤边缘勾画有内收或外延现象,故GTV∩2.5和GTVMRI是略有差异的。当SUV为4.0时,GTVPET4.0的M值、DSC(0.78±0.27)虽小于GTVPET2.5,但绝对体积与GTV∩2.5基本相当,可较为真实地反映GTV范围;故在18F-FDG PET-CT图像中使用SUV=4.0来勾画鼻咽癌大体肿瘤区与MRI图像中所勾画的更接近,这与Xiang等[22]用动物实验的获得研究结论基本一致。
MRI对鼻咽癌的诊断、分期、预后十分重要[23],将MRI作参考使用不同阈值勾画GTV能更好地涵盖肿瘤信息,因此18F-FDG PET-CT中使用SUV=4.0进行勾画是可行的。GTVPET2.5与GTVMRI不能完全重合,其未重叠的部分即SUVPET2.5、SUVMRI,二者的SUV值比较中SUVMRI偏小,可能是PET成像的部分容积效应原因,造成了对SUVPET2.5高估,对SUVMRI低估的结果。
在对鼻咽癌患者淋巴结研究中,发现在PET中勾画淋巴结少于MRI与CT中的,且高摄取淋巴结体积大于无或低摄取淋巴结[24],这可能是无或低摄取淋巴结体积偏小等原因。对3种成像中的淋巴结进行了比较后发现,LymphPET2.5的体积显著大于LymphMRI、LymphCT,可能是选择2.5的阈值来勾画淋巴结不能保证较好的适形性[9],考虑在淋巴结自动勾画时参照CT、MRI对边缘进行适当修改。
在本研究对鼻咽癌GTV勾画中,CT、MRI、18F-FDG PET-CT多模态融合时,皮肤或皮下组织配准较差。主要原因为在3种影像学检查不在同一时刻扫描,CT及MRI模拟定位有体位固定装置,而PET-CT扫描时没有;其次PET-CT对软组织分辨较差。
综上所述,本研究完成了基于CT、MRI、18F-FDG PET-CT图像进行鼻咽癌GTV和淋巴结勾画的对照研究,在MRI图像上勾画GTV和淋巴结与CT及PET-CT的相比,MRI能较好显示软组织边缘,勾画体积更准确。基于PET图像不同阈值进行鼻咽癌GTV自动勾画时,当SUV=4.0的体积与GTVMRI最相近,推荐其为鼻咽癌GTV自动勾画阈值。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 章钰梅负责病例分析统计和论文撰写;巩贯忠负责选题、修改论文;曹秀娟、韩云炜、周静、陆合明负责病例搜集与指导;尹勇负责指导论文写作
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Li QX, Yang R, Wang YF, et al. MR imaging as a precise technique to evaluate skull-base tumor volume: comparison of CT, MR imaging and FDG PET from murine and clinical data[J]. J Craniomaxillofac Surg, 2020, 48(1): 105-110. DOI:10.1016/j.jcms.2019.12.007 |
| [3] |
Zhu R, Li XF, Zhang XL, et al. MRI and CT medical image fusion based on synchronized-anisotropic diffusion model[J]. IEEE Access, 2020, 8: 91336-91350. DOI:10.1109/access.2020.2993493 |
| [4] |
刘秀建, 冯兴义, 郑自刚, 等. PET-CT与MRI诊断中国人鼻咽癌转移的Meta分析[J]. 生物医学工程与临床, 2014, 18(1): 35-38. Liu XJ, Feng XY, Zheng ZG, et al. Meta-analysis diagnosis of PET-CT and MRI for nasopharyngeal carcinoma metastasis in Chinese[J]. Biomed Eng Clin Med, 2014, 18(1): 35-38. |
| [5] |
Nayak U, Prasad RS, Sekhar S. Clinical radiology of head and neck tumors[M]. Singapore: Springer, 2018.
|
| [6] |
Huang SH, Chien CY, Lin WC, et al. A comparative study of fused FDG PET/MRI, PET/CT, MRI, and CT imaging for assessing surrounding tissue invasion of advanced buccal squamous cell carcinoma[J]. Clin Nucl Med, 2011, 36(7): 518-525. DOI:10.1097/RLU.0b013e318217566f |
| [7] |
Amin MB. American Joint Committee on Cancer staging manual. 8th ed[M]. New York: Springer, 2017.
|
| [8] |
项红霞, 黎静. 鼻咽癌淋巴结转移诊断标准的研究进展[J]. 现代肿瘤医学, 2013, 21(5): 1140-1142. Xiang HX, Li J. Research progression of diagnostic criteria of nasopharyngeal carcinoma lymph node metastasis[J]. J Mod Oncol, 2013, 21(5): 1140-1142. DOI:10.3969/j.issn.1672-4992.2013.05.68 |
| [9] |
Wang D, Schultz CJ, Jursinic PA, et al. Initial experience of FDG-PET/CT guided IMRT of head-and-neck carcinoma[J]. Int J Radiat Oncol Biol Phys, 2006, 65(1): 143-151. DOI:10.1016/j.ijrobp.2005.11.048 |
| [10] |
Antoch G, Vogt FM, Freudenberg LS, et al. Whole-body dual-modality PET/CT and whole-body MRI for tumor staging in oncology[J]. JAMA, 2003, 290(24): 3199-3206. DOI:10.1001/jama.290.24.3199 |
| [11] |
Hanna E, Vural E, Prokopakis E, et al. The sensitivity and specificity of high-resolution imaging in evaluating perineural spread of adenoid cystic carcinoma to the skull base[J]. Arch Otolaryngol Head Neck Surg, 2007, 133(6): 541-545. DOI:10.1001/archotol.133.6.541 |
| [12] |
Chung NN, Ting LL, Hsu WC, et al. Impact of magnetic resonance imaging versus CT on nasopharyngeal carcinoma: primary tumor target delineation for radiotherapy[J]. Head Neck, 2004, 26(3): 241-246. DOI:10.1002/hed.10378 |
| [13] |
Rumboldt Z, Gordon L, Gordon L, et al. Imaging in head and neck cancer[J]. Curr Treat Options Oncol, 2006, 7(1): 23-34. DOI:10.1007/s11864-006-0029-2 |
| [14] |
Thiagarajan A, Caria N, Sch der H, et al. Target volume delineation in oropharyngeal cancer: impact of PET, MRI, and physical examination[J]. Int J Radiat Oncol Biol Phys, 2012, 83(1): 220-227. DOI:10.1016/j.ijrobp.2011.05.060 |
| [15] |
Prestwich RJ, Sykes J, Carey B, et al. Improving target definition for head and neck radiotherapy: a place for magnetic resonance imaging and 18-fluoride fluorodeoxyglucose positron emission tomography?[J]. Clin Oncol, 2012, 24(8): 577-589. DOI:10.1016/j.clon.2012.04.002 |
| [16] |
Decazes P, Hapdey S, Larnaudie A, et al. PET technology: latest advances and potential impact on radiotherapy[J]. Cancer Radiother, 2020, 24(6-7): 628-634. DOI:10.1016/j.canrad.2020.07.006 |
| [17] |
Deantonio L, Beldì D, Gambaro G, et al. FDG-PET/CT imaging for staging and radiotherapy treatment planning of head and neck carcinoma[J]. Radiat Oncol, 2008, 3: 29. DOI:10.1186/1748-717X-3-29 |
| [18] |
Li H, Li F, Li J, et al. Comparison of gross target volumes based on four-dimensional CT, positron emission tomography-computed tomography, and magnetic resonance imaging in thoracic esophageal cancer[J]. Cancer Med, 2020, 9(15): 5353-5361. DOI:10.1002/cam4.3072 |
| [19] |
林勤, 吴华, 朱鹭超, 等. FDG PET-CT与MRI在鼻咽癌原发灶靶区勾画中的对比研究[J]. 中华放射肿瘤学杂志, 2012, 21(6): 492-495. Lin Q, Wu H, Zhu LC, et al. Comparative study of gross tumor volume shown on MRI and FDG PET/CT of nasopharyngeal carcinoma[J]. Chin J Radiat Oncol, 2012, 21(6): 492-495. DOI:10.3760/cma.j.issn.1004-4221.2012.06.003 |
| [20] |
周育夫, 张亚军, 孙谦, 等. PET/CT与MRI/CT在鼻咽癌原发灶靶区勾画中的可行性研究[J]. 安徽医学, 2017, 38(7): 837-840. Zhou YF, Zhang YJ, Sun Q, et al. Comparative study of gross tumor volume shown on FDG PET/CT and MRI/CT of nasopharyngeal carcinoma[J]. Anhui Med J, 2017, 38(7): 837-840. DOI:10.3969/j.issn.1000-0399.2017.07.005 |
| [21] |
Ford EC, Kinahan PE, Hanlon L, et al. Tumor delineation using PET in head and neck cancers: threshold contouring and lesion volumes[J]. Med Phys, 2006, 33(11): 4280-4288. DOI:10.1118/1.2361076 |
| [22] |
Xiang ZQ, Imani S, Hu Y, et al. Comparison of different images in gross target volume delineating on VX2 nasopharyngeal transplantation tumor models[J]. J Cancer, 2020, 11(5): 1104-1114. DOI:10.7150/jca.36076 |
| [23] |
Abdel Khalek Abdel Razek A, King A. MRI and CT of nasopharyngeal carcinoma[J]. AJR Am J Roentgenol, 2012, 198(1): 11-18. DOI:10.2214/AJR.11.6954 |
| [24] |
Gan Q, Stewart JM, Valik E, et al. Cytologic evaluation of positron emission tomography-computed tomography-positive lymph nodes sampled by fndobronchial ultrasound-guided transbronchial needle aspiration: experience at a large cancer center[J]. Arch Pathol Lab Med, 2019, 143(10): 1265-1270. DOI:10.5858/arpa.2018-0483-OA |
 2021, Vol. 41
2021, Vol. 41


