2. 盐城市第一人民医院放疗科 224006;
3. 苏州市立医院放疗科 215002;
4. 苏州大学第二附属医院放疗科 215004
2. Department of Radiotherapy and Oncology, Yancheng No. 1 People's Hospital, Yancheng 224006, China;
3. Department of Radiotherapy and Oncology, Nanjing Medical University Affiliated Suzhou Hospital, Suzhou 215002, China;
4. Department of Radiotherapy and Oncology, Second Affiliated Hospital of Soochow University, Suzhou 215004, China
放射治疗是儿童脑部肿瘤的重要治疗手段,随着现代化放疗技术的应用以及综合治疗的不断进步,患者生存期普遍延长,但也带来神经系统的不良反应[1-2]。放射性认知障碍是最严重的不良反应之一,多表现为依赖海马的学习、记忆和空间处理能力下降[3]。海马是学习和记忆的组织学基础,也是认知功能形成过程的关键环节,并且是放射敏感区域。海马组织中神经突触可塑性有利于脑组织接受新的信息,适应微环境的刺激,对脑组织的损伤恢复具有积极作用。树突棘是神经元突触可塑性的结构基础,其结构和密度的变化对突触功能有显著的影响。因此,了解全脑放疗后幼鼠发生学习和记忆障碍时海马不同脑区,如齿状回(dentate gyrus, DG)区颗粒神经元和CA1区锥体神经元树突棘密度和形态学是否及如何改变具有重要意义。为此,本研究观察电离辐射对海马DG区和CA1区神经元树突棘形态、结构及记忆相关蛋白的影响,为深入地研究幼鼠放射性认知损伤提供形态学依据。
材料与方法 1、实验动物及材料100只21 d龄健康雄性Sprague-Dawley(SD)大鼠,体重50~60 g(苏州大学实验动物中心提供,合格证号201507460),置于SPF环境中按标准实验条件饲养。所有实验程序均符合苏州大学动物保健与伦理委员会相关规定。FD Rapid GolgiStainTM KitPK401(美国FD NeuroTechnologies公司)。一抗:兔源PSD95(1 ∶1 000,美国Abcam公司),兔源Drebrin(1 ∶1 000,美国Abcam公司);二抗:生物素化羊抗兔(1 ∶10 000,上海碧云天生物技术有限公司)。
2、动物分组及实验模型制备大鼠适应性饲养3 d后分为健康对照组(0 Gy)和照射组(10 Gy),每组50只。采用直线加速器(荷兰Philips公司,SL-18型)产生的4 MeV电子线作单次全脑照射,吸收剂量率为200 cGy/min,源皮距为100 cm,电子线限光筒为20 cm×20 cm。电子线铅模采用带有10个2.0 cm × 3.5 cm照射孔自制模具。SD大鼠经3.6%(360 mg/kg)水合氯醛腹腔麻醉后,俯卧位垂直全脑照射,照射野上界位于双眼后眦连线,下界位于双耳后连线,左右露空,用铅块屏蔽大鼠暴露于照射孔内的眼睛和身体其他部位。
3、Morris水迷宫实验分别于照射结束后第1、3个月进行认知功能检测,包括定向航行实验和空间探索实验。定向航行实验:连续进行5 d,每天1次。实验时,将大鼠面向池壁,分别从4个入水点将大鼠轻轻滑入水中,记录大鼠从入水到找到隐匿在水面下的平台的时间,记为潜伏期。通过视频分析系统记录其游泳的路程、游泳的速度及潜伏期。空间探索实验:定向航行实验完成后24 h进行空间探索实验,移除隐匿于第二象限水面下的平台,固定将大鼠均从第一象限入水点放入水中,记录30 s内大鼠在第二象限的时间占总时间的百分比及在第二象限的路程占总路程的百分比。
4、树突棘密度及形态分析Golgi染色后利用正置显微镜(德国Leica公司,DM500型)进行观察和图像采集。选取海马DG和CA1区的神经元树突棘计数,在40倍物镜下,随机观察海马CA1区顶树突和底树突三级分支和DG区10个颗粒细胞二级分支上的树突棘,每组共20个神经元,采集图像,每个树突随机计数50 μm长度范围内树突棘的数量。应用Image J软件进行计数分析。神经元细胞符合下述标准方可计数:树突未被截断;树突呈现连续性高尔基染色;被测量树突应与邻近树突保持间距保证测量不受干扰。树突棘形态分为下述类型:短粗型突棘,柄部粗而短,头部与柄部直径相差不大,其连接处无明显收缩;细长型树突棘,有一个较小的头部和狭窄的颈部,柄部比较长;蘑菇状树突棘,柄部比较粗,而头部比较大。
5、Western blot检测应用3.6%水合氯醛将大鼠安乐死后断头,钝性剥离海马,将组织块置于500 μl RIPA强裂解液及1 μl苯甲基磺酰氟(PMSF)的混合液中(均购自上海碧云天生物技术有限公司),超声匀浆提蛋白,总蛋白(25~40 μg),经10%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后转至聚偏二氟乙烯(PVDF)膜,用5%脱脂奶粉中,室温封闭1 h,一抗4℃冰箱过夜,次日用等渗缓冲盐溶液(TBST)洗脱,加入二抗密封,室温摇床孵育1 h后应用TBST连续洗脱,加入电化学发光液显影。应用Image J软件进行目标条带的灰度值分析。
6、统计学处理采用SPSS 17.0软件进行分析处理。所有计量资料以x±s表示,根据数据的正态分布和方差齐性选择合适的方法,采用独立样本的t检验或非参数检验进行组间比较。P < 0.05为差异有统计学意义。
结果 1、认知功能检测全脑照射后1个月,健康对照组与照射组在定向航行和空间探索实验中表现无明显差异(图 1)。但是在照射后3个月,定向航行实验结果显示,随着训练天数的延长,第5天照射组大鼠到达平台的潜伏期较健康对照组长,差异有统计学意义[(25.15±3.40)s vs. (16.19±2.0)s,t=-2.267,P < 0.05)(图 1B)]。空间探索实验结果显示,健康对照组与照射组大鼠在目标象限停留的时间占总探索时间的比例分别为(27.97±1.31)和(21.62±1.20)(t=3.589,P < 0.05),穿越平台次数分别为(3.31±0.23)和(2.05±0.29)次,(t=3.455,P < 0.05)。
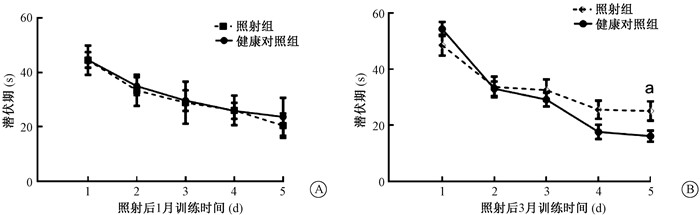
|
注:a与健康对照组比较,t=-2.267,P < 0.05 图 1 Morris水迷宫实验 A. 照射后1个月逃避潜伏期;B. 照射后3个月逃避潜伏期 Figure 1 Morris Water Maze test of irradiated rats A. Escape latencies at 1 month after irradiation; B. Escape latencies at 3 month after irradiation |
2、电离辐射对海马神经元树突棘密度的影响
照射后海马DG区树突棘密度显著降低,1和3个月后分别降低了39.06%和29.27%(t=14.96、12.35,P < 0.05)(图 2)。海马CA1区神经元底树突的树突棘密度在照射后1个月降低了33.40%(t=10.39,P < 0.05),而在照射后3个月其树突棘密度无明显变化。然而电离辐射后1和3个月海马CA1区顶树突的树突棘密度均无明显变化,见图 2。
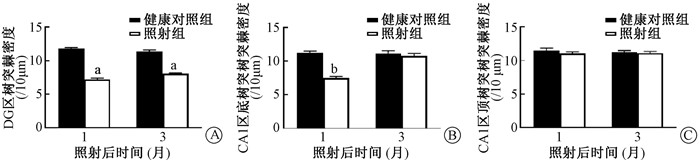
|
注:与同一时间健康对照组比较,at=14.96、12.35,P < 0.05;与同一时间健康对照组比较,bt=10.39,P < 0.05 图 2 全脑照射对海马DG区和CA1区树突棘密度随时间变化 A. DG区树突棘密度变化;B. CA1区底树突棘密度变化;C. CA1区顶树突棘密度变化 Figure 2 Time response of the changes of dendritic spine density in DG and CA1 areas of hippocampus after whole brain irradiation of rats A. Changes of dendritic spine density in DG area; B. Density change of basal dendritic spines in CA1 area; C. Density change of apical dendritic spines in CA1 region |
3、电离辐射对海马区树突棘形态变化的影响
电离辐射后SD大鼠海马DG区的蘑菇型树突棘比例在照射后1和3个月均降低,1月后降低达5.00%(t=-2.38,P < 0.05);细长型树突棘在照射后1个月无显著变化,但在照射后3月其比例降低5.62%(t=2.30,P < 0.05);短粗型树突棘在照射后1个月比例增加5.72%(t=-2.57,P < 0.05),3个月后增加6.87%(t=-3.45,P < 0.05,见图 3)。
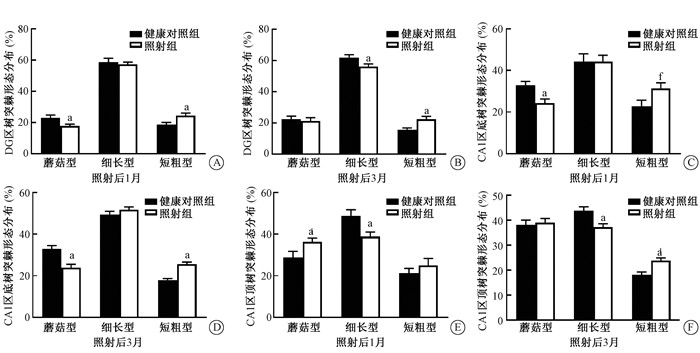
|
注:与同一类型健康对照组比较,at=-2.38、-2.57、2.30、-3.45、3.13、-2.22、3.80、-5.84、-2.16、2.69、2.69、-3.50,P < 0.05 图 3 全脑照射后海马DG区和CA1区神经元树突棘形态的变化 A、B. 照射后1、3个月海马DG区神经元树突棘形态分布;C、D. 照射后1、3个月海马CA1区神经元底树突棘形态分布;E、F. 照射后1、3个月海马CA1区神经元顶树突棘形态分布 Figure 3 Morphological changes of dendritic spines in DG and CA1 neurons of hippocampus after whole brain irradiation of rats A, B. Morphological subtypes of dendritic spines in hippocampal DG neurons 1 and 3 months after irradiation; C, D. Morphological subtypes of basal dendritic spines in hippocampal CA1 neurons at 1 and 3 months after irradiation; E, F. Morphological subtypes of apical dendritic spines in hippocampal CA1 region at 1 and 3 months after irradiation |
电离辐射后1和3个月CA1区底树突的细长型树突棘比例无明显变化;而蘑菇型树突棘在照射后1个月降低8.59%(t=3.13,P < 0.05),3个月后降低8.89%(t=3.80,P < 0.05);短粗型树突棘在照射后1个月增加8.57%(t=-2.22,P < 0.05),3个月后增加7.78%(t=-5.84,P < 0.05,见图 3)。
尽管CA1区顶树突的树突棘密度在照射前后无明显变化,但是其树突棘形态比例在照射后1和3个月均发生了明显变化,蘑菇型树突棘在照射后1个月增加7.5%(t=-2.16,P < 0.05),3个月后无差异;细长型树突棘比例在照射后1个月减少10.00%(t=2.69,P < 0.05),3个月后减少6.57%(t=3.10,P < 0.05);而短粗型树突棘在照射后1个月略有增高,但在照射后3个月明显增加5.62%(t=-3.50,P < 0.05,见图 3)。
4、电离辐射对海马组织中突触后致密蛋白95(PSD95)的影响PSD95在树突棘形态和重塑具有十分重要的作用,结果显示电离辐射后1个月,大鼠海马组织中PSD95蛋白含量降低了24.6%(t=2.97,P < 0.05),3个月后PSD95蛋白含量进一步降低50.5%(t=9.27,P < 0.05,见图 4)。
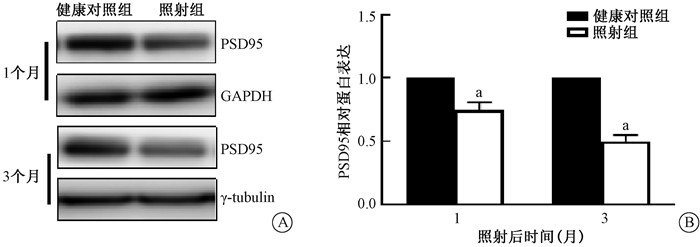
|
注:与健康对照组比较,at=2.97、9.27,P < 0.05 图 4 全脑照射对海马区PSD95蛋白表达的影响 A.电泳图;B.蛋白相对表达量 Figure 4 Effect of whole brain irradiation on the expression of PSD95 protein in hippocampus. A. Western blot assay; B. Relative expression level of PSD95 protein |
讨论
近20年来,国内外多个课题组已经成功建立了啮齿类动物颅脑照射的实验模型,研究结果显示实验动物的年龄、照射剂量、照射范围以及照射后观察的时间是影响实验动物放射性认知功能障碍检测的重要影响因素[4-6]。临床发现放疗时的年龄可能是导致脑部肿瘤患者出现远期认知功能障碍的重要危险因素之一。动物研究证实采用单次剂量10 Gy照射成年鼠后3个月Morris水迷宫测试并未检测到认知功能障碍[7],而10 d龄小鼠在接受0.5 Gy照射后就已经出现明显认知功能损伤[8]。本实验结果显示,给予出生21 d龄SD大鼠全脑10 Gy照射后3个月Morris水迷宫测试电离辐射对认知功能的影响,再次证实接受照射疗时的年龄是发生放射性认知功能障碍的重要影响因素。
行为学的改变必定有相应的物质基础,突触联系和突触传递的直接解剖结构就是树突棘,因此,了解电离辐射对树突棘的影响,可为了解放射性认知功能障碍的研究提供形态学依据。DG区和CA区是海马组织中两个重要的脑区,有研究报道给予损伤刺激后DG区颗粒神经元和CA1区锥体神经元的会发生不同的反应[9],因此研究电离辐射对这两个区域神经元的影响对于明确海马在认知功能中具有重要作用。
树突棘是中枢神经系统中主要的兴奋性信号接入点,其密度和形态学的改变可导致其突触水平的差异。从树突棘的形态可以预测出树突棘的稳定性和突触能力,一些体内研究也证实突触结构可塑性与学习和记忆能力相关[10-11]。Golgi染色在观察神经元的形态细节尤其是树突棘方面,具有可靠性和灵敏性。本研究发现,给予出生21 d龄的SD大鼠全脑照射后1个月其DG区树突棘密度降低了39.06%,CA1区的底树突棘密度降低了33.40%,这与Chakraborti等[12]的研究结果DG区树突棘密度降低了26.9%、CA1区底树突棘密度无变化相比存在差异,其原因可能在于本实验中采用幼鼠,而他们的实验对象为2月龄成年鼠,提示幼鼠海马区的树突棘对电离辐射更加敏感,更易脱落。此外,本研究的观察点直至照射后3个月,此时间点虽然CA1区树突棘密度有所恢复,与健康对照组相比差异无统计学意义,但是DG区树突棘密度仍低于正常水平,说明电离辐射对幼鼠树突棘密度的影响呈长期持续性,棘突数量的下降必然引起学习记忆相关的信息传递系统功能受损,导致大鼠学习记忆能力全面下降,这可能也是幼鼠发生认知功能损伤程度较重的一个可能因素。
树突棘的形态可以预测出树突棘的稳定性及突触能力,大的树突棘易于形成强有力的突触,而小的树突棘形成较弱的突触[13]。本研究表明幼鼠海马DG区和CA1区树突棘形态均受到电离辐射的影响,即使CA1区顶树突的树突棘密度未发生改变,但是其形态已发生了变化。与Chakraborti等[12]的研究结果蘑菇型树突棘更易受到电离辐射的影响不同,本研究观察到幼鼠受到电离辐射后1和3个月,各种类型的树突棘均处于活跃的动态变化中。其中DG区和CA1区蘑菇型树突棘在上述观察点呈持续降低状态,现有的观点认为蘑菇型树突棘含有更多的突触后致密物,其主要作用与记忆能力长期、稳定记忆能力的调节密切相关[14]。同时发现照射后1和3个月DG和CA1区短粗型树突棘比例明显增加。尽管对短粗型树突棘功能尚不明确,但是从其结构上分析,多巴胺受体位于树突棘颈部,而短粗型树突棘缺乏颈部[15],既往的研究已证实电离辐射可以影响大脑内多巴胺进程,有学者据此推断这种长期影响的后果可能导致放射性认知功能障碍的发生。细长型树突棘其结构可塑性更强,被称为“学习型树突棘”[16]。射线造成“学习型树突棘”比例降低时,神经元顶树突形成新突触能力也降低。电离辐射后海马区树突棘密度降低,树突棘形态发生改变,这种长期改变影响中枢神经系统修复,可使得认知功能障碍逐渐加重并难以逆转。本研究结果首次证实幼鼠在全脑照射后3个月仍有这种变化,这可能是受照射时年龄越小,其放射性损伤程度加重的原因。
突触后致密蛋白PSD95可促进新树突棘的形成来诱发和增强突触可塑性,在记忆形成与固化过程中起重要作用,其表达异常可能会导致突触功能障碍,出现海马依赖的学习记忆功能的缺陷[17-18]。本实验结果与之相一致,本研究结果表明幼鼠给予全脑照射后1、3个月PSD95表达仍低于正常水平,提示PSD95的表达减少可能通过影响树突棘的密度及形态结构造成突触可塑性的改变,导致认知功能障碍。其机制可能与电离辐射造成海马神经元的损伤,神经递质的释放减少,突触传递的效能减弱,即突触可塑性功能减退有关。
本研究首次报道在幼鼠在电离辐射后海马不同脑区树突棘密度及形态学变化,提示电离辐射后树突棘及其结构的损伤可能参与了放射性认知功能障碍的发生,希望能为更深入地研究儿童放射性认知功能障碍提供更详尽直接的形态学依据。但是本研究只是初步探索了电离辐射导致幼鼠学习记忆下降及海马不同脑区树突棘密度、形态及相关突触蛋白的变化,缺乏相关分子机制的探讨,这需要在以后的工作中进一步明确。
利益冲突 无
志谢 感谢姑苏卫生人才项目(GSWS2020067)对本研究的资助
作者贡献声明 丁昕、吴昊昊负责实验操作、数据分析和论文撰写;冀胜军指导实验;田野指导整体实验设计,修改论文
| [1] |
Cekanaviciute E, Rosi S, Costes SV. Central nervous system responses to simulated galactic cosmic rays[J]. Int J Mol Sci, 2018, 19(11): 3669. DOI:10.3390/ijms19113669 |
| [2] |
Wagner AP, Carroll C, White SR, et al. Long-term cognitive outcome in adult survivors of an early childhood posterior fossa brain tumour[J]. Int J Clin Oncol, 2020, 25(10): 1763-1773. DOI:10.1007/s10147-020-01725-7 |
| [3] |
Robbins M, Greeneschloesser D, Peiffer AM, et al. Radiation-induced brain injury: a review[J]. Front Oncol, 2012, 2: 73. DOI:10.3389/fonc.2012.00073 |
| [4] |
Yang L, Yang J, Li G, et al. Pathophysiological responses in rat and mouse models of radiation-induced brain injury[J]. Mol Neurobiol, 2017, 54(2): 1022-1032. DOI:10.1007/s12035-015-9628-x |
| [5] |
Forbes ME, Paitsel M, Bourland JD, et al. Early-delayed, radiation-induced cognitive deficits in adult rats are heterogeneous and age-dependent[J]. Radiat Res, 2014, 182(1): 60-71. DOI:10.1667/RR13662.1 |
| [6] |
Sun R, Zhang LY, Chen LS, et al. Long-term outcome of changes in cognitive function of young rats after various/different doses of whole brain irradiation[J]. Neurol Res, 2016, 38(7): 647-654. DOI:10.1080/01616412.2016.1188483 |
| [7] |
Raber J, Rola R, LeFevour A, et al. Radiation-induced cognitive impairments are associated with changes in indicators of hippocampal neurogenesis[J]. Radiat Res, 2004, 162(1): 39-47. DOI:10.1667/rr3206 |
| [8] |
Eriksson P, Fischer C, Stenerlöw B, et al. Interaction of gamma-radiation and methyl mercury during a critical phase of neonatal brain development in mice exacerbates developmental neurobehavioural effects[J]. Neurotoxicology, 2010, 31(2): 223-229. DOI:10.1016/j.neuro.2010.01.002 |
| [9] |
Alkadhi KA. Cellular and molecular differences between area CA1 and the dentate gyrus of the hippocampus[J]. Mol Neurobiol, 2019, 56(9): 6566-6580. DOI:10.1007/s12035-019-1541-2 |
| [10] |
Raven F, Van der Zee EA, Meerlo P, et al. The role of sleep in regulating structural plasticity and synaptic strength: Implications for memory and cognitive function[J]. Sleep Med Rev, 2018, 39: 3-11. DOI:10.1016/j.smrv.2017.05.002 |
| [11] |
Moczulska KE, Tinter-Thiede J, Peter M, et al. Dynamics of dendritic spines in the mouse auditory cortex during memory formation and memory recall[J]. Proc Natl Acad Sci USA, 2013, 110(45): 18315-18320. DOI:10.1073/pnas.1312508110 |
| [12] |
Chakraborti A, Allen A, Allen B, et al. Cranial irradiation alters dendritic spine density and morphology in the hippocampus[J]. PLoS One, 2012, 7(7): e40844. DOI:10.1371/journal.pone.0040844 |
| [13] |
Guo Y, Zou G, Qi K, et al. Simvastatin impairs hippocampal synaptic plasticity and cognitive function in mice[J]. Mol Brain, 2021, 14(1): 41. DOI:10.1186/s13041-021-00758-x |
| [14] |
Avila JA, Alliger AA, Carvajal B, et al. Estradiol rapidly increases GluA2-mushroom spines and decreases GluA2-filopodia spines in hippocampus CA1[J]. Hippocampus, 2017, 27(12): 1224-1229. DOI:10.1002/hipo.22768 |
| [15] |
Fox ME, Chandra R, Menken MS, et al. Dendritic remodeling of D1 neurons by RhoA/Rho-kinase mediates depression-like behavior[J]. Mol Psychiatry, 2020, 25(5): 1022-1034. DOI:10.1038/s41380-018-0211-5 |
| [16] |
von Bohlen Und Halbach O. Structure and function of dendritic spines within the hippocampus[J]. Ann Anat, 2009, 191(6): 518-531. DOI:10.1016/j.aanat.2009.08.006 |
| [17] |
Erli F, Palmos AB, Raval P, et al. Estradiol reverses excitatory synapse loss in a cellular model of neuropsychiatric disorders[J]. Transl Psychiatry, 2020, 10(1): 16. DOI:10.1038/s41398-020-0682-4 |
| [18] |
Dore K, Malinow R. Elevated PSD-95 blocks ion-flux independent LTD: a potential new role for PSD-95 in synaptic plasticity[J]. Neuroscience, 2021, 456: 43-49. DOI:10.1016/j.neuroscience.2020.02.020 |
 2021, Vol. 41
2021, Vol. 41


