2. 锦州医科大学基础医学院 121000;
3. 锦州医科大学生命科学院 121000
2. School of Basic Medicine, Jinzhou Medical University, Jinzhou 121000, China;
3. School of Life Sciences, Jinzhou Medical University, Jinzhou 121000, China
放射治疗,常作为治疗头颈部恶性肿瘤(如鼻咽癌、扁桃体癌、中耳癌、腮腺癌等)的重要手段。在放射治疗中,患者的颞骨区包括耳均在放射野内,故可发生听觉传导通路的一系列损伤,导致永久性的听力减退[1],但听力减退的发病机制目前不清。研究表明,听功能减退与带状突触密切相关。带状突触位于内毛细胞和螺旋神经元之间,并且是两者间的主要结构,带状突触的数量、形态、结构和功能变化异常会导致感音神经性耳聋[2]。有学者认为电离辐射造成的听功能损害,不仅与内毛细胞和螺旋神经元有关,带状突触可能也是电离辐射的重要损伤部位。CtBP2和RIBEYE各自具有独特的启动子和N末端区域,但它们共享相同的C末端域,共同组成带状突触的结构。耳畸蛋白(Otoferlin)是内毛细胞带状突触前膜的组成部分,主要促进突触囊泡于脂膜融合,然后释放神经递质,在维持听功能上发挥重要作用。AP-2蛋白在成年小鼠耳蜗中主要表达于内毛细胞突触活化部位。突触囊泡回收的主要途径目前普遍认为是CME途径,而AP-2是参与CME这一途径的关键蛋白,介导耳蜗突触囊泡内吞。本实验通过标记突触前膜特异性受体蛋白CtBP2及对突触相关功能蛋白otoferlin、AP-2进行半定量分析来证实放射对带状突触的损伤。
目前,放射性听力损伤尚无有效的治疗药物。α-硫辛酸(α-lipoic acid,LA)是一种强效抗氧化剂,对药物(如氨基糖甙类抗生素等)所致的内耳损伤具有保护作用。研究报道,LA具有显著保护神经元和突触的生物学作用[3-4]。本实验旨在通过观察小鼠耳蜗带状突触的数量和功能的变化,探讨LA对电离辐射导致的内耳损伤的保护作用。
材料与方法 1、试剂α-硫辛酸粉剂(锦州医科大学生理实验室提供);鼠抗CtBP-2多克隆抗体(美国BD公司);兔抗otoferlin多克隆抗体、兔抗AP-2多克隆抗体(武汉博士徳生物工程有限公司);免疫荧光化学染色试剂盒(锦州医科大学生理实验室提供);蛋白质印记检测所需相关试剂(锦州医科大学科学实验中心提供);HRP标记的山羊抗兔IgG、HRP标记的羊抗鼠IgG(美国EARTH公司);TRITC标记鬼笔环肽(上海翊圣生物科技有限公司)。
2、实验动物及分组选用2个月龄BABL/c小鼠(雄)50只,体重18~22 g,无外耳和中耳疾病,听性脑干反应(ABR)评估证实听力正常,由北京维通利华公司提供(合格证号:190327268541)。随机区组法将小鼠随机分为以下5组:健康对照组、照射3 d组、照射3 d+LA组、照射14 d组和照射14 d+LA组,每组10只。照射3 d组和照射14 d组小鼠给予16 Gy一次性照射,于照后第3、14天处死;照射3 d+LA组和照射14 d组+LA组小鼠在照射前3 d至处死当天连续给予α-硫辛酸(75 mg/kg),腹腔注射每日1次,照射当天行16 Gy一次性照射;健康对照组在相同时间点给予等量生理盐水注射。所有小鼠在照射和处死前进行ABR评估听力。耳蜗基底膜铺片后,免疫荧光法标记突触前膜受体蛋白ctBP2,观察带状突触数量变化。Western blot对突触囊泡功能相关蛋白otoferlin、AP-2表达水平进行半定量分析。
3、照射方法使用RS2000pro生物学X射线辐照仪(美国RAD SOURCE公司)进行照射。小鼠1%戊巴比妥钠90 mg/kg经腹腔麻醉后,使小鼠侧卧,置于防护罩内以屏蔽小鼠其他部位,仅暴露头部。照射野1.5 cm×1.5 cm,源皮距40 cm,置于反射体中,能量160 kVp吸收剂量率1.16 Gy/min,一次性16 Gy。
4、ABR阈值检测小鼠经腹腔麻醉后,应用听觉诱发电位-耳声发射记录系统(美国智听公司)给予短纯音(tone burst)刺激,选取8、12、24、32 kHz共4个刺激频率分别进行测试并记录ABR阈值。重复率39.10次/s,带通滤波100~1 500 Hz,叠加1 024次,扫描时程16.0 ms。声刺激强度从80 dB SPL开始,以5 dB逐次递减,听阈判定以刚出现ABR Ⅰ波为准,并至少重复2次。阈移为各组小鼠与健康对照组ABR阈值之差。
5、耳蜗基底膜标本制备完全随机法于每组随机抽取4只小鼠,颈椎脱臼法处死小鼠,断头后迅速取出颞骨,置入4%多聚甲醛缓冲液内,并用含4%多聚甲醛的0.1 mol/L磷酸盐缓冲液(PBS,pH 7.4)经蜗尖灌流,可见液体由圆窗及卵圆窗流出,之后标本于4℃中固定4 h。
6、免疫荧光染色耳蜗样本PBS冲洗后放入10%EDTA脱钙24 h,解剖显微镜下于磷酸盐缓冲液中分离耳蜗基底膜,加入封闭液1 h,再将封闭液吸净后孵一抗,4℃过夜。用PBS将基底膜洗3次(5 min/次)后滴加荧光标记的二抗1 h,PBS冲洗3次,在显微镜下将基底膜平整铺在载玻片上,加含有4′,6-二脒基-2-苯基吲哚(DAPI)的荧光封固剂封片,连续截取13~14个内毛细胞,荧光显微镜下观察结果。
7、Western blot完全随机法于每组随机抽取6只小鼠,立即断头处死,待各组动物停药并测试完ABR后,速取耳蜗,6个耳蜗组成一份标本,加入放射免疫沉淀试验(RIPA)细胞裂解液,低温振荡研磨,4℃,12 000 r/min,离心半径8.3 cm,离心25 min。取上清测定蛋白含量。每条泳道加入含50 μg蛋白的样品,电泳后,转移至聚偏二氟乙烯(PVDF)膜,加入含1%牛血清白蛋白(BSA)封闭液,常温摇床孵育1 h,加入一抗(1 ∶1 000稀释),4℃过夜。Tris-HCL缓冲盐溶液+Tween(TBST)缓冲液冲洗5 min×3次。加入二抗(1 ∶1 000稀释),4℃摇床孵育1 h。TBST 5 min×3次。滴加BCIP/NBT显色后,即可见成像条带。采用全自动凝胶成像系统对条带进行半定量分析,GAPDH作为内参照物。
8、统计学处理使用SPSS 26.0软件进行分析,计量资料符合正态分布的用
各组动物于照射前1 d和照射后第3和14天进行ABR听阈检测,随着电离辐射后时间的延长,各组小鼠的听阈随之增高。照射3 d组、照射14 d组在照射后各个频率ABR平均阈值较健康对照组明显增高(P < 0.05),且照射14 d组较照射3 d组更显著(P < 0.05)。给予LA后,阈值较同一时间照射组明显降低(P < 0.05)。照射3 d、14 d组阈移32 kHz较8 kHz更为显著,差异有统计学意义(P<0.05),12、24 kHz与8 kHz阈移比较,差异无统计学意义(P>0.05),见表 1。
|
|
表 1 各组小鼠不同频率声音刺激后ABR阈值变化 (dB SPL, |
2、CtBP2免疫荧光标记
结果见图 1。健康对照组、照射3 d组、照射3 d+LA组、照射14 d组、照射14 d+LA组的照射14 d组带状突触数量分别为27.75±0.96、17.00±0.82、20.75±1.26、12.25±1.50、15.50±1.29(F=99.41,P<0.05)。照射组较健康对照组表达数量明显减少,差异有统计学意义(P<0.05),照射14 d组较照射3 d组表达数量减少更为显著(P<0.05),给予LA后,照射+LA组较照射组表达数量明显增多,差异有统计学意义(P<0.05)。
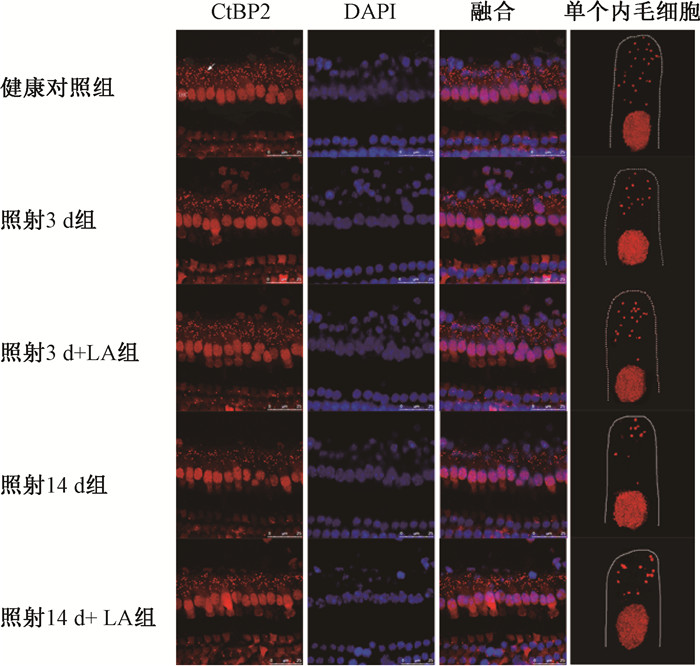
|
图 1 各处理组在照射与给药后带状突触的变化免疫荧光染色 ×100 Figure 1 Changes of the ribbon synapses after irradiation and drug treatment Immunofluorescence staining ×100 |
3、AP-2蛋白和otoferlin蛋白的表达情况
半定量分析结果显示,照射组较健康对照组表达明显减少,差异具有统计学意义(P<0.05),且照射14 d组更低(P<0.05);照射+LA组则明显升高(P<0.05),见图 2,图 3,表 2。
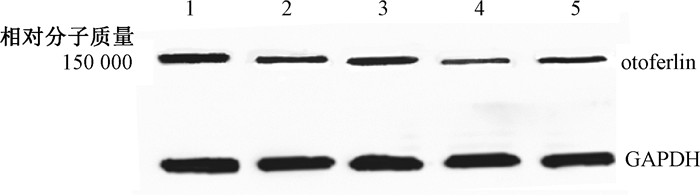
|
注:1.健康对照组;2.照射3 d组;3.照射3 d+LA组;4.照射14 d组;5.照射14 d+LA组 图 2 Western blot检测各照射组与对照组otoferlin蛋白表达情况 Figure 2 Western blot assay of otoferlin protein expression in different groups |
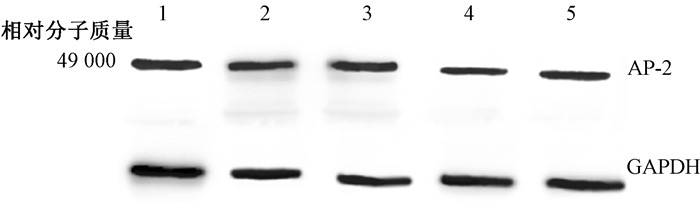
|
注:1.健康对照组;2.照射3 d组;3.照射3 d+LA组;4.照射14 d组;5.照射14 d+LA组 图 3 Western blot检测各照射组与对照组AP-2蛋白表达情况 Figure 3 Western blot assay of AP-2 protein expression in different groups |
|
|
表 2 各组小鼠在8 kHz AP-2、otoferlin蛋白表达变化 (dB SPL, |
讨论
放射导致的听力损伤是头颈部肿瘤放疗后难以避免的副作用,严重影响患者的生活质量。据报道,大约三分之一的鼻咽癌患者在接受放射治疗后出现了严重的感音神经性耳聋[5-7],在放射治疗中,患者的颞骨区包括耳均在放射野内,故可发生听觉传导通路的一系列损伤,导致永久性的听力减退[1]。但听力减退的发病机制目前不清。带状突触位于内毛细胞和螺旋神经元之间,并且是两者间的主要结构,研究表明,听功能减退与之密切相关,带状突触的数量、形态、结构和功能变化异常会导致感音神经性耳聋[2]。典型的带状突触结构是核心为圆形或椭圆形的电子致密体,直径为100~200 nm[8],大小各不相等。周围附着着大量突触囊泡,直径约35 nm,存在于距核心约20 nm的区域内,约100~200个。且在不同物种、不同发育时间点带状突触的数量、大小、形态的表现也不一样[9]。带状突触与螺旋神经元的连接是一一对应的,传递特定的音频信息,带状突触在声音传递过程中非常重要,可以使声音信号准确传递到中枢听觉系统。因此,寻找到有效的保护药物,可以减轻患者放疗带来的听力损伤的副作用,提高生活质量。
本实验通过对小鼠的耳颞部进行X射线照射来模拟患者头颈部放疗,中短期听力损失使用小鼠模型进行研究的分次照射剂量为>10 Gy但<20 Gy[10-11],本实验给予小鼠16 Gy头部一次性照射,分别观察照射后3和14 d小鼠的听功能变化以及耳蜗带状突触的变化。在本研究中,各照射组与健康对照组比较,听阈增高,照射14 d组与照射3 d组比较更为显著。Wei等[12]发现放射治疗后听力损伤高频较低频更为明显。本实验的ABR结果显示,与照射前相比高频(32 kHz)较低频(8 kHz) 小鼠的阈移更明显,与上述临床研究结果一致,放射造成的听力损伤高频更为显著。
近年来LA在临床广泛应用,且其对多种神经系统疾病有显著的保护作用,如Alzheimer氏病[4]、糖尿病脑病[13]及化疗性脑病[14]等。Pouyatos等[15]对大鼠CO+噪声暴露模型进行研究,表明LA对其造成的听力损伤具有保护作用。Nouvain等[16]发现一次性50 Gy对豚鼠耳蜗进行照射,透射电镜下可见耳蜗内神经末梢及突触的损害。
CtBP2和RIBEYE各自具有独特的启动子和N末端区域,但它们共享相同的C末端域,它们共同组成带状突触的结构。otoferlin相对分子质量约150 000,是内毛细胞带状突触前膜的组成部分[17],主要促进突触囊泡于脂膜融合,然后释放神经递质,在维持听功能上发挥重要作用[18]。由于otoferlin与25和CaV1.3 Ca2+通道的密切关联,研究者提出otoferlin可能充当融合的Syt1样钙传感器[19]。在内毛细胞(inner hair cell, IHC)中的otoferlin的表达对于维持囊泡重新供应到带状活性区至关重要。otoferlin通过与内吞衔接蛋白2的相互作用在囊泡补充中的功能似乎涉及调节突触囊泡与活性区膜之间的短丝状系链形成[20],以及促进从之前的胞吐膜清除囊泡释放位点(胞吐-胞吞偶合)[21]。因此,otoferlin不仅具有Ca2+的传感能力,而且其质膜水平对于IHC胞吐作用至关重要。AP-2相对分子质量约49 000,是由α、β2、μ2和σ2 4个亚基组成的蛋白复合体,在内吞起始阶段识别网格蛋白并协同其他辅助蛋白形成网格蛋白包被小泡(coated pits)。AP-2蛋白在成年小鼠耳蜗中主要表达于内毛细胞突触活化部位。听觉信号传导具有高效、精准的特点,依赖于突触囊泡循环(recycling)听觉神经递质的持续释放、回收,即囊泡的胞吐和胞吞。突触囊泡回收的主要途径目前普遍认为是突触囊泡循环CME途径,而AP-2是参与CME这一途径的关键蛋白,介导耳蜗突触囊泡内吞[22]。耳蜗IHC带状突触作为一种特殊的神经突触,AP-2蛋白调控的CME途径理论上应该在突触囊泡循环过程中发挥着重要作用。在成熟的IHC中,otoferlin与AP-2相互作用[23],来自成熟(> P25)耳蜗的MS分析表明,AP-2亚基能够结合otoferlin。AP-2也与肌球蛋白Ⅵ共定位并相互作用,肌球蛋白Ⅵ也与网格蛋白结合,对CME是必不可少的[24]。本实验通过标记突触前膜特异性受体蛋白CtBP2及对突触相关功能蛋白otoferlin、AP-2进行半定量分析来证实放射对带状突触的损伤作用及LA对其保护作用。
免疫荧光结果显示,照射组较健康对照组带状突触数量明显减少,且照射14 d组较照射3 d组减少的更为明显。给予LA后,各组带状突触数量较同一时间的照射组明显增多,提示LA对内耳神经元带状突触可能具有促进生长作用,表明LA对放射所致的耳蜗听功能损伤具有保护作用。这与Zhang等[3]报道的LA对大鼠海马神经元和突触具有保护作用一致。otoferlin和衔接蛋白AP-2(adaptin-2)均在突触囊泡传递过程中起着重要作用。在大鼠耳鸣研究中,otoferlin蛋白表达水平随着耳鸣时间推移而降低,也表明其在听功能方面的重要性。本研究结果显示,带状突触功能相关蛋白AP-2、otoferlin的表达水平,照射组较健康对照组明显减少,且照射14 d组较照射3 d组减少更为明显,给予LA后,各组蛋白表达水平较同一时间的照射组明显升高,与ABR阈值检测结果一致。综上,LA能够维持辐射后耳蜗带状突触的数量,并且提高otoferlin蛋白和AP-2蛋白水平,继而发挥对电离辐射导致的听力损伤的保护作用。
LA对耳蜗电离辐射损伤防护作用,可能与LA对带状突触数量及功能蛋白水平的改变有关。本实验从带状突触数量及功能上初步探讨了LA对电离辐射导致的听力损伤的保护作用,在超微结构上的改变以及对突触囊泡释放及回收通路上的影响还有待进一步研究。
利益冲突 无
作者贡献声明 王宁负责数据采集、处理并撰写论文;屈东昊负责数据采集;林宇涵、刘双月、邢巍巍负责方案制定及论文指导;许涛负责制定照射计划及实施
| [1] |
胡莉. 内耳受照剂量对头颈部肿瘤患者放射性感音神经性听力损伤影响的临床研究[D]. 蚌埠: 蚌埠医学院, 2017. Hu L. Clinical study on the effect of inner ear radiation dose on radiation-induced sensorineural hearing impairment in patients with head and neck tumors[D]. Bengbu: Bengbu Medical College, 2017. |
| [2] |
Coate TM, Scott MK, Gurjar M. Current concepts in cochlear ribbon synapse formation[J]. Synapse, 2019, 73(5). DOI:10.1002/syn.22087 |
| [3] |
Zhang Y, Lv YL, Si YN, et al. α-lipoic acid attenuates spatial learning and memory impairment induced by hepatectomy[J]. Exp Ther Med, 2019, 17(3): 2329-2333. DOI:10.3892/etm.2019.7202 |
| [4] |
Dos SSM, CFR R, Rodrigues CA, et al. Mitochondrial dysfunction and alpha-lipoic acid: Beneficial or harmful in Alzheimer's disease?[J]. Oxid Med Cell Longev, 2019, 2019: 8409329. DOI:10.1155/2019/8409329 |
| [5] |
Chang H, Tu TY, Wu CS, et al. Is the risk of idiopathic sudden sensorineural hearing loss higher in nasopharyngeal carcinoma than in hypopharyngeal cancer? A population-based study[J]. J Chin Med Assoc, 2020, 83(9): 865-869. DOI:10.1097/JCMA.0000000000000314 |
| [6] |
Lee MS, Penumala S, Sweet S, et al. Long-term progression of sensorineural hearing loss and tinnitus after combined intensity-modulated radiation therapy and cisplatin-based chemotherapy for nasopharyngeal carcinoma: a case report[J]. Case Rep Oncol, 2017, 10(2): 743-751. DOI:10.1159/000478847 |
| [7] |
Zhu W, Chen F, Li J, et al. Dosimetric parameters associated with conductive or sensorineural hearing loss 5 years after intensity-modulated radiation therapy in nasopharyngeal carcinoma[J]. Acta Otolaryngol, 2019, 139(3): 263-268. DOI:10.1080/00016489.2019.1566778 |
| [8] |
Li SN, Jiang XJ, Liu K. Ribbon synapse of inner hair cell[J]. Chin J Otorhinolaryngol Head Neck Surg, 2008, 43(5): 294-391. |
| [9] |
Fang L, Fu YY, Zhang TY. Salicylate-induced hearing loss trigger structural synaptic modifications in the ventral cochlear nucleus of rats via medial olivocochlear (MOC) feedback circuit[J]. Neurochemical Res, 2016, 41(6): 1-11. DOI:10.1007/s11064-016-1836-x |
| [10] |
Yang I, Sughrue ME, Han SJ, et al. A comprehensive analysis of hearing preservation after radiosurgery for vestibular schwannoma[J]. J Neurosurg, 2010, 112(4): 851-859. DOI:10.3171/2009.8.JNS0985 |
| [11] |
Hasegawa T, Kida Y, Kato T, et al. Factors associated with hearing preservation after Gamma Knife surgery for vestibular schwannomas in patients who retain serviceable hearing[J]. J Neurosurg, 2011, 115(6): 1078-1086. DOI:10.3171/2011.7.JNS11749 |
| [12] |
Wei Y, Zhou T, Zhu J, et al. Long-term outcome of sensorineural hearing loss in nasopharyngeal carcinoma patients: comparison between treatment with radiotherapy alone and chemoradiotherapy[J]. Cell Biochem Biophys, 2014, 69(3): 433-437. DOI:10.1007/s12013-014-9814-x |
| [13] |
高健. α-硫辛酸联合甲钴胺治疗糖尿病周围神经病变的临床应用效果分析[J]. 心理月刊, 2020, 15(8): 216. Gao J. Analysis of clinical application effect of α-lipoic acid combined with methylcobalamin in the treatment of diabetic peripheral neuropathy[J]. Psychol Monthly, 2020, 15(8): 216. DOI:10.19738/j.cnki.psy.2020.08.189 |
| [14] |
de Sousa CNS, CMG dSL, da SMI, et al. Alpha-lipoic acid in the treatment of psychiatric and neurological disorders: a systematic review[J]. Metab Brain Dis, 2019, 34(1): 39-52. DOI:10.1007/s11011-018-0344-x |
| [15] |
Pouyatos B, Gearhart C, Nelson-Miller A, et al. Lipoic acid and 6-formylpterin reduce potentiation of noise-induced hearing loss by carbon monoxide: preliminary investigation[J]. J Rehabil Res Dev, 2008, 45(7): 1053-1064. DOI:10.1682/jrrd.2007.12.0200 |
| [16] |
Nouvian R, Beutner D, Parsons TD, et al. Structure and function of the hair cell ribbon synapse[J]. J Membr Biol, 2006, 209(2-3): 153-165. DOI:10.1007/s00232-005-0854-4 |
| [17] |
Michalski N, Goutman JD, Auclair SM, et al. Otoferlin acts as a Ca2+ sensor for vesicle fusion and vesicle pool replenishment at auditory hair cell ribbon synapses[J]. Elife, 2017, 6: e31013. DOI:10.7554/eLife.31013 |
| [18] |
Tertrais M, Bouleau Y, Emptoz A, et al. Viral transfer of mini-otoferlins partially restores the fast component of exocytosis and uncovers ultrafast endocytosis in auditory hair cells of otoferlin knock-out mice[J]. J Neurosci, 2019, 39(18): 3394-3411. DOI:10.1523/JNEUROSCI.1550-18.2018 |
| [19] |
Roux I, Safieddine S, Nouvian R, et al. Otoferlin, defective in a human deafness form, is essential for exocytosis at the auditory ribbon synapse[J]. Cell, 2006, 127: 277-289. DOI:10.1016/j.cell.2006.08.040 |
| [20] |
Vogl C, Cooper BH, Neef J, et al. Unconventional molecular regulation of synaptic vesicle replenishment in cochlear inner hair cells[J]. Cell Sci, 2015, 128(4): 638-644. DOI:10.1242/jcs.162099 |
| [21] |
Duncker SV, Franz C, Kuhn S, et al. Otoferlin couples to clathrin-mediated endocytosis in mature cochlear inner hair cells[J]. J Neurosci, 2013, 33(22): 9508-9519. DOI:10.1523/JNEUROSCI.5689-12.2013 |
| [22] |
顾翔, 宋锐, 陈知己, 等. 衔接蛋白AP-2蛋白在小鼠耳蜗中的表达及意义[J]. 临床耳鼻咽喉头颈外科杂志, 2015, 29(1): 83-85. Gu X, Song R, Chen ZJ, et al. Expression and significance of the adaptor protein AP-2 protein in mouse cochlea[J]. J Clin Otorhinol Head Neck Surg, 2015, 29(1): 83-85. DOI:10.13201/j.issn.1001-1781.2015.01.020 |
| [23] |
Keyel PA, Thieman JR, Roth R, et al. The AP-2 adaptor beta2 appendage scaffolds alternate cargo endocytosis[J]. Mol Biol Cell, 2008, 19(12): 5309-5326. DOI:10.1091/mbc.e08-07-0712 |
| [24] |
Puri C. Loss of myosin VI no insert isoform (NoI) induces a defect in clathrin-mediated endocytosis and leads to caveolar endocytosis of transferrin receptor[J]. J Biol Chem, 2010, 284(3): 34998-35014. DOI:10.1074/jbc.M109.012328 |
 2021, Vol. 41
2021, Vol. 41


