皮肤是外照射粒子在放射治疗中进入人体的第一道屏障,易受到辐射所致的损伤[1-2]。放射性皮肤损伤是肿瘤放射治疗、放射性核事故以及骨髓移植预处理之后常见的并发症[3-4]。电离辐射作用于皮肤所产生的自由基是放射性皮肤损伤发生的重要原因,自由基会攻击生物体内的重要分子,如核酸、蛋白质等,引起细胞功能的紊乱甚至细胞的自噬、衰老、坏死和凋亡等[5-6]。但是电离辐射引起细胞死亡方式的调控机制尚不完全清楚,深入探索电离辐射引起细胞死亡的调控机制对辐射损伤的防治无疑具有积极意义。
铁死亡是一种铁依赖的由脂质过氧化反应驱动的非凋亡性细胞死亡方式[7]。电离辐射能够通过诱导活性氧(reactive oxygen species,ROS)的产生和长链脂酰辅酶A合成酶4(acyl-CoA synthetase long-chain family member 4,ACSL4)的表达引起细胞发生铁死亡[8]。也有研究表明,放射性肺纤维化和急性放射性肺损伤的发生发展过程与电离辐射产生的ROS引起的铁死亡密切相关[9-10],可见辐射损伤的进展与铁死亡的发生可能密切相关,这为辐射损伤的防治提供了一种新的策略。但电离辐射能否引起皮肤细胞出现铁死亡尚不明确。本研究通过检测X射线照射以及铁死亡抑制剂Ferrostatin-1(Fer-1)作用后,HaCaT细胞毒性、脂质过氧化水平、克隆存活能力和铁死亡相关蛋白的表达来研究Fer-1的对受照射皮肤细胞的保护效果,为辐射损伤的防护提供一种新策略。
材料与方法 1、实验材料人永生化上皮角质形成细胞株HaCaT购自美国ATCC公司并由本实验室保存[11-12]。DMEM培养基、胎牛血清、胰酶、青霉素-链霉素双抗溶液、磷酸盐缓冲液(PBS)购自以色列BI公司,四氢生物喋呤购买自美国Cayman Chemical公司,二甲基亚砜(DMSO)购于北京索莱宝公司,CCK-8试剂盒、二喹啉甲酸(BCA)蛋白浓度测定试剂盒、RIPA裂解液、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白上样缓冲液(5×)、乳酸脱氢酶(LDH)检测试剂盒、10% SDS-PAGE凝胶超快速配制试剂盒和辣根过氧化物酶标记山羊抗兔IgG购自上海碧云天生物科技公司,铁死亡抑制剂Fer-1购自美国Sigma公司,脂质过氧化荧光探针BODIPYTM 581/591 C11购自美国Invitrogen公司。GAPDH、ACSL4和GPX4兔单克隆抗体购自英国Abcam公司。
2、细胞培养和照射条件采用含10%胎牛血清的DMEM培养基(含青霉素100 U/ml和链霉素100 μg/ml)在37℃、含5%CO2饱和湿度的培养箱中培养HaCaT细胞。本研究细胞实验采用X-RAD 225生物辐照仪(美国Precision X-ray公司)进行照射,X射线最高能量为225 kV,源靶距50 cm,剂量率2.0 Gy/min。
3、实验分组按照射与给药方式分为对照组、Fer-1组、单纯照射组以及照射+Fer-1组。对照组不进行任何处理(假照射),Fer-1组为1、2、5或10 μmol/L Fer-1处理组,单纯照射组指接受一定剂量的X射线照射组(5、10或15 Gy),照射+Fer-1组是指在接受一定剂量的X射线照射前24 h用一定浓度的Fer-1处理(1、2、5或10 μmol/L)。
4、细胞存活检测选择对数生长期的HaCaT细胞,调整其浓度为5×104/ml,以200 μl/孔接种于96孔板中,然后将培养板置于培养箱中。孵育24 h后各组给予不用剂量(0、5、10、15 Gy)的X射线照射,分别在辐照24和48 h后每孔加入20 μl的CCK-8溶液,将培养板在培养箱中孵育2 h后,用酶标仪检测450 nm处的吸光度,并计算细胞的相对存活率。为了验证Fer-1的辐射防护效果,在接种细胞24 h后去掉原培养液,分别加入含有不同浓度Fer-1(0、1、2、5、10 μmol/L)的培养基,每个浓度设置6个平行孔。继续孵育24 h后,各组分别给与0或10 Gy的X射线照射,在照射后48 h用CCK-8试剂盒检测细胞的相对存活率。
5、LDH释放检测选择对数生长期的HaCaT细胞,调整其浓度为105/ml,以200 μl/孔接种于96孔板中,然后将培养板置于培养箱中。孵育24 h后各组换无血清培养基并给予不同剂量(0、5、10、15 Gy)的X射线照射,分别在照射24和48 h后按照说明书进行LDH释放的检测并计算。为了验证Fer-1的辐射防护效果,在接种细胞24 h后去掉原培养液,分别加入用无血清培养基配制的含有不同浓度Fer-1(0、1、2、5、10 μmol/L)的培养基,每个浓度设置6个平行孔。继续孵育24 h后,各组分别给予0或10 Gy的X射线照射,在照射后48 h用试剂盒检测LDH的释放并计算。
6、脂质过氧化水平检测选择对数生长期的HaCaT细胞,调整其浓度为105/ml,以1 ml/孔接种于12孔板中,然后将培养板置于培养箱中。孵育24 h后去掉原培养液,分别加入含0和5 μmol/L Fer-1的培养基(每组设置3个平行孔),并在经0或10 Gy的X射线照射24和48 h后弃去原培养基,加入500 μl预先用无血清培养基配制的BODIPYTM 581/591 C11探针(终浓度为4 μmol/L),置于培养箱中孵育30 min,用PBS清洗3次,然后用胰酶消化细胞,重悬在PBS溶液中后利用流式细胞仪检测脂质过氧化水平的变化。
7、平板克隆存活实验选择对数生长期的HaCaT细胞,调整细胞为合适的浓并接种于6孔板中(0 Gy组和10 Gy组对应细胞数为200和1 000 /孔),然后将培养板置于培养箱中。孵育24 h后去掉原培养液,并分别加入含有0和5 μmol/L Fer-1的培养基,每组设置3复孔,培养24 h后分别给予0或10 Gy的X射线照射。继续培养14 d,每2~3天换液,直至在培养板中出现肉眼可见细胞克隆,终止培养。使用4%多聚甲醛固定细胞15 min,结晶紫染色30 min后用流水缓慢洗去染色液,计数≥ 50个细胞的克隆数,并根据克隆存活率计算细胞存活分数,克隆形成率(%)=克隆数/接种细胞数×100%。
8、Western blot选择对数生长期的HaCaT细胞,调整细胞浓度为5×105/ml,以2 ml/孔接种于6孔板中,然后将培养板置于培养箱中。孵育24 h后去掉原培养液,并分别加入含有0和5 μmol/L Fer-1的培养基。继续孵育24 h后各组分别给予0或10 Gy的X射线照射,并在照射后2、4、8、12、24和48 h提取各组细胞的总蛋白,使用BCA蛋白浓度测定试剂盒,按照操作说明书测定蛋白浓度。取50 μg蛋白,于10%的SDS-PAGE凝胶中进行电泳分离,并将蛋白转移到聚偏氟乙烯(PVDF)膜上。用5%的脱脂奶粉室温封闭1 h后加入按说明书比例稀释的一抗,4℃孵育过夜。用3(羟甲基)氨基甲烷-盐酸缓冲盐溶液(TBST)洗膜3次,加入按比例稀释的二抗溶液,室温孵育1 h后用TBST洗膜3次。最后用电化学发光(ECL)试剂盒在暗室曝光。以GAPDH为参照,采用Image J软件分析目的蛋白表达水平。
9、统计学处理采用SPSS 24.0软件进行统计学分析,数据符合正态分布,用
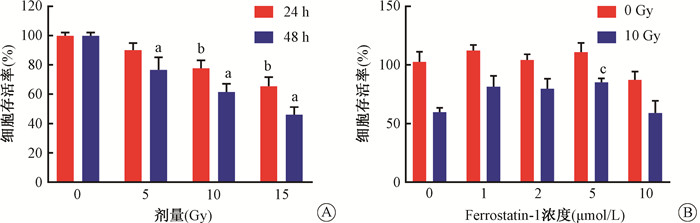
与对照组(0 Gy)相比,单纯照射组HaCaT细胞在分别给予10和15 Gy的X射线照射后,细胞存活率明显降低,差异具有统计学意义(t=5.63、8.74,P < 0.05),并随着照射后时间的延长细胞存活率进一步降低,差异具有统计学意义(t=3.09、3.71、4.46,P < 0.05)(图 1 A)。而在用5 μmol/L的Fer-1进行处理后,照射+Fer-1组的细胞存活率明显高于单纯照射组,其差异具有统计学意义(t=5.79,P < 0.05)(图 1B)。说明Fer-1的处理能够提高X射线照射后HaCaT细胞的存活率,体现出一定的辐射防护效果,并且5 μmol/L的Fer-1在各实验组中体现出较好的保护效果。
|
注:a与同剂量照射后24 h比较,t=3.09、3.71、4.46,P < 0.05;b与对照组比较,t=5.63、8.74,P < 0.05;c与单纯照射组比较,t=5.79,P < 0.05 图 1 X射线照射对HaCaT细胞存活的影响A. 不同剂量X射线照射后24和48 h细胞的存活率;B. 不同浓度Fer-1处理后经10 Gy X射线照射后48 h细胞的存活率 Figure 1 The cell viability of HaCaT after X-ray irradiation A. The cell viability of cells at 24 h and 48 h after X-ray irradiation with different doses; B. At 48 h after 10 Gy X-ray irradiation, the cell viability of HaCaT cells pre-treated with different concentrations of Fer-1 |
2、X射线对HaCaT细胞毒性的影响
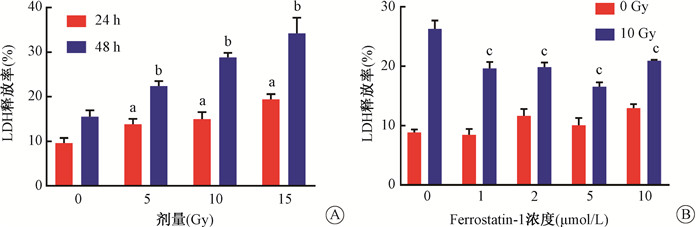
与对照组(0 Gy)相比,单纯照射组HaCaT细胞在分别给予5、10和15 Gy的X射线照射后,LDH的释放量明显增多,差异具有统计学意义(t=3.98、5.08、9.27,P < 0.05),并随着随着照射后时间的延长LDH的释放量随着辐射剂量的增加而急剧增加,差异具有统计学意义(t=4.21、6.11、9.85,P < 0.05,图 2A)。而在用不同浓度的Fer-1进行处理后,照射+Fer-1组的细胞LDH的释放量明显低于单纯照射组,其差异具有统计学意义(t=12.36、11.96、18.13、9.96,P < 0.05,图 2B)。说明Fer-1的处理能够缓解X射线对HaCaT细胞的破坏作用,体现出一定的辐射防护效果,并且5 μmol/L的Fer-1在各实验组中体现出最好的保护效果。
|
注:a与对照组比较,t=3.98、5.08、9.27,P < 0.05;b与同剂量照射后24 h比较,t=4.21、6.11、9.85,P < 0.05;c与单纯照射组比较,t=12.36、11.96、18.13、9.96,P < 0.05。LDH.乳酸脱氢酶 图 2 X射线照射对HaCaT细胞毒性的影响A. 不同剂量X射线照射后24和48 h细胞的LDH释放率;B. 不同浓度Fer-1处理后经10 Gy的X射线照射后48 h细胞的LDH释放率 Figure 2 The cytotoxicity of HaCaT after X-ray irradiation A. LDH release rate of cells at 24 h and 48 h after X-ray irradiation with different doses; B. At 48 h after 10 Gy X-ray irradiation, LDH release rate of cells pre-treated with different concentrations of Fer-1 |
3、X射线对HaCaT细胞脂质过氧化的影响
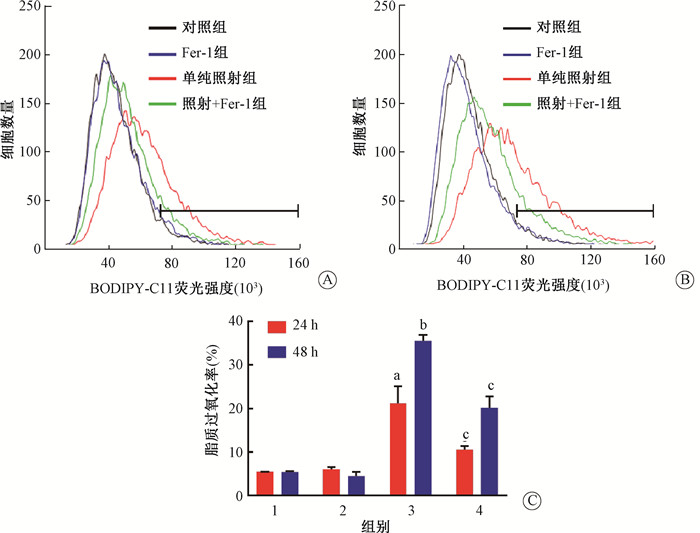
与对照组(0 Gy)相比,单纯照射组HaCaT细胞在给予10 Gy的X射线照射后,脂质过氧化水平明显升高,差异具有统计学意义(t=9.59,P < 0.05),并随着照射后时间的延长脂质过氧化水平进一步增加,差异具有统计学意义(t=9.79,P < 0.05)。而在5 μmol/L的Fer-1处理后,照射+Fer-1组的脂质过氧化水平明显低于单纯照射组,其差异具有统计学意义(t=6.48、17.04,P < 0.05,图 3)。这一结果表明电离辐射能够诱导HaCaT发生铁死亡,并且铁死亡抑制剂能够通过抑制铁死亡的发生,发挥辐射防护的效果。
|
注:1.对照组;2.Fer-1组;3.单纯照射组;4.照射+Fer-1组。a与对照组比较,t=9.59,P < 0.05;b与同剂量照射后24 h比较,t=9.79,P < 0.05;c与同一时间的单纯照射组比较,t=6.48、17.04,P < 0.05 图 3 X射线照射对HaCaT细胞脂质过氧化水平的影响A. 各组经X射线照射后24 h细胞脂质过氧化水平的变化;B. 各组经X射线照射后48 h细胞脂质过氧化水平的变化;C. 各组经X射线照射后24和48 h脂质过氧化率比较 Figure 3 Lipid peroxidation assessment in HaCaT after X-ray irradiation A. Lipid peroxidation assessment in cells at 24 h after X-ray irradiation; B. Lipid peroxidation assessment in cells at 48 h after X-ray irradiation; C. Comparison of lipid peroxidation rate in cells at 24 h and 48 h after X-ray irradiation |
4、X射线照射对HaCaT细胞克隆形成能力的影响
对照组、Fer-1组、单纯照射组和照射+Fer-1组的克隆形成率分别为(100.00±10.78)%、(85.29± 13.46)%、(26.35±11.70)%和(48.59±16.79)%。与对照组相比,单纯照射组的克隆形成率明显降低(t=4.26,P < 0.05),说明X射线的照射能够明显抑制HaCaT细胞的生长,使其发生增殖性死亡现象,而照射+Fer-1组较单纯照射组克隆形成率有明显的增加(t=3.96,P < 0.05),说明Fer-1的处理能够明显地缓解因电离辐射所导致的增殖抑制现象。
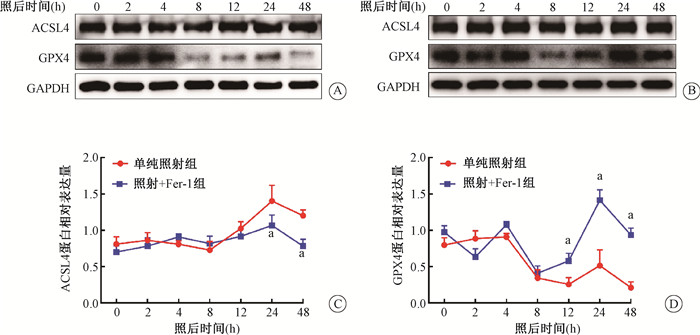
5、X射线照射对HaCaT细胞铁死亡相关蛋白表达的影响HaCaT细胞经过10 Gy的电离辐射后ACSL4的表达水平随着时间的延长略有增加,GPX4的表达随着时间的增加逐渐降低。而作为铁死亡的抑制剂,经5 μmol/L的Fer-1处理后,照射+Fer-1组相较于单纯照射组,在辐照后24和48 h ACSL4的表达水平有所下降(t=5.23、7.16,P < 0.05),而GPX4的表达水平在辐照后12、24和48 h后其表达水平有了明显的升高趋势(t=4.78、8.29、6.43,P < 0.05)(图 4),说明铁死亡抑制剂Fer-1的处理能够明显地缓解电离辐射所导致的铁死亡的发生。
|
注:a与照射组比较,t=5.23、7.16、4.78、8.29、6.43,P < 0.05 图 4 10 Gy X射线照射后不同时间HaCaT细胞铁死亡的相关蛋白表达A. 单纯照射组ACSL4和GPX4蛋白在照后不同时间的表达情况;B. 照射+Fer-1组ACSL4和GPX4蛋白在照后不同时间的表达情况;C. 单纯照射组和照射+Fer-1组ACSL4蛋白表达随辐照后时间变化曲线;D. 单纯照射组和照射+Fer-1组GPX4蛋白表达随辐照后时间变化曲线 Figure 4 Expressions of ferroptosis related proteins in HaCaT cells after X-ray irradiation A. Expressions of ACSL4 and GPX4 in the cells at different time after irradiation; B. Expressions of ACSL4 and GPX4 in the cells of irradiation + Fer-1 group after irradiation; C. Line diagram of the expression levels of ACSL4 in the irradiation group and irradiation + Fer-1 group; D. Line diagram of the expression levels of GPX4 in the irradiation group and irradiation + Fer-1 group |
讨论
放射性皮肤损伤是肿瘤放射治疗、放射性核事故以及骨髓移植预处理之后常见的并发症,严重影响患者的生活质量[3-4]。深入研究和探索电离辐射引起的皮肤细胞和组织功能紊乱的调控机制对放射性皮肤损伤的防治以及放疗效率的提高具有重要的意义。细胞死亡是放射性皮肤损伤中的一个关键问题,传统上,认为电离辐射后细胞死亡是由辐射直接引起的DNA损伤引起的细胞凋亡所导致的[13-14]。然而,辐射不仅会损伤细胞DNA,还会诱导ROS的产生,因此辐射所致的损伤还包括活性氧的积累对细胞膜脂质的损伤[9]。因此,除细胞凋亡外,其他一些细胞死亡可能参与了放射性皮肤损伤的发生过程。活性氧的积累对细胞膜脂类的损伤是铁死亡的根源。本研究旨在探讨铁死亡在放射性皮肤损伤中的作用,以及铁死亡抑制剂对放射性皮肤损伤的治疗作用及机制。
铁死亡是一种铁依赖的调节细胞死亡的形式,它是由过度的脂质过氧化引起的,在形态学、生物化学和遗传学上与凋亡不同[7]。目前的研究表明,铁死亡主要是由含有多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)的磷脂(phospholipids,PLs)过氧化引起的,ACSL4是一种长链脂肪酸辅酶A连接酶,它是PUFA-PL生物合成所必需的连接酶[15-17]。谷胱甘肽过氧化物酶GPX4能够利用还原型谷胱甘肽将脂质过氧化物转化为脂质醇,从而减轻脂质过氧化,抑制铁死亡作用[18-19]。铁死亡抑制剂能够直接或间接提高细胞中GPX4的水平而抑制铁死亡的发生,铁死亡抑制剂的发展为铁死亡相关的研究提供了重要的工具,也为治疗铁死亡相关疾病提供了潜在治疗药物。本研究中发现电离辐射能够导致GPX4表达水平的明显降低,而铁死亡抑制剂Fer-1的治疗能够明显促进GPX4表达水平的恢复,这为放射性皮肤损伤的治疗提供了新的治疗策略。
放射治疗导致的正常皮肤组织的损伤是一个复杂的过程,其具体的发生和发展机制尚未完全阐明。本研究通过初步的研究发现电离辐射可引起皮肤细胞铁死亡,且铁死亡抑制剂Fer-1在细胞水平上能够通过抑制电离辐射后铁死亡的发生而缓解放射性皮肤损伤的进展,这将为辐射损伤的防治提供了一种基于铁死亡的新策略,也为深入探索电离辐射诱导铁死亡相关机制奠定基础,也将为放射治疗并发症的防治研究提供理论支持。
利益冲突 无
志谢 感谢成都医学院校基金(CYZ19-31)对本研究的资助
作者贡献声明 冯亚辉负责实验操作、论文撰写;蒋胜、涂文玲负责数据分析;邵继春、余道江负责课题设计与部分实验操作;李静怡、张舒羽负责课题设计与指导、论文修改
| [1] |
Rocha MA, Bagatin E. Skin barrier and microbiome in acne[J]. Arch Dermatol Res, 2018, 310(3): 181-185. DOI:10.1007/s00403-017-1795-3 |
| [2] |
Wang Y, Tu W, Tang Y, et al. Prevention and treatment for radiation-induced skin injury during radiotherapy[J]. Radiat Med Prot, 2020, 1(2): 60-68. |
| [3] |
Fujioka M. Surgical reconstruction of radiation injuries[J]. Adv Wound Care (New Rochelle), 2014, 3(1): 25-37. DOI:10.1089/wound.2012.0405 |
| [4] |
Chan RJ, Webster J, Chung B, et al. Prevention and treatment of acute radiation-induced skin reactions: a systematic review and meta-analysis of randomized controlled trials[J]. BMC Cancer, 2014, 14: 53. DOI:10.1186/1471-2407-14-53 |
| [5] |
Smith TA, Kirkpatrick DR, Smith S, et al. Radioprotective agents to prevent cellular damage due to ionizing radiation[J]. J Transl Med, 2017, 15(1): 232. DOI:10.1186/s12967-017-1338-x |
| [6] |
Kirolikar S, Prasannan P, Raghuram GV, et al. Prevention of radiation-induced bystander effects by agents that inactivate cell-free chromatin released from irradiated dying cells[J]. Cell Death Dis, 2018, 9(12): 1142. DOI:10.1038/s41419-018-1181-x |
| [7] |
康传杰, 张相彤, 马威. 细胞铁死亡发生与调控机制的研究进展[J]. 中国病理生理杂志, 2017, 33(3): 567-571. Kang CJ, Zhang XT, Ma W. Progress in occurrence and development of ferroptosis[J]. Chin J Pathophysiol, 2017, 33(3): 567-571. DOI:10.3969/j.issn.1000-4718.2017.03.032 |
| [8] |
Lei G, Zhang Y, Koppula P, et al. The role of ferroptosis in ionizing radiation-induced cell death and tumor suppression[J]. Cell Res, 2020, 30(2): 146-162. DOI:10.1038/s41422-019-0263-3 |
| [9] |
Li X, Duan L, Yuan S, et al. Ferroptosis inhibitor alleviates radiation-induced lung fibrosis (RILF) via down-regulation of TGF-β1[J]. J Inflamm(Lond), 2019, 16: 11. DOI:10.1186/s12950-019-0216-0 |
| [10] |
Li X, Zhuang X, Qiao T. Role of ferroptosis in the process of acute radiation-induced lung injury in mice[J]. Biochem Biophys Res Commun, 2019, 519(2): 240-245. DOI:10.1016/j.bbrc.2019.08.165 |
| [11] |
Xue J, Yu C, Sheng W, et al. The Nrf2/GCH1/BH4 axis ameliorates radiation-induced skin injury by modulating the ROS cascade[J]. J Invest Dermatol, 2017, 137(10): 2059-2068. DOI:10.1016/j.jid.2017.05.019 |
| [12] |
Jia H, Mo W, Hong M, et al. Interferon-α inducible protein 6(IFI6) confers protection against ionizing radiation in skin cells[J]. J Dermatol Sci, 2020, 100(2): 139-147. DOI:10.1016/j.jdermsci.2020.09.003 |
| [13] |
Ogura A, Oowada S, Kon Y, et al. Redox regulation in radiation-induced cytochrome c release from mitochondria of human lung carcinoma A549 cells[J]. Cancer Lett, 2009, 277(1): 64-71. DOI:10.1016/j.canlet.2008.11.021 |
| [14] |
Haimovitz-Friedman A, Kan CC, Ehleiter D, et al. Ionizing radiation acts on cellular membranes to generate ceramide and initiate apoptosis[J]. J Exp Med, 1994, 180(2): 525-535. DOI:10.1084/jem.180.2.525 |
| [15] |
Doll S, Proneth B, Tyurina YY, et al. ACSL4 dictates ferroptosis sensitivity by shaping cellular lipid composition[J]. Nat Chem Biol, 2017, 13(1): 91-98. DOI:10.1038/nchembio.2239 |
| [16] |
Kagan VE, Mao G, Qu F, et al. Oxidized arachidonic and adrenic PEs navigate cells to ferroptosis[J]. Nat Chem Biol, 2017, 13(1): 81-90. DOI:10.1038/nchembio.2238 |
| [17] |
Yang WS, Kim KJ, Gaschler MM, et al. Peroxidation of polyunsaturated fatty acids by lipoxygenases drives ferroptosis[J]. Proc Natl Acad Sci USA, 2016, 113(34): E4966-4975. DOI:10.1073/pnas.1603244113 |
| [18] |
Seibt TM, Proneth B, Conrad M. Role of GPX4 in ferroptosis and its pharmacological implication[J]. Free Radic Biol Med, 2019, 133: 144-152. DOI:10.1016/j.freeradbiomed.2018.09.014 |
| [19] |
Yang WS, SriRamaratnam R, Welsch ME, et al. Regulation of ferroptotic cancer cell death by GPX4[J]. Cell, 2014, 156(1-2): 317-331. DOI:10.1016/j.cell.2013.12.010 |
 2021, Vol. 41
2021, Vol. 41


