2. 火箭军特色医学中心, 北京 100088
2. PLA Rocket Characteristic Medical Center, Beijing 100088, China
氡(Rn)是自然界唯一的天然放射性气体,被国际癌症研究机构(International Agency for Research on Cancer, IARC)归类于I类致癌因素[1],也被世界卫生组织列为致癌的19种主要物质之一,同时也是我国控制的5种室内污染物之一,是仅次于吸烟引起肺癌的第二大诱因[2]。氡对健康的影响不仅是氡本身,重要的还包括其衰变子体。氡及其子体衰变产生的α粒子可直接损伤细胞核,造成基因突变和染色体畸变,也可通过间接作用产生活性氧,导致细胞凋亡和肿瘤等[3]。
氡及其子体暴露与肺癌发生的剂量效应是目前国内外研究的重点,对于氡暴露损伤的防护研究较少,且多采用制定标准规范,限制不同场所氡浓度来预防氡危害的,尚缺乏氡暴露肺损伤的生物防治措施。研究表明,丹参和黄芪具有抗炎、抗纤维化和抗肿瘤等特点,被广泛用于呼吸系统和组织纤维化治疗中[4-5]。冬虫夏草具有抗衰老、抗氧化、抗癌和免疫调节等多种生物活性,在临床研究中广泛应用[6-7]。尚缺乏上述中药对氡暴露损伤防护的研究,因此本研究通过构建氡暴露小鼠/细胞模型及中药组合物干预氡暴露小鼠/细胞模型,探索中药组合物对氡暴露损伤的防治效果,为今后氡损伤的辐射防护提供支持。
材料与方法 1、细胞和动物人支气管上皮细胞16HBE,购于上海中乔新舟科技有限公司;SPF级雄性BALB/c小鼠18只,体重18~22 g,购于常州卡文斯动物有限公司(合格证号:201928357)。
2、主要试剂和仪器中药组合物是由生黄芪、丹参组成的配方颗粒和冬虫夏草粉末(以下简称夏丹芪),由火箭军特色医学中心提供。用高压水配制中药组合物母液。配制后的试剂有部分不溶,呈混悬液。细胞实验中母液在100℃,30 min下进行无菌处理。上皮细胞专用培养基(上海中乔新舟科技有限公司);E-cadherin和Vimentin单克隆抗体(英国Abcam公司);α-SMA单克隆抗体(美国CST公司),GAPDH单克隆抗体(美国Affinity公司),山羊抗兔/小鼠二抗(美国ABclonal公司),二喹啉甲酸(BCA)蛋白测定试剂盒、超敏电化学发光(ECL)液和Masson染液试剂盒(北京索莱宝生物技术公司),超氧化物歧化酶(SOD)和丙二醛(MDA)检测试盒(南京建成生物有限公司);细胞黏附检测试剂盒(上海贝博生物技术有限公司),免疫组织化学试剂盒[基因科技(上海)股份有限公司];HD-3型多功能生态氡室(华东地质学院制造)。
3、氡染毒动物模型18只6周龄左右的雄性BALB/c小鼠按随机数字表法分为3组:健康对照组、氡暴露组和夏丹芪干预氡暴露组,每组6只,夏丹芪干预氡暴露组于每次氡暴露前30 min灌胃200 μl中药溶液,中药组合物剂量为2 mg/g,后续实验中根据小鼠体重调整给药体积。氡暴露组和健康对照组给予等量去离子水灌胃。小鼠在氡室内吸入105 Bq/m3氡及其子体,每天10 h,每周6 d,氡暴露过程中小鼠可自由饮食及活动。当小鼠氡暴露累积剂量达120 WLM,即累积暴露时间约755 h时,终止染氡。
4、氡染毒细胞模型将状态良好的16HBE细胞接种于6孔板的Transwell小室内,置于专用气体染毒装置中,小室中的细胞直接接触20 000 Bq/m3的氡及其子体,每次染毒20 min,3 d后重复染毒1次,染氡2次的细胞作为氡暴露1代细胞,选取氡暴露6代细胞(染氡组)进行后续实验。对照组细胞置于天然本底氡浓度装置中。夏丹芪干预氡暴露组为在已建好的染氡组细胞中直接加入中药组合物,使其终浓度为150 μg/ml(夏丹芪1组)和200 μg/ml(夏丹芪2组),作用24 h,检测相关指标。
5、取材和肺组织病理学观察氡暴露结束后24 h内,小鼠麻醉后眼球采血,收集各组小鼠血液和肺组织。全血在4℃,3 500 r/min离心10 min,离心半径6.8 cm,分离血清,-80℃冰箱保存。处死小鼠,取部分肺组织4%多聚甲醛固定,石蜡包埋、切片、脱水及水化,HE染色后光学显微镜下观察并拍照。Masson染色后显微镜下观察肺组织胶原纤维沉积情况。
6、MDA和SOD检测根据MDA和SOD检测试剂盒说明书进行操作,检测各组小鼠血清中MDA含量和SOD活性。
7、免疫组织化学检测石蜡切片常规脱蜡至水,高压抗原修复后,置于3%H2O2溶液中10 min清除内源性过氧化物酶,磷酸盐缓冲液(PBS)清洗5 min×3次,加入正常山羊血清室温封闭30 min,加入一抗(α-SMA、Vimentin)后4℃孵育过夜,PBS溶液洗涤5 min×3次,滴加二抗室温孵育30 min,PBS溶液5 min×3次,DAB溶液显色,适时终止反应,苏木素复染,梯度乙醇脱水,二甲苯透明后封片观察。
8、Transwell细胞迁移实验细胞沉淀用无生长因子基础培养基重悬后接种在Transwell上室(孔径8 μm)中,下室加入含生长因子的培养基,37℃、5%CO2温箱培养24 h,甲醇室温固定30 min,0.1%结晶紫染色20 min,湿棉棒擦去小室内表面细胞,PBS清洗3遍,显微镜下拍照并计数。每组设置3个复孔,重复3次。
9、细胞黏附性检测前1 d将96孔板进行包被并4℃过夜,细胞按5×104/孔接种,每组设置5个复孔,37℃孵育1 h,培养基洗涤2~3次,每孔加入100 μl细胞培养基,再加入10 μl染色液B,37℃孵育1 h,检测吸光度A450值。每组设置5个复孔,重复3次。
10、Western blot实验收集各组细胞,加入适量含蛋白酶抑制剂的裂解液,冰上裂解30 min,12 000 r/min离心10 min,离心半径6.8 cm,分离细胞上清,BCA法进行蛋白定量。浓缩胶电压80 V,30 min,分离胶电压120 V,90 min进行电泳;恒流300 mA,2 h进行转膜;5%脱脂奶粉室温封闭90 min;加入一抗(E-cadherin、Vimentin和GAPDH抗体),4℃孵育过夜,TBST溶液洗膜10 min×3次,二抗室温孵育90 min,TBST溶液洗膜10 min×3次后用ECL化学显色试剂盒显影,Image J软件定量分析后绘图。之后再重复2次上述操作。
11、统计学处理采用SPSS 23.0软件进行统计分析,数据符合正态分布及方差齐性,计量资料用
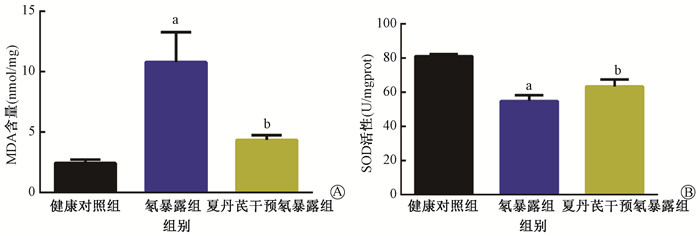
各组小鼠血清MDA含量和SOD活性差异有统计学意义(F=26.83、72.32,P < 0.05)。与健康对照组相比,氡暴露组小鼠外周血MDA含量明显升高(t=5.78,P < 0.01),SOD活性显著降低(t=14.53,P < 0.01)。与氡暴露组相比,夏丹芪干预氡暴露组小鼠血清MDA含量下降,且血清SOD活性升高,差异有统计学意义(t=4.43、3.22,P < 0.05),见图 1。
|
注:3组间比较,FMDA=26.83,P < 0.05;FSOD=72.32,P < 0.05;a与健康对照组相比,t=5.78、14.53,P < 0.05;b与氡暴露组相比,t=4.43、3.22,P < 0.05;MDA.丙二醛;SOD.超氧化物歧化酶 图 1 各组小鼠外周血MDA含量(A)和SOD活性(B) Figure 1 The MDA content (A) and SOD activity (B) in each group of mice |
2、夏丹芪对氡暴露小鼠肺组织病理损伤和胶原纤维沉积的影响
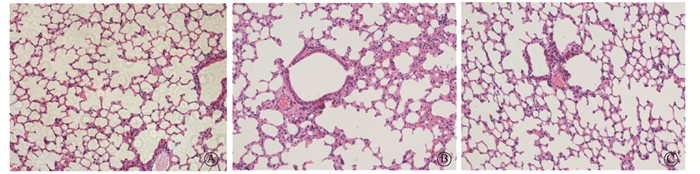
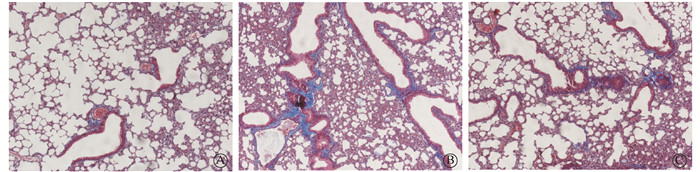
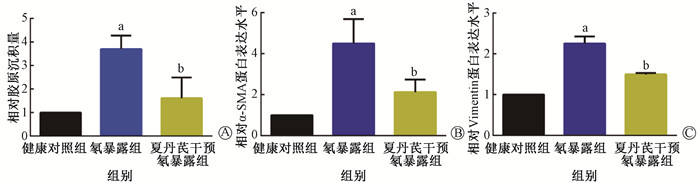
与健康对照组相比,氡暴露组小鼠肺组织可见肺泡结构严重破坏,肺泡壁不完整,肺间隔增厚和形成大量肺大泡及炎性细胞浸润。夏丹芪干预氡暴露组小鼠肺组织的炎性渗出情况减轻,肺泡壁破坏程度减弱,肺间隔增厚明显缓解(图 2)。Masson染色结果表明(图 3,4A),各组小鼠肺组织胶原纤维沉积量差异有统计学意义(F=16.38,P < 0.05)。与健康对照组相比,氡暴露组小鼠肺组织蓝色胶原纤维沉积增加(t=8.21,P < 0.05);与氡暴露组相比,夏丹芪干预氡暴露组小鼠肺组织胶原纤维沉积减少,差异有统计学意义(t=3.45,P < 0.05)。
|
图 2 各组小鼠肺组织病理学改变 HE染色×20 A.健康对照组;B.氡暴露组;C.夏丹芪干预氡暴露组 Figure 2 Histopathological changes of lung tissues in each group of mice HE staining ×200 A. Control group; B. Radon exposure group; C. Xiadanqi intervention and radon exposure group |
|
图 3 各组小鼠肺组织纤维沉积 Masson染色×10 A.健康对照组;B.氡暴露组;C.夏丹芪干预氡暴露组 Figure 3 Fiber deposition of lung tissues in each group of mice Masson staining ×100 A. Control group; B. Radon exposure group; C. Xiadanqi intervention and radon exposure group |
|
注:a与健康对照组相比,t=8.21、5.11、12.79,P < 0.05;b与氡暴露组相比,t=3.45、3.08、7.57,P < 0.05 图 4 各组小鼠肺组织胶原纤维沉积(A)、α-SMA蛋白(B)和Vimentin蛋白(C)相对表达量 Figure 4 The relative expression levels of collagen fibrous deposition (A), α-SMA protein (B) and Vimentin protein (C) in mice lung tissues |
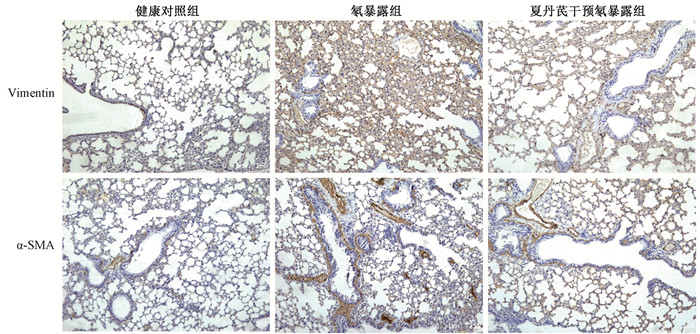
3、夏丹芪对氡暴露小鼠肺组织Vimentin蛋白α-SMA蛋白表达的影响
与健康对照组相比,氡暴露组小鼠肺组织Vimentin和α-SMA蛋白表达均显著增加(t=12.79、5.11,P < 0.05)。而夏丹芪干预氡暴露组小鼠肺组织Vimentin和α-SMA蛋白表达较氡暴露组有明显降低,差异有统计学意义(t=7.57、3.08,P < 0.05),见图 4B,C,5。
|
图 5 各组小鼠肺组织Vimentin和α-SMA蛋白表达情况IHC染色×100 Figure 5 The expression of Vimentin and α-SMA protein in lung tissues of each group of mice IHC staining ×100 |
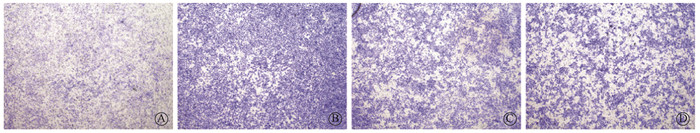
4、夏丹芪对氡暴露支气管上皮细胞迁移和黏附能力的影响
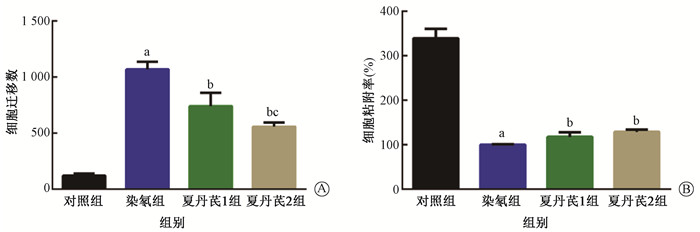
迁移实验发现,各组细胞迁移能力有差异(F=16.38,P < 0.05)。与对照组比,染氡组穿过Transwell上室膜细胞数量显著增多(t=26.53,P<0.05)。与染氡组比,夏丹芪1组、夏丹芪2组的迁移细胞数均明显减少(t=4.78、13.01,P<0.05),夏丹芪2组细胞迁移数量也显著少于夏丹芪1组(t=2.94,P<0.05),差异均具有统计学意义(图 6)。
|
图 6 各组细胞迁移能力 结晶紫染色×10 A.对照组;B.染氡组;C.夏丹芪1组;D.夏丹芪2组 Figure 6 The cell migration ability of each group Crystal violet staining ×100 A. Control group; B. Radon exposure group; C. Xiadanqi group 1; D. Xiadanqi group 2 |
在细胞黏附实验中,与对照组比,染氡组细胞黏附力显著降低(图 7B,t=22.73,P<0.01)。而与染氡组比,夏丹芪1组、夏丹芪2组细胞黏附能力均明显升高,差异均具有统计学意义(t=3.41、12.55,P<0.05)。
|
注:a与对照组相比,t=26.53、22.73,P < 0.05;b与染氡组相比,t=4.78、13.01、3.41、12.55,P < 0.05;c与夏丹芪1组相比,t=2.94,P < 0.05 图 7 各组细胞迁移能力(A)和黏附性(B)比较 Figure 7 Comparison of cell migration (A) and adhesion (B) in each group |
5、夏丹芪对氡暴露支气管上皮细胞E-cadherin和Vimentin蛋白表达的影响
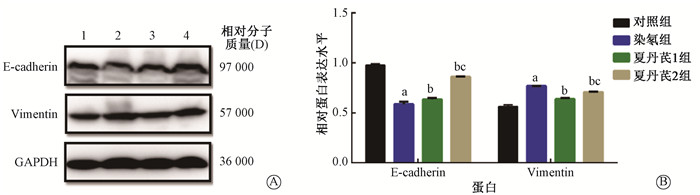
Western blot结果显示,与对照组比,染氡组上皮细胞E-cadherin蛋白表达明显减弱(t=24.96,P<0.05),Vimentin蛋白表达显著增高(t=20.26,P<0.05)。与染氡组比,夏丹芪1组和夏丹芪2组中,16HBE细胞的E-cadherin蛋白表达水平增高(t=2.96、19.57,P<0.05),且呈剂量依赖性,夏丹芪2组增高趋势更明显;中药干预后Vimentin蛋白的表达水平则出现不同程度的降低(t=21.00、33.32,P<0.05),其中夏丹芪1组的Vimentin蛋白表达水平在3组氡暴露细胞中最低(图 8)。
|
注:a与对照组相比,t=24.96、20.26,P < 0.05;b与染氡组相比,t=2.96、19.57、21.00、33.32,P < 0.05;c与夏丹芪1组相比,t=27.39、10.77,P < 0.05。1.对照组;2.染氢组;3.夏丹芪1组;4.夏丹芪2组 图 8 各组细胞E-cadherin和Vimentin蛋白表达水平 Figure 8 The expression of E-cadherin and Vimentin protein in cells |
讨论
大量研究已证实氡与肺癌发生显著相关,且氡浓度越高发生肺癌的可能性越大[8]。虽然世界卫生组织(WHO)和许多国家制定了一系列技术规范或标准来监测和限制氡及其子体浓度[9],以减少氡暴露危害,但在高本底地区和一些特殊场所,氡浓度仍较高,存在健康风险,且目前主要通过物理方法降低氡浓度来预防氡危害,缺乏氡辐射损伤防治的药物或制剂。有研究发现黑蜂胶和褪黑素等药物可通过降低氡暴露诱发的氧化应激发挥辐射防护作用[10-11]。黄芪和丹参可通过调节toll样受体4/NF-κB信号通路,减少肺组织蛋白浓度和炎性因子水平,改善脂多糖诱导的大鼠急性肺水肿和肺组织损伤[12],且丹参和黄芪对紫外线诱导的皮肤损伤和放射性肠损伤也具有良好的保护作用[13-14]。冬虫夏草因具有良好的抗炎、抗氧化和抗病原微生物能力,已被用于慢性阻塞性肺气肿、慢性支气管炎等多种肺部疾病的治疗[15]。因此,本研究主要目的为探索由冬虫夏草、黄芪和丹参组成的中药组合物对氡暴露损伤的辐射防护作用。
本研究发现,氡暴露小鼠外周血氧化水平升高,给予2 mg/kg的夏丹芪干预后可显著降低氡暴露小鼠MDA含量,提高SOD活性,有效减弱氡暴露诱发的小鼠外周血氧化应激。同时,夏丹芪可减少氡暴露诱发的肺大泡、肺间隔增厚和破损肺泡结构,缓解氡暴露诱发的肺损伤。以上结果与孙军霞[16]在大鼠中的研究结果一致。于卫国等[17]研究发现,每次照射0.1 Gy,连续5次,累积0.5 Gy的X射线可致SD大鼠外周血SOD活性和谷胱甘肽(GSH)含量降低,MDA含量增加,机体抗氧化能力下降,而丹参可增加GSH含量和SOD活性,降低MDA含量,提高机体的抗氧化能力,对机体电离辐射损伤起到防护作用。Masson染色结果表明,氡暴露后小鼠肺组织胶原纤维沉积增加,说明氡暴露可致小鼠肺组织出现纤维化,夏丹芪干预后可有效缓解氡暴露小鼠肺组织纤维化进展。Vimentin和α-SMA蛋白与细胞骨架的组成和肌成纤维细胞的生成相关,是组织纤维化和Ⅱ型上皮细胞间质转化(EMT)发生的重要标志物[18-19]。氡暴露小鼠肺组织Vimentin和α-SMA蛋白表达水平增高,提示氡暴露可使肺组织出现EMT和纤维化。夏丹芪干预后小鼠肺组织Vimentin和α-SMA蛋白表达减弱,说明夏丹芪可通过降低Vimentin的表达抑制肿瘤细胞骨架的重塑,从而使其不易从原发灶处游离[20],而α-SMA由肌成纤维细胞特异性表达,α-SMA表达的降低则提示中药干预后肌纤维母细胞分化能力的降低以及肌成纤维细胞生成的减少,从而减慢氡暴露小鼠肺纤维化进程。研究发现,冬虫夏草可降低肾组织胶原积累和间质细胞标志物BAG3、α-SMA的表达,缓解梗阻大鼠的肾纤维化[21]。同时,冬虫夏草也可减少肺组织炎性细胞聚集和产生,缓解气道壁增厚、纤维化及上皮增生,抑制COPD大鼠的气道重构[22]。黄芪也可降低间充质蛋白N-cadherin、α-SMA和Ⅰ型胶原表达,增加E-cadherin表达,抑制过敏物诱发的呼气道EMT[23]。
体外实验结果表明,氡暴露后细胞迁移能力增强,细胞黏附性下降,E-cadherin蛋白表达降低,Vimentin蛋白表达增加,上皮细胞发生EMT。这与之前研究结果一致[24],氡及其子体可通过激活PI3K/AKT/mTOR通路,减弱E-cadherin表达,提高Vimentin水平,进而诱导上皮细胞出现EMT。E-cadherin是EMT上皮细胞标志物,是介导细胞之间相互粘附的钙依赖性跨膜糖蛋白,氡及其子体可以破坏上皮细胞间E-cadherin复合体的完整性,降低其在上皮细胞中的表达,从而使细胞粘附能力降低[25]。同时,原本以角蛋白为主的细胞骨架在氡及其子体照射后转变为以Vimentin蛋白为主的细胞骨架,使支气管上皮细胞由上皮源性转向间质性,二者的共同作用最终导致细胞迁移能力增强和黏附率降低。本研究显示,使用150和200 μg/ml的夏丹芪干预后,氡暴露细胞迁移能力明显减弱,细胞黏附性提高,E-cadherin蛋白表达增加和Vimentin蛋白表达减少,说明中药组合物夏丹芪可减缓氡暴露诱发的上皮细胞EMT。Dong等[26]发现,冬虫夏草提取物可通过调节p38/ERK信号通路,提高细胞黏附性,降低纤维连接蛋白FN、I型胶原和α-SMA的表达,使E-cadherin表达升高,从而抑制高糖所致的HK-2细胞的EMT。丹参酮可通过抑制TGF-β/Smad信号通路的激活,减缓细胞EMT和肺纤维化,从而保护二氧化硅诱导的肺损伤。张利英等[27]和李洋洋等[28]发现,黄芪可通过抑制辐射激活NF-κB信号通路,促进重离子12C6+辐射后人骨髓间充质干细胞增殖,减少细胞微核率和53BP1焦点数,有效缓解辐射诱导的细胞损伤。以上结果表明,冬虫夏草、黄芪和丹参可通过多种途径,缓解辐射或其他因素诱发的EMT,从而对疾病发挥良好的防护作用。
本研究发现夏丹芪可通过减弱氡暴露诱发的氧化应激,降低细胞迁移能力,提高细胞黏附性,缓解氡暴露诱发的上皮细胞EMT和肺组织纤维化,对氡暴露损伤具有一定的辐射防护作用。该结果可为中药组合物夏丹芪在氡暴露损伤的防护提供选择依据,为临床辐射防护奠定理论基础,但是关于夏丹芪的辐射防护作用机制尚不明确,有待进一步研究。
利益冲突 无
作者贡献声明 黎晏卿和陈慧芹负责实验和数据分析,并撰写论文;江其生、张蓉、程菲、崔凤梅和涂彧指导并修改论文;史更生和田思琦协助完成实验
| [1] |
International Agency for Research on Cancer. IARC Monographs on the evaluation of the carcinogenic risks to humans. Man-made mineralfibres and radon[R]. Lyon: IARC, 1988, 43: 1-300.
|
| [2] |
Ou JY, Fowler B, Ding Q, et al. A statewide investigation of geographic lung cancer incidence patterns and radon exposure in a low-smoking population[J]. BMC Cancer, 2018, 18(1): 115. DOI:10.1186/s12885-018-4002-9 |
| [3] |
Robertson A, Allen J, Laney R, et al. The cellular and molecular carcinogenic effects of radon exposure: a review[J]. Int J Mol Sci, 2013, 14(7): 14024-14063. DOI:10.3390/ijms140714024 |
| [4] |
冯菲菲. 丹参酮IIA对矽肺肺损伤及纤维化的保护作用及机制研究[D]. 济南: 山东大学, 2020. DOI: 10.27272/d.cnki.gshdu.2020.000658. Feng FF. The protective effect and its mechanism of Tanshione IIA on pulmonary injury and fibrosis of silicosis[D]. Jinan: Shangdong University, 2020. DOI: 10.27272/d.cnki.gshdu.2020.000658. |
| [5] |
Tan X, Xu M, Liu F, et al. Antimetastasis effect of astragalus membranaceus-curcuma zedoaria via beta-catenin mediated CXCR4 and EMT signaling pathway in HCT116[J]. Evid Based Complement Alternat Med, 2019, 2019: 9692350. DOI:10.1155/2019/9692350 |
| [6] |
邱健健, 张奕敏, 李光荣, 等. 冬虫夏草在呼吸系统炎性疾病的药理及临床研究进展[J]. 菌物研究, 2020, 18(2): 86-92. Qiu JJ, Zhang YM, Li GR, et al. Pharmaceutical and clinical research progress on Chinese cordycepsand related products against respiratory inflammatory diseases[J]. J Fungal Res, 2020, 18(2): 86-92. DOI:10.13341/j.jfr.2020.1339 |
| [7] |
Zhang HW, Lin ZX, Tung YS, et al. Cordyceps sinensis (a traditional Chinese medicine) for treating chronic kidney disease[J]. Cochrane Database Syst Rev, 2014(12): CD008353. DOI:10.1002/14651858.CD008353.pub2 |
| [8] |
Dempsey S, Lyons S, Nolan A. High radon areas and lung cancer prevalence: evidence from Ireland[J]. J Environ Radioact, 2018, 182: 12-19. DOI:10.1016/j.jenvrad.2017.11.014 |
| [9] |
Zeeb H, Shannoun F. WHO handbook on indoor radon: a public health perspective[M]. Geneva: World Health Organization, 2009.
|
| [10] |
Wu Q, Fang L, Yang Y, et al. Protection of melatonin against long-term radon exposure-caused lung injury[J]. Environ Toxicol, 2021, 36(4): 472-483. DOI:10.1002/tox.23052 |
| [11] |
丁建松, 聂继华, 童建. 蜂胶对氡及其子体吸入致大鼠损伤的防护作用研究[J]. 辐射研究与辐射工艺学报, 2006, 24(5): 317-320. Ding JX, Nie JH, Tong J. The protective effect of propolis on damage to lung and blood in rats by inhaled radioactive radon and its progeny[J]. J Rad Res Rad Proc, 2006, 24(5): 317-320. DOI:10.3969/j.issn.1000-3436.2006.05.013 |
| [12] |
Qin L, Tan HL, Wang YG, et al. Astragalus membranaceus and Salvia miltiorrhiza ameliorate lipopolysaccharide-induced acute lung injury in rats by regulating the toll-like receptor 4/nuclear factor-kappa b signaling pathway[J]. Evid Based Complement Alternat Med, 2018, 2018: 3017571. DOI:10.1155/2018/3017571 |
| [13] |
Hong MJ, Ko EB, Park SK, et al. Inhibitory effect of Astragalus membranaceus root on matrix metalloproteinase-1 collagenase expression and procollagen destruction in ultraviolet B-irradiated human dermal fibroblasts by suppressing nuclear factor kappa-B activity[J]. J Pharm Pharmacol, 2013, 65(1): 142-148. DOI:10.1111/j.2042-7158.2012.01570.x |
| [14] |
郭娟, 张琰君, 安广洲, 等. 丹参素对于电离辐射损伤小鼠的防护作用[J]. 时珍国医国药, 2015, 26(8): 1811-1813. Guo J, Zhang YJ, An GZ, et al. Protective-effects of salvianic acid A on ionizing irradiated mice[J]. Lishizhen Med Mater Med Res, 2015, 26(8): 1811-1813. |
| [15] |
Chen P X, Wang S, Nie S, et al. Properties of Cordyceps sinensis: A review[J]. J Funct Foods, 2013, 5(2): 550-569. DOI:10.1016/j.jff.2013.01.034 |
| [16] |
孙军霞. 氡及其子体对大鼠靶器官的损伤效应及氡防护剂防护效果的研究[D]. 苏州: 苏州大学, 2012. Sun JX. The effects of radon and its daughter on targeted organs and protective effect of radon-protection agent in rats[D]. Suzhou: Soochow University, 2012. |
| [17] |
于卫国, 张杰, 张蕾, 等. 丹参对电离辐射致SD大鼠损伤的防护研究[J]. 江西医药, 2019, 54(10): 1193-1195. Yu WG, Zhang J, Zhang L, et al. Protective effects of Danshen on SD rats induced by ionizing radiation[J]. Jiangxi Med J, 2019, 54(10): 1193-1195. DOI:10.3969/j.issn.1006-2238.2019.10.014 |
| [18] |
Nieto MA, Huang RY, Jackson RA, et al. Emt: 2016[J]. Cell, 2016, 166(1): 21-45. DOI:10.1016/j.cell.2016.06.028 |
| [19] |
Zeisberg M, Neilson EG. Biomarkers for epithelial-mesenchymal transitions[J]. J Clin Invest, 2009, 119(6): 1429-1437. DOI:10.1172/JCI36183 |
| [20] |
Battaglia RA, Delic S, Herrmann H, et al. Vimentin on the move: new developments in cell migration[J]. F1000Res, 2018, 7: 1796. DOI:10.12688/f1000research.15967.1 |
| [21] |
Du F, Li S, Wang T, et al. Cordyceps sinensis attenuates renal fibrosis and suppresses BAG3 induction in obstructed rat kidney[J]. Am J Transl Res, 2015, 7(5): 932-940. |
| [22] |
Yang L, Jiao X, Wu J, et al. Cordyceps sinensis inhibits airway remodeling in rats with chronic obstructive pulmonary disease[J]. Exp Ther Med, 2018, 15(3): 2731-2738. DOI:10.3892/etm.2018.5777 |
| [23] |
Yao L, Wang S, Wei P, et al. Huangqi-Fangfeng protects against allergic airway remodeling through inhibiting epithelial-mesenchymal transition process in mice via regulating epithelial derived TGF-beta1[J]. Phytomedicine, 2019, 64: 153076. DOI:10.1016/j.phymed.2019.153076 |
| [24] |
Chen H, Chen N, Li F, et al. Repeated radon exposure induced lung injury and epithelial-mesenchymal transition through the PI3K/AKT/mTOR pathway in human bronchial epithelial cells and mice[J]. Toxicol Lett, 2020, 334: 4-13. DOI:10.1016/j.toxlet.2020.09.008 |
| [25] |
李婧, 汪弋力, 王晓芳, 等. 艾灸肺俞、膏肓俞治疗肺纤维化大鼠对E-cad、α-SMA、vimentin的影响[J]. 辽宁中医杂志, 2017, 44(5): 1078-1081, 1118-1120. Li J, Wang GL, Wang XF, et al. Regulation of E-cad, α-SMA and vimentin through moxibustion at Feishu and Gaohuangshu of pulmonary fibrosis rats[J]. Liaoning J Trad Chin Med, 2017, 44(5): 1078-1081, 1118-1120. DOI:10.13192/j.issn.1000-1719.2017.05.058 |
| [26] |
Dong Z, Sun Y, Wei G, et al. A nucleoside/nucleobase-rich extract from cordyceps sinensis inhibits the epithelial-mesenchymal transition and protects against renal fibrosis in diabetic nephropathy[J]. Molecules, 2019, 24(22): 4119. DOI:10.3390/molecules24224119 |
| [27] |
张利英, 王磊, 张丽昕, 等. 黄芪多糖对重离子辐射BMSCs防护作用及与NF-κB相关机制研究[J]. 中华中医药杂志, 2018, 33(12): 5576-5580. Zhang LY, Wang L, Zhang LX, et al. Protective effect of Astragalus polysaccharide on heavy ionizing radiation on BMSCs and its mechanism related with NF-κB China[J]. Tradit Chin Med Pharm, 2018, 33(12): 5576-5580. |
| [28] |
李洋洋, 张苡铭, 魏孔熙, 等. 黄芪不同有效成分对电离辐射致BMSCs DNA损伤防护作用的比较研究[J]. 中国药房, 2020, 31(24): 2987-2992. Li YY, Zhang YM, Wei KX, et al. Comparative study on the protective effects of different effective components of Astragali radix against ionizing radiation-induced BMSCs DNA damage[J]. Chin Pharm, 2020, 31(24): 2987-2992. DOI:10.6039/j.issn.1001-0408.2020.24.07 |
 2021, Vol. 41
2021, Vol. 41


