随着核技术在民用和军事上日益广泛的发展应用,人们对发生放射性核事故的可能性日益关切。大于6 Gy的全身电离辐射(ionizing radiation, IR)会导致人体出现恶心、腹泻和脱水等症状的胃肠综合征[1-2],最终导致多组织器官的衰竭,危及生命。目前临床通过药物干预、益生菌治疗、手术等治疗放射性肠损伤,但尚不能达到令人满意的效果[3],例如小肠移植(SBT)的成功率约为60%,明显低于其他移植器官[4]。近几年,干细胞在机体放射防护方面一直是研究热点,科研人员期望能找出新的方法治疗放射性肠损伤。
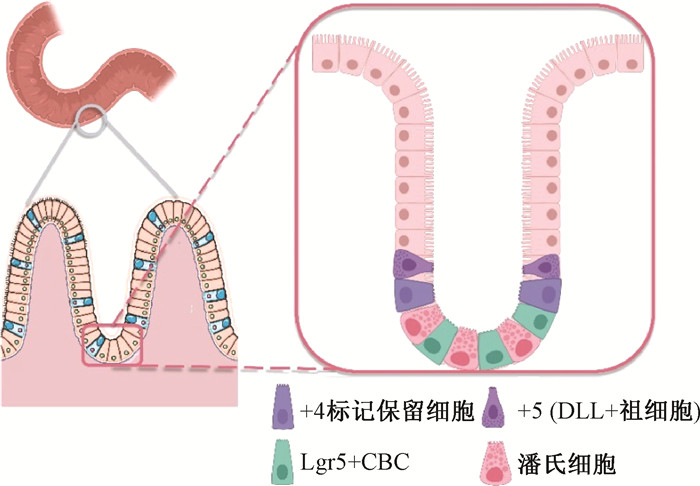
肠道干细胞(intestinal stem cells, ISCs) 位于小肠隐窝底部(图 1),维持肠上皮细胞的自我更新,每个隐窝内含有4~6个活跃肠道干细胞,约24 h分裂一次;其子细胞向绒毛顶端不断分裂并分化为成熟的肠上皮细胞,以补充肠上皮细胞的凋亡脱落。已有研究表明,肠道干细胞中的+4标记保留细胞对电离辐射有一定的耐受能力,且可以通过自我增殖来恢复辐射引起的损伤[5],这为治疗放射性肠损伤提供了一种新的方向。为了更深入探究ISCs在放射性肠损伤防护中的重要作用及意义,本文从肠道干细胞的分类、干细胞的调节机制以及具有调控干细胞损伤、凋亡、修复作用的药物等方面进行综述。
|
图 1 小肠隐窝与肠道干细胞示意图 Figure 1 Schematic diagram of small intestinal crypt and intestinal stem cells |
一、肠道干细胞(ISCs) 1、隐窝基底柱状细胞(crypt base columnar cells, CBCs)
CBCs是位于隐窝底部的连续循环增殖细胞(图 1)[6],以富含亮氨酸重复序列的G蛋白偶联受体5 (Lgr5)为特异性标志物[7]。Lgr5+ CBCs具有较高的分裂活性,负责调节肠道稳态,是上皮细胞更新的主要来源,但Lgr5+ CBCs对辐射损伤极为敏感[8]。12 Gy射线腹部照射的小鼠2 d后Lgr5+ CBCs已几乎全部消失,且由其增殖分化得到的下游细胞也随之减少。照射后4.5~7 d内,只有约占隐窝细胞数量1/180的Lgr5+ CBCs会重新出现,但肠道结构无法重建[9]。Chaves-Pérez等[10]利用非传统型前折叠束RPB5交互因子(URI) 标记ISCs,发现URI表达较低的细胞,如Lgr5+ CBCs会高度增殖,因此具有放射敏感性。但Barriga等[11]发现,由Mex3a标志的一种慢循环Lgr5+ CBCs处于隐窝底部+3/+4位置,也具有储备干细胞的特点,即在稳态情况下缓慢分裂,具有辐射抗性,且有助于辐射损伤后ISCs再生。
2、储备干细胞(reserve stem cells, RSCs)RSCs表型定义为细胞在稳态条件下维持干细胞数量并处于静止状态的特征,并且当CBCs受到损害时可以重新获得类CBCs的增殖状态。尽管RSCs主要与+4标记保留细胞相关,但越来越多的证据表明,许多肠道细胞具有类RSCs活性[12]。在本文中,RSCs指对稳态肠上皮更新没有贡献,但在损伤后介导肠道再生的细胞(表 1)。目前尚不清楚RSCs是否指某一种干细胞类型,或者是否存在大量具有不同干细胞活性的细胞类型,若是如此,这些细胞可用于胃肠道疾病的再生治疗策略。
|
|
表 1 肠道干细胞分类及特征 Table 1 Classification and characterization of intestinal stem cells |
之前有研究揭示了Lgr5+ CBC细胞与储备干细胞各司其职的关系[9],近些年有人提出Lgr5+ CBC细胞表达RSCs的标志物[13],及RSCs在电离辐射后Lgr5表达增加[12, 14-15],提示Lgr5+ CBC细胞与储备干细胞互为表里。随着肠道辐射损伤防护机制的深入研究,RSCs家族将得到更多关注。
(1)+4标记保留干细胞:“+4”是一个近似值,指由隐窝底部至肠绒毛方向计数的第4~7位细胞(图 1)。+4标记保留干细胞是经典的RSCs之一,不仅具有辐射抵抗的能力,且能在肠道受到损伤的情况下被激活,以重建小肠结构[9]。在证实Bmi1等为+4标记保留干细胞的标志物[9, 16-17]之后,Yan等[9]将纯化得到的单个Bmi1+细胞克隆培养后产生了一种球体细胞,这些球体具有源于Lgr5+CBCs球体相同的内源因子,并且具有持续增殖、连续传代的能力,可以断定该球体中包含了Lgr5+CBCs。
可见Lgr5+CBCs和+4标记保留干细胞可以相互转化,并非组成不可逆转的分离谱系。缓慢循环的+4标记保留干细胞可以被激活并具有Lgr5+CBCs活性[18],反之亦然[19]。但复杂的是,这两种干细胞可能部分重叠,虽然大多数Lgr5+CBCs是增殖干细胞,但一部分的Lgr5+细胞是非分裂的分泌前体,可共表达+4标记保留干细胞的标志物,如Bmi1[13, 20]。这些前体通常局限于分泌状态,可在组织损伤时被促进为多能干细胞状态,从而影响肠道修复[20]。
(2) 具有RSCs特征的小肠细胞:近几年研究表明还有一些祖细胞、肠分泌细胞和吸收细胞等也具有RSCs特征,具有很大的表型可塑性,可以响应损伤而重新获得干细胞的特征和功能[12]。
van Es等[15]发现Dll+祖细胞源于CBC细胞,照射后将Dll+细胞置于高Wnt信号刺激环境中培养,Dll+细胞在体外恢复为Lgr5+干细胞,同时小鼠体内模型中Dll+细胞也恢复为Lgr5+细胞。SOX9+分泌祖细胞在照射后显现出ISCs特性,其在体内外通过上调细胞周期激酶、有关DNA修复等基因产生的类器官,能迅速形成隐窝状结构[21]。
Yan等[22]使用比较性RNA测序和单细胞转录组学,定义Bmi1-GFP+和Prox1+细胞为肠内分泌谱系细胞,在体内稳态过程中以及放射损伤后的隐窝再生期间具有肠道干细胞活性。在靶向消除Lgr5+CBCs后,表达碱性磷酸肠基因(Alpi)的肠上皮祖细胞产生了许多长寿隐窝绒毛“色带”,表明肠上皮细胞分化为Lgr5+CBCs[23]。
(3) 其他具有RSCs特征的干细胞:Ayyaz等[24]通过对再生小肠隐窝的单细胞转录组测序发现并定义了一种以簇集素(CLU)为标记物的复活干细胞(revSCs)。在稳态条件下CUL+干细胞数量极少,但会在辐射或者化疗损伤之后经过YAP1依赖性的瞬时增殖,重建Lgr5+CBCs以及隐窝结构,并参与再生功能性肠道的构建。
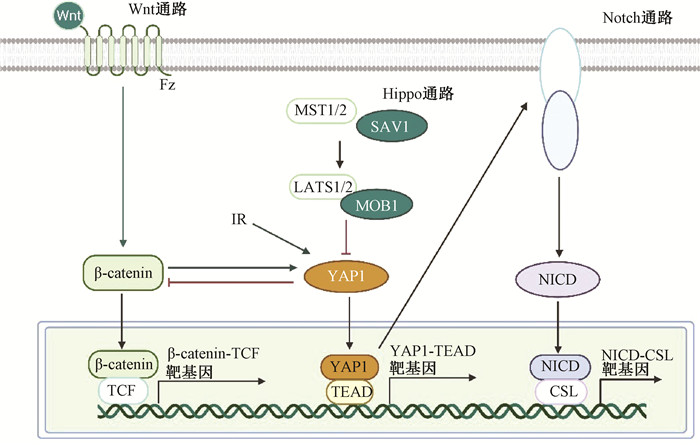
二、放射性肠损伤后肠道干细胞的调节 1、调节ISCs的主要通路肠道干细胞龛(intestinal stem cell niche)可以定义为维持干细胞自我更新和增殖所必需的微环境。稳态干细胞龛维持Lgr5+CBCs的活性与RSCs的相对静止,维持细胞干性;小肠受到损伤后,干细胞龛通过Wnt、Hippo、Notch等通路激活RSCs以影响上皮修复[25-26]。进一步了解如何整合干细胞龛中各种信号通路以调节ISCs功能是这一领域的主要挑战。
(1) Wnt/β-catenin:Wnt信号对维持小肠干细胞的活性、促进肠上皮发育和更新至关重要[27-28](图 1)。利用Wnt靶基因Lgr5作为CBCs标记证明其分化为肠道各种细胞[7],因此,ISCs之所以处于富含Wnt的环境中,是因为其增殖需要Wnt[29];随着细胞远离隐窝结构,其接受到的Wnt刺激也愈低。而最近有研究证明Wnt蛋白无法独自诱导Lgr5+ CBCs更新,而是通过诱导自我更新因子RSPO受体表达(Lgr5、Rnf43和Znrf3)来激活Lgr5+ISCs启动增殖的能力[30]。这提示Wnt通路中RSPO蛋白也可作为促进ISCs增殖的一个重要靶点。
Wnt对Lgr5+CBCs的增殖有促进作用,且在照射后激活储备干细胞以重塑隐窝结构。Suh等[14]发现,照射使肠道干细胞龛中的活性氧(ROS)升高,并通过ROS-HIF-Wnt 2b信号轴激活Tert+细胞中Wnt/β-catenin通路,从而导致Tert+细胞被激活进入,增加Lgr5+蛋白表达并促进肠道结构恢复与再生。
(2) Hippo:Hippo通路通过调节细胞的增殖、凋亡和分化在肠道细胞谱系分化、组织稳态及调控器官大小中起到重要作用[31],其在肠道稳态中的作用本文不再赘述,重点说明其在辐射肠损伤后的肠道重构中的作用。研究发现,Hippo通路的下游转录因子Yes相关蛋白1(YAP1)在小鼠全身照射2~4 d后激活,且ISCs特异敲除YAP1小鼠显示辐照损伤后隐窝增殖水平降低。YAP1通过瞬时性抑制Wnt通路、激活EGFR通路重塑肠道干细胞,避免肠道在照射损伤后由于Wnt过度表达引起的肠道隐窝增生[32]。这提示Hippo通路在放射性肠损伤恢复中的作用,及Wnt与Hippo通路协调工作以保证放射性肠损伤后组织的正常恢复。
(3) Notch:Notch与Wnt通路共同维持肠道干细胞的干性,Carulli等[33]研究发现Notch1和Notch2缺失的肠道受到IR后隐窝再生受损,尤其是干细胞受到Notch1缺失的影响,Olfm4的表达和Lgr5+干细胞减少,证明Notch1和Notch2是受照后调节肠道干细胞功能的主要受体之一。Notch与Wnt通路共同决定ISCs的命运——当潘氏细胞中的Notch通路和Wnt通路同时激活时,Notch配体Dll使相邻的CBCs保持未分化的干性状态;当Wnt通路不活跃而Notch通路激活时,通过Atoh1调节ISCs分化为肠上皮细胞;而Wnt通路激活与Notch通路抑制时会导致ISCs向分泌祖细胞谱系分化[33-35]。
在肠道受到辐射损伤后,激活的YAP1转录上调Notch受体的表达,导致Notch信号激活和NICD向细胞核的易位,因此Notch常被认为是Hippo通路的中介物[31, 36](图 2),但其中的分子机制仍未被阐明。
|
图 2 Wnt、Hippo与Notch通路的关系图 Figure 2 Relationship of Wnt, Hippo and Notch pathway |
2、潘氏细胞(Paneth cells, PCs)
潘氏细胞位于隐窝底部,与CBCs交叉分隔排列。PCs分泌抗菌肽提供Wnt配体、表皮生长因子(EGF)和Notch配体来维持CBCs,协助稳定肠道微生物群、建立干细胞龛以及促进细胞更新[37]。Sato等[35]发现PCs通过分泌ISCs必需的因子来维持CBCs,而且PCs可使突变隐窝恢复成正常的ISCs。Burgering实验室发现由PCs产生的作为有效的自由基清除剂和抗氧化剂的乳酸可用作CBCs中线粒体代谢的底物[38],提示来自潘氏细胞的乳酸盐可以为CBCs持续增殖提供能量底物,并保护CBCs免受过度的氧化应激。Yu等[39]发现IR诱导PCs通过Notch通路获得干细胞特性,这些PCs具有类干细胞样转录组和形成类器官的能力,加快放射性肠损伤的恢复。
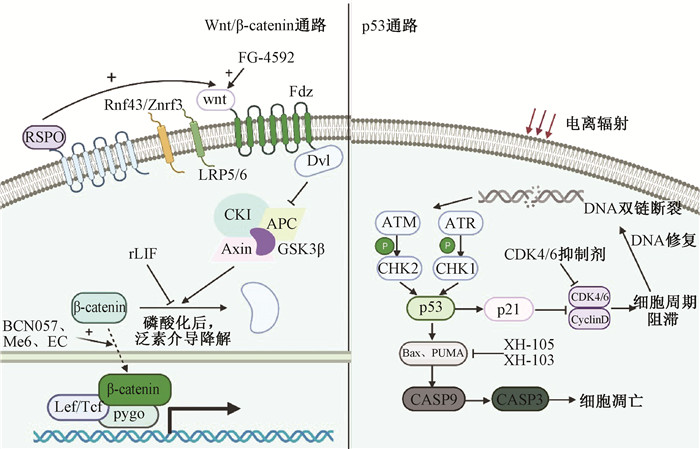
三、影响ISCs辐射损伤修复的药物对于影响ISCs辐射损伤修复的药物不多,并且尚没有系统的分类。本文对这些药物做一总结,并根据药物作用特点将其分为以下几类(图 3)。
|
图 3 相关药物作用与通路图 Figure 3 The action and pathway diagram of related drugs |
1、促进损伤ISCs增殖
由于Wnt通路在辐射损伤修复过程中的重要作用,目前大部分相关药物是针对上调Wnt/β-catenin达到促进IR后ISCs增殖、促进肠道修复的作用。
(1)BCN057:BCN057是一种以G蛋白偶联受体为部分靶点的新型小分子。Bhanja等[40]利用TCF/LEF荧光素酶报告基因测试等技术验证了在照射后24 h给予BCN057促进β-catenin的核易位,激活Wnt/β-catenin通路以减轻IR对ISCs的辐射毒性,并减轻小肠结构损伤,提高受照小鼠的生存率。
(2)三[2-(二甲基氨基)乙基]胺(Me6TREN,Me6):Me6是一种生物碱类似物,通过刺激S552位点的β-catenin磷酸化,促进β-catenin的核易位,正向调控β-catenin的转录活性,激活ISCs增殖的相关基因并促进Ascl2、Lgr5、Myc和CyclinD1等基因的表达,能显著改善照射后ISCs和隐窝细胞的再生,提高照射后小鼠的生存率[41]。
(3)白血病抑制因子(LIF):LIF通过抑制AKT/GSK3β信号传导,以抑制β-catenin泛素化降解并维持β-catenin活性,从而调节ISCs功能。在高剂量辐射后的小鼠会由于LIF缺乏影响肠道上皮的再生,导致小鼠生存率降低,而辐射后通过重组LIF(rLIF)治疗可促进肠道上皮的再生并延长小鼠的生存期[42]。
2、减少细胞凋亡和DNA损伤这类药物多是通过抑制p53通路减少细胞凋亡和DNA损伤,或促进DNA损伤修复,从而减轻放射性肠损伤。p53的两个转录靶标——p21和PUMA对于ISCs具有相反的调控作用(图 3):在高剂量辐射后依赖PUMA的细胞凋亡使ISCs和祖细胞迅速死亡,p21可引起辐射诱导的隐窝的检查点激活和DNA修复,提高了动物的生存率和隐窝再生;而且通过PUMA敲除或小分子PUMA抑制剂治疗可防止Lgr5+CBCs坏死、干细胞龛的扰动及受照后干细胞的衰竭[43-44]。但是最近也有研究表明,通过用Mdm2抑制剂药理增强小鼠的p53活性可防止辐射诱发的胃肠道不良反应,达到对辐射后胃肠的保护作用[45]。
(1)XH-103与XH-105:田红旗实验室将天然产物中的槲皮素与氨基硫醇类似物结合而成了具有相似的化学结构产物XH-103与XH-105,并发现两者均可降低辐射后p53和Bax表达的水平,减轻小肠细胞凋亡和DNA损伤,并以此改善照射后ISCs及小鼠的生存率[46-47]。XH-103和XH-105可降低p53和Bax表达的水平表明他们可能通过抑制依赖p53的细胞凋亡途径减轻辐射引起的肠损伤。
(2)CDK4/6抑制剂:细胞周期蛋白依赖性激酶(CDK)4/6对细胞周期G1/S转化至关重要,而电离辐射引发的DNA损伤会通过p53通路触发G1检查点引起细胞周期阻滞,CDK4/6的抑制可使细胞顺利进入G1检查点并进行自身修复。Wei等[48]发现用PD-0332991(PD)或CDK4/6抑制剂治疗照射后的小鼠可抑制隐窝细胞凋亡和改善辐射后Lgr5+干细胞的存活和隐窝再生。PD等主要通过可逆地抑制辐射激活的p53通路,从而阻滞PUMA依赖性凋亡,而不影响p21依赖性DNA修复以维持恢复放射性肠损伤所需的ISCs的数量与功能。
3、降低氧化应激机体在受到电离辐射后,会短时间内产生大量活性氧(ROS)损伤DNA、蛋白质等大分子,引起细胞凋亡和机体损伤。目前,降低肠道氧化应激以保护ISCs的药物较少,这一研究方向具有很大的潜力。(-)-表儿茶素(EC)是常见的黄酮类化合物,它可以通过调节血液和肠道中的超氧化物歧化酶和丙二醛水平来抑制氧化应激。Li等[49]发现EC通过Nrf2通路清除ROS以改善ISCs活性的同时,通过上调Wnt/β-catenin通路增加了ISCs活性,两者的协同作用使照射后的小鼠肠损伤降低、生存率升高。
4、其他(1)肽类:Ghrelin是一种主要由小肠内分泌细胞产生的内源性肽激素,研究发现Ghrelin通过激活Notch信号诱导受照肠道上皮细胞增殖,减轻辐射引起的肠道损伤[50]。新型再生肽TP508可刺激粘附蛋白E-钙粘蛋白的表达,减少细胞凋亡并防止肠隐窝解体,同时TP508可以通过激活RSCs并增加隐窝干性潜力,从而减轻辐射对胃肠道的不良反应和促进放射性肠损伤的恢复[51]。
(2)HIF蛋白调节剂: 在常氧条件下,脯氨酸羟化酶结构域(PHD)在脯氨酸残基上羟基化缺氧诱导因子(HIF),使HIF进行蛋白酶体降解。有研究表明,抑制PHD可引起HIF的上调进而减轻放射性肠损伤。Taniguchi等[52]发现PHD小分子抑制剂——二甲基乙二烯氨基乙酸(DMOG)可通过HIF-2改善照射后肠上皮完整性和胃肠道功能,但由于肠道缺氧的生理环境,这种作用在ISCs中并不明显。
另一种调节HIF蛋白的靶点以更高的氧亲和力引起关注,即HIF抑制因子(FIH)。Meng等[53]合成的NOFD(N-草酰基-D-苯丙氨酸)是FIH的特异抑制剂,能够降低辐射后细胞内ROS水平,减轻辐射引起的DNA损伤和凋亡,同时促进细胞中HIF调控的下游基因的表达,包括:Notch-1、Notch-2、VEGF等,具有一定的辐射防护作用。
四、小结与展望ISCs是人体内更新速度最快的细胞之一,近年来其在辐射防护中的作用研究也成为热点。本文概述了ISCs调控放射性肠损伤修复的机制及相关药物,对于研究放射性肠损伤修复非常重要。+4标记保留细胞是辐射损伤后肠道结构修复的重要细胞,而有关其调控机制和相关药物的研究进展比较缓慢;Wnt、Notch、BMP等重要通路的研究取得重要进展,但是针对这些通路的靶点药物开发还需要继续深入。未来对于RSCs在辐射损伤修复中的调控机制与开发基于明确靶点的靶向小分子药物将是肠道辐射防护研究的重要方向。
利益冲突 全体作者无利益冲突,未接受任何不正当职务及财政利益,并对本文的独立性和科学性予以保证
志谢 感谢中国医学科学院医学与科技创新工程基金(CIFMS,2017-12 M-3-019)对本研究的资助
作者贡献声明 张子琪负责资料搜集、撰写论文;龙伟负责指导写作;徐文清负责审阅文章的知识性内容及指导修改
| [1] |
Dubois A, Walker RI. Prospects for management of gastrointestinal injury associated with the acute radiation syndrome[J]. Gastroenterology, 1988, 95(2): 500-507. DOI:10.1016/0016-5085(88)90512-4 |
| [2] |
Shadad AK, Sullivan FJ, Martin JD, et al. Gastrointestinal radiation injury: symptoms, risk factors and mechanisms[J]. World J Gastroenterol, 2013, 19(2): 185-198. DOI:10.3748/wjg.v19.i2.185 |
| [3] |
Harb AH, Abou FC, Sharara AI. Radiation enteritis[J]. Curr Gastroenterol Rep, 2014, 16(5): 383. DOI:10.1007/s11894-014-0383-3 |
| [4] |
Garg M, Jones RM, Vaughan RB, et al. Intestinal transplantation: current status and future directions[J]. J Gastroenterol Hepatol, 2011, 26(8): 1221-1228. DOI:10.1111/j.1440-1746.2011.06783.x |
| [5] |
Hua G, Thin TH, Feldman R, et al. Crypt base columnar stem cells in small intestines of mice are radioresistant[J]. Gastroenterology, 2012, 143(5): 1266-1276. DOI:10.1053/j.gastro.2012.07.106 |
| [6] |
Cheng H, Leblond CP. Origin, differentiation and renewal of the four main epithelial cell types in the mouse small intestine. V. Unitarian theory of the origin of the four epithelial cell types[J]. Am J Anat, 1974, 141(4): 537-561. DOI:10.1002/aja.1001410407 |
| [7] |
Barker N, van Es JH, Kuipers J, et al. Identification of stem cells in small intestine and colon by marker gene Lgr5[J]. Nature, 2007, 449(7165): 1003-1007. DOI:10.1038/nature06196 |
| [8] |
Metcalfe C, Kljavin NM, Ybarra R, et al. Lgr5+ stem cells are indispensable for radiation-induced intestinal regeneration[J]. Cell Stem Cell, 2014, 14(2): 149-159. DOI:10.1016/j.stem.2013.11.008 |
| [9] |
Yan KS, Chia LA, Li X, et al. The intestinal stem cell markers Bmi1 and Lgr5 identify two functionally distinct populations[J]. Proc Natl Acad Sci USA, 2012, 109(2): 466-471. DOI:10.1073/pnas.1118857109 |
| [10] |
Chaves-Pérez A, Yilmaz M, Perna C, et al. URI is required to maintain intestinal architecture during ionizing radiation[J]. Science, 2019, 364(6443): eaaq1165. DOI:10.1126/science.aaq1165 |
| [11] |
Barriga FM, Montagni E, Mana M, et al. Mex3a marks a slowly dividing subpopulation of Lgr5+ intestinal stem cells[J]. Cell Stem Cell, 2017, 20(6): 801-816.e7. DOI:10.1016/j.stem.2017.02.007 |
| [12] |
Bankaitis ED, Ha A, Kuo CJ, et al. Reserve stem cells in intestinal homeostasis and injury[J]. Gastroenterology, 2018, 155(5): 1348-1361. DOI:10.1053/j.gastro.2018.08.016 |
| [13] |
Muñoz J, Stange DE, Schepers AG, et al. The Lgr5 intestinal stem cell signature: robust expression of proposed quiescent '+4' cell markers[J]. EMBO J, 2012, 31(14): 3079-3091. DOI:10.1038/emboj.2012.166 |
| [14] |
Suh HN, Kim MJ, Jung YS, et al. Quiescence exit of tert(+) stem cells by wnt/β-catenin is indispensable for intestinal regeneration[J]. Cell Rep, 2017, 21(9): 2571-2584. DOI:10.1016/j.celrep.2017.10.118 |
| [15] |
van Es JH, Sato T, van de Wetering M, et al. Dll1+ secretory progenitor cells revert to stem cells upon crypt damage[J]. Nat Cell Biol, 2012, 14(10): 1099-1104. DOI:10.1038/ncb2581 |
| [16] |
Sangiorgi E, Capecchi MR. Bmi1 is expressed in vivo in intestinal stem cells[J]. Nat Genet, 2008, 40(7): 915-920. DOI:10.1038/ng.165 |
| [17] |
Montgomery RK, Carlone DL, Richmond CA, et al. Mouse telomerase reverse transcriptase (mTert) expression marks slowly cycling intestinal stem cells[J]. Proc Natl Acad Sci USA, 2011, 108(1): 179-184. DOI:10.1073/pnas.1013004108 |
| [18] |
Tian H, Biehs B, Warming S, et al. A reserve stem cell population in small intestine renders Lgr5-positive cells dispensable[J]. Nature, 2011, 478(7368): 255-259. DOI:10.1038/nature10408 |
| [19] |
Takeda N, Jain R, LeBoeuf MR, et al. Interconversion between intestinal stem cell populations in distinct niches[J]. Science, 2011, 334(6061): 1420-1424. DOI:10.1126/science.1213214 |
| [20] |
Buczacki SJ, Zecchini HI, Nicholson AM, et al. Intestinal label-retaining cells are secretory precursors expressing Lgr5[J]. Nature, 2013, 495(7439): 65-69. DOI:10.1038/nature11965 |
| [21] |
Van Landeghem L, Santoro MA, Krebs AE, et al. Activation of two distinct Sox9-EGFP-expressing intestinal stem cell populations during crypt regeneration after irradiation[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 302(10): G1111-1132. DOI:10.1152/ajpgi.00519.2011 |
| [22] |
Yan KS, Gevaert O, GXY Z, et al. Intestinal enteroendocrine lineage cells possess homeostatic and injury-inducible stem cell activity[J]. Cell Stem Cell, 2017, 21(1): 78-90.e6. DOI:10.1016/j.stem.2017.06.014 |
| [23] |
Tetteh PW, Basak O, Farin HF, et al. Replacement of lost Lgr5-positive stem cells through plasticity of their enterocyte-lineage daughters[J]. Cell Stem Cell, 2016, 18(2): 203-213. DOI:10.1016/j.stem.2016.01.001 |
| [24] |
Ayyaz A, Kumar S, Sangiorgi B, et al. Single-cell transcriptomes of the regenerating intestine reveal a revival stem cell[J]. Nature, 2019, 569(7754): 121-125. DOI:10.1038/s41586-019-1154-y |
| [25] |
AJM S, Lo YH, Mah AT, et al. The intestinal stem cell niche: homeostasis and adaptations[J]. Trends Cell Biol, 2018, 28(12): 1062-1078. DOI:10.1016/j.tcb.2018.08.001 |
| [26] |
Vanuytsel T, Senger S, Fasano A, et al. Major signaling pathways in intestinal stem cells[J]. Biochim Biophys Acta, 2013, 1830(2): 2410-2426. DOI:10.1016/j.bbagen.2012.08.006 |
| [27] |
Mah AT, Yan KS, Kuo CJ. Wnt pathway regulation of intestinal stem cells[J]. J Physiol, 2016, 594(17): 4837-4847. DOI:10.1113/JP271754 |
| [28] |
Clevers H, Loh KM, Nusse R. Stem cell signaling. An integral program for tissue renewal and regeneration: Wnt signaling and stem cell control[J]. Science, 2014, 346(6205): 1248012. DOI:10.1126/science.1248012 |
| [29] |
van Es JH, Haegebarth A, Kujala P, et al. A critical role for the Wnt effector Tcf4 in adult intestinal homeostatic self-renewal[J]. Mol Cell Biol, 2012, 32(10): 1918-1927. DOI:10.1128/MCB.06288-11 |
| [30] |
Yan KS, Janda CY, Chang J, et al. Non-equivalence of Wnt and R-spondin ligands during Lgr5+ intestinal stem-cell self-renewal[J]. Nature, 2017, 545(7653): 238-242. DOI:10.1038/nature22313 |
| [31] |
Hong AW, Meng Z, Guan KL. The Hippo pathway in intestinal regeneration and disease[J]. Nat Rev Gastroenterol Hepatol, 2016, 13(6): 324-337. DOI:10.1038/nrgastro.2016.59 |
| [32] |
Gregorieff A, Liu Y, Inanlou MR, et al. Yap-dependent reprogramming of Lgr5(+) stem cells drives intestinal regeneration and cancer[J]. Nature, 2015, 526(7575): 715-718. DOI:10.1038/nature15382 |
| [33] |
Carulli AJ, Keeley TM, Demitrack ES, et al. Notch receptor regulation of intestinal stem cell homeostasis and crypt regeneration[J]. Dev Biol, 2015, 402(1): 98-108. DOI:10.1016/j.ydbio.2015.03.012 |
| [34] |
Liang SJ, Li XG, Wang XQ. Notch signaling in mammalian intestinal stem cells: Determining cell fate and maintaining homeostasis[J]. Curr Stem Cell Res Ther, 2019, 14(7): 583-590. DOI:10.2174/1574888x14666190429143734 |
| [35] |
Sato T, van Es JH, Snippert HJ, et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts[J]. Nature, 2011, 469(7330): 415-418. DOI:10.1038/nature09637 |
| [36] |
Zhou D, Zhang Y, Wu H, et al. Mst1 and Mst2 protein kinases restrain intestinal stem cell proliferation and colonic tumorigenesis by inhibition of yes-associated protein (Yap) overabundance[J]. Proc Natl Acad Sci USA, 2011, 108(49): E1312-1320. DOI:10.1073/pnas.1110428108 |
| [37] |
Gassler N. Paneth cells in intestinal physiology and pathophysiology[J]. World J Gastrointest Pathophysiol, 2017, 8(4): 150-160. DOI:10.4291/wjgp.v8.i4.150 |
| [38] |
Rodríguez-Colman MJ, Schewe M, Meerlo M, et al. Interplay between metabolic identities in the intestinal crypt supports stem cell function[J]. Nature, 2017, 543(7645): 424-427. DOI:10.1038/nature21673 |
| [39] |
Yu S, Tong K, Zhao Y, et al. Paneth cell multipotency induced by notch activation following injury[J]. Cell Stem Cell, 2018, 23(1): 46-59.e5. DOI:10.1016/j.stem.2018.05.002 |
| [40] |
Bhanja P, Norris A, Gupta-Saraf P, et al. BCN057 induces intestinal stem cell repair and mitigates radiation-induced intestinal injury[J]. Stem Cell Res Ther, 2018, 9(1): 26. DOI:10.1186/s13287-017-0763-3 |
| [41] |
Wang S, Han Y, Zhang J, et al. Me6TREN targets β-catenin signaling to stimulate intestinal stem cell regeneration after radiation[J]. Theranostics, 2020, 10(22): 10171-10185. DOI:10.7150/thno.46415 |
| [42] |
Wang H, Wang J, Zhao Y, et al. LIF is essential for ISC function and protects against radiation-induced gastrointestinal syndrome[J]. Cell Death Dis, 2020, 11(7): 588. DOI:10.1038/s41419-020-02790-6 |
| [43] |
Wang X, Wei L, Cramer JM, et al. Pharmacologically blocking p53-dependent apoptosis protects intestinal stem cells and mice from radiation[J]. Sci Rep, 2015, 5: 8566. DOI:10.1038/srep08566 |
| [44] |
Leibowitz BJ, Qiu W, Liu H, et al. Uncoupling p53 functions in radiation-induced intestinal damage via PUMA and p21[J]. Mol Cancer Res, 2011, 9(5): 616-625. DOI:10.1158/1541-7786.MCR-11-0052 |
| [45] |
Pant V, Xiong S, Wasylishen AR, et al. Transient enhancement of p53 activity protects from radiation-induced gastrointestinal toxicity[J]. Proc Natl Acad Sci USA, 2019, 116(35): 17429-17437. DOI:10.1073/pnas.1909550116 |
| [46] |
Dong Y, Cheng Y, Hou Q, et al. The protective effect of new compound XH-103 on radiation-induced GI syndrome[J]. Oxid Med Cell Longev, 2018, 2018: 3920147. DOI:10.1155/2018/3920147 |
| [47] |
Cheng Y, Dong Y, Hou Q, et al. The protective effects of XH-105 against radiation-induced intestinal injury[J]. J Cell Mol Med, 2019, 23(3): 2238-2247. DOI:10.1111/jcmm.14159 |
| [48] |
Wei L, Leibowitz BJ, Wang X, et al. Inhibition of CDK4/6 protects against radiation-induced intestinal injury in mice[J]. J Clin Invest, 2016, 126(11): 4076-4087. DOI:10.1172/JCI88410 |
| [49] |
Li Y, Ma S, Zhang Y, et al. (-)-Epicatechin mitigates radiation-induced intestinal injury and promotes intestinal regeneration via suppressing oxidative stress[J]. Free Radic Res, 2019, 53(8): 851-864. DOI:10.1080/10715762.2019.1635692 |
| [50] |
Kwak SY, Shim S, Park S, et al. Ghrelin reverts intestinal stem cell loss associated with radiation-induced enteropathy by activating Notch signaling[J]. Phytomedicine, 2021, 81: 153424. DOI:10.1016/j.phymed.2020.153424 |
| [51] |
Kantara C, Moya SM, Houchen CW, et al. Novel regenerative peptide TP508 mitigates radiation-induced gastrointestinal damage by activating stem cells and preserving crypt integrity[J]. Lab Invest, 2015, 95(11): 1222-1233. DOI:10.1038/labinvest.2015.103 |
| [52] |
Taniguchi CM, Miao YR, Diep AN, et al. PHD inhibition mitigates and protects against radiation-induced gastrointestinal toxicity via HIF2[J]. Sci Transl Med, 2014, 6(236): 236ra64. DOI:10.1126/scitranslmed.3008523 |
| [53] |
Meng Y, Yang F, Long W, et al. Radioprotective activity and preliminary mechanisms of n-oxalyl-d-phenylalanine (NOFD) in vitro[J]. Int J Mol Sci, 2018, 20(1): 37. DOI:10.3390/ijms20010037 |
 2021, Vol. 41
2021, Vol. 41


