恶性肿瘤是目前人类主要死亡原因之一,严重危害人类生命健康[1]。放射治疗是恶性肿瘤治疗的重要手段之一。然而,在采用放疗治疗恶性肿瘤的同时,高能量电离辐射也导致了肿瘤周边正常组织和器官的急性辐射损伤,严重地影响了治疗效果及患者的生活质量。此外,核泄漏及核恐怖偶有发生,也会对健康人群造成一定的辐射损伤。因此,找到有效地缓解辐射暴露引起的辐射损伤的方法具有重要的临床应用价值和现实意义。
肠道辐射损伤研究中,腹部局部照射后受损肠道的形态学变化已有研究报道[2],尽管受照后引起肠道菌群的变化已成为共识[2-3],但对肠道菌群代谢产物的变化还尚未深入研究。
本研究为了探究禁食对受照小鼠肠道菌群代谢产物的变化,采用小鼠肠型放射损伤模型,收集禁食处理的受辐照后3.5d小鼠结肠中的粪便,通过非靶向代谢组学测定,分析不同处理组小鼠肠道菌群表达差异的代谢物,进而揭示代谢产物与放射性肠损伤之间的调节关系,为急性肠型放射损伤的预防及治疗提供新的思路。
材料与方法 1、照射条件137Cs γ射线照射源(Autocell 40,加拿大原子能有限公司),由中国医学科学院放射医学研究所提供照射条件[4],腹部照射使用铅板覆盖耻骨联合以下、剑突以上,剂量率为0.98 Gy/min。
2、实验动物分组及处理雄性C57BL/6 J小鼠159只,SPF级,8~10周龄,体质量20~22 g,购自北京维通利华实验动物有限公司提供,合格证号:SCXK(京)2019-0008,由中国医学科学院放射医学研究所动物实验中心提供SPF级条件饲养,环境温度(22±2)℃,空气湿度40%~70%,12 h/12 h日夜交替采光。实验动物研究方案经中国医学科学院放射医学研究所伦理委员会审查和批准[4]。在全身照射存活率实验中将小鼠分为5组:健康对照组、全身照射9 Gy组、禁食24 h+全身照射9 Gy组、禁食48 h+全身照射9 Gy组、禁食72 h+全身照射9 Gy组,每组15只。在腹部照射存活率实验中分为5组:健康对照组、腹部局部照射15 Gy组、禁食24 h+腹部局部照射15 Gy组、禁食48 h+腹部局部照射15 Gy组、禁食72 h+腹部局部照射15 Gy组,每组12只。非靶代谢实验测序分为4组,分别为健康对照组、禁食24 h组、腹部局部照射15 Gy组、禁食24 h+腹部局部照射15 Gy组,每组6只。健康对照组小鼠在相同条件下,接受0 Gy假照射。
3、小鼠脏器指数测定于照射后3.5 d称取小鼠体重,脱颈处死小鼠后,电子天平称量小鼠脾脏和胸腺的重量,计算脏器指数。脾脏指数=脾质量(mg)/体质量(g)。胸腺指数=胸腺质量(mg)/体质量(g)[5]。
4、小鼠粪便样本制备于照射后3.5 d获取小鼠新鲜粪便于无菌EP管中,液氮速冻后置超低温冰箱冷冻保存。分析前,将样本于室温下解冻,取50 mg,加入450 μl提取液,再加入10 μl L-2-氯苯丙氨酸,旋涡30 s;加入磁珠,45 Hz研磨仪处理4 min,超声5 min;将样本4℃离心,12 000 r/min离心15 min,离心半径5 cm;小心移取300 μl上清液于1.5 ml EP管中,每个样本各取60 μl混合成QC样本;在真空浓缩器中干燥提取物;向干燥后的代谢物加入60 μl甲氧胺盐试剂,混匀后,放入烘箱中80℃孵育30 min;向每个样品中加入80 μl N, O-双(三甲基硅基)三氟乙酰胺(含有1%三甲基氯硅烷,V/V),将混合物70℃孵育1.5 h;冷却至室温,向混合的样本中加入5 μl脂肪酸甲酯(溶于氯仿);实验样本随机顺序上机检测。
5、上机检测Agilent 7890气相色谱-飞行时间质谱联用仪配有Agilent DB-5MS毛细管(30 m×250 μm×0.25 μm,美国J & W Scientific公司),GC-TOF-MS具体分析条件为:进样量;1 μl;分流模式:Splitless Mode;隔垫吹扫流速:3 ml/min;载气:Helium;色谱柱:DB-5MS (30 m×250 μm×0.25 μm)。
6、数据处理、分析与代谢物的鉴定使用Chroma TOF软件(V4.3×, 美国LECO公司)对质谱数据进行峰提取、基线校正、解卷积、峰积分、峰对齐等分析。使用LECO-Fiehn Rtx5数据库,根据质谱匹配度、保留时间指数匹配等对代谢物进行定性鉴定。采用PLS-DA模型第一主成分的变量投影重要度(variable importance in the projection,VIP)值,差异倍数(fold change,FC),并结合t检验的P值来寻找差异性表达代谢物,设置阈值为VIP > 1.0,差异倍数FC > 2.0或FC < 0.5且P < 0.05,筛选差异代谢物。
7、统计学处理采用GraphPad Prism 8.0统计软件对数据进行分析。数据符合正态分布且方差齐,以
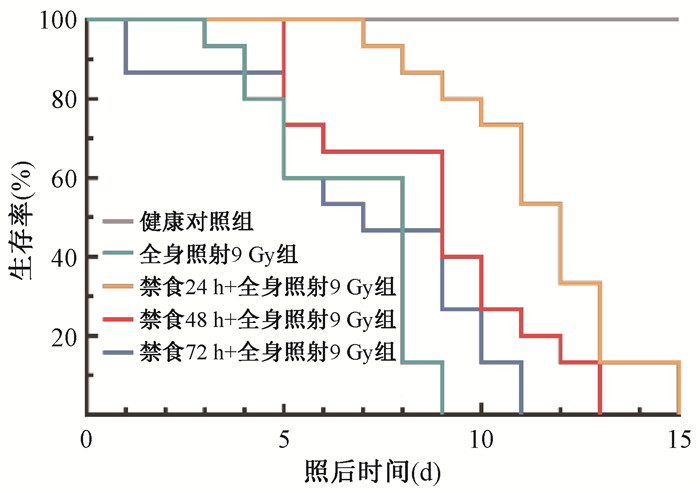
如图 1所示,暴露于9 Gy全身照射,照射组小鼠在9 d内全部死亡,照射前禁食72 h的小鼠在11 d内全部死亡,照射前禁食48和24 h的小鼠分别在13和15 d内全部死亡。
|
图 1 小鼠经9 Gy全身照射后15 d存活曲线 Figure 1 Survival curve of C57BL/6 mice after exposure to 9 Gy TBI |
2、腹部照射后小鼠30 d存活率
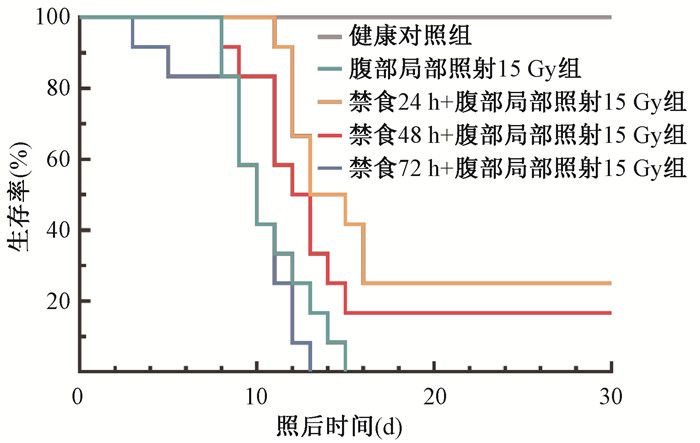
如图 2所示,暴露于15 Gy腹部照射,腹部局部照射15 Gy组小鼠在15 d内全部死亡,照射前禁食72 h的小鼠在13 d内全部死亡,照射前禁食48和24 h小鼠的30 d存活率分别为16.67%和25%。
|
图 2 小鼠经15 Gy腹部照射后15 d存活曲线 Figure 2 Survival curve of C57BL/6 mice after exposure to 15 Gy WAI |
3、腹部照射后3.5 d小鼠体重和脏器指数
15 Gy腹部照射后3.5 d,小鼠体重较健康对照组有不同程度下降,禁食24 h组小鼠较健康对照组体重略有下降,差异无统计学意义(P >0.05),腹部局部照射15 Gy组和禁食24 h+腹部局部照射15 Gy组体重显著低于健康对照组(t=17.02、16.01,P < 0.05),禁食24 h+腹部局部照射15 Gy组体重显著高于腹部局部照射15 Gy组(t= 2.338,P=0.042)。与健康对照组比较,禁食24 h组小鼠的胸腺指数和脾脏指数降低,但差异无统计学意义(P >0.05),腹部局部照射15 Gy后,两指数均低于健康对照组(t=6.459、8.056,P < 0.05),而禁食24 h+腹部局部照射15 Gy组与腹部局部照射15 Gy组相比,其胸腺指数(P >0.05)和脾脏指数(t=2.289, P=0.045)呈现回调趋势,见表 1。
|
|
表 1 15 Gy γ射线腹部照射后3.5 d小鼠的体重和脏器指数 ( |
4、多变量分析
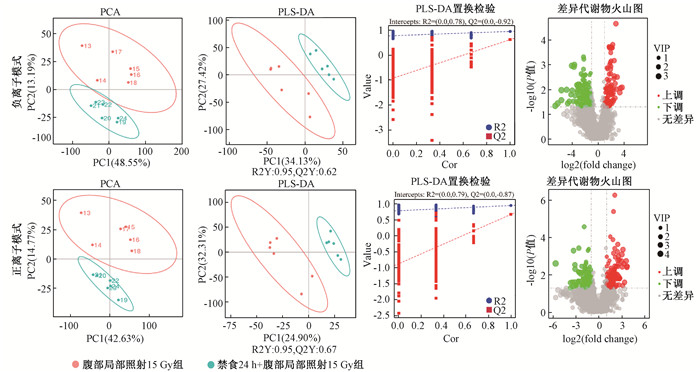
在正离子模式和负离子模式的PCA分析(图 3)中,可以观察到禁食和未禁食的受辐照小鼠粪便样本之间有明显的分离,表明两个实验组样本之间的代谢差异显著。为了进一步确定禁食和未禁食的受照小鼠的代谢谱的差异变化,对正离子和负离子模式都采用偏最小二乘法-判别分析(partial least squares discrimination analysis, PLS-DA) 模型进行有监督的数据分析(图 3),并进行了7次循环交互验证,以防止PLS-DA模型的过度拟合(图 5E和5F)。对于负离子代谢物模型,反映模型拟合准确性的模型参数R2=0.95,反映模型预测准确性的Q2=0.62,R2和Q2与Y轴的截距值分别为0.78和-0.92;而正离子代谢物模型R2=0.95,Q2=0.67,R2和Q2与Y轴的截距值分别为0.79和-0.87。说明模型的稳定性和预测率都比较高,而且模型未过度拟合,适用于解释禁食对受辐照小鼠之间的代谢差异和发现两组之间的差异性表达代谢物。结果表明,禁食对受辐照小鼠的代谢有明显的干扰作用。
|
注:PCA.主成分分析; PLS-DA. 偏最小二乘法判别分析;R2.反映模型拟合准确性的模型参数;Q2.反映模型预测准确性的模型参数 图 3 两组小鼠粪便非靶向代谢组学分析 Figure 3 Non-targeted metabonomics analysis of two groups of mice feces |
5、差异代谢物的鉴定
筛选出的差异代谢物如图 3所示。通过ChemSpider和mzCloud数据库进行检索比对,15种代谢物在禁食和未禁食的受辐照小鼠粪便中以负离子模式差异表达,18种代谢物在正离子模式下差异表达(表 2)。
|
|
表 2 15 Gy γ射线腹部照射后3.5 d小鼠粪便差异代谢物 Table 2 Differential metabolites of C57BL/6 mice 3.5 d after 15 Gy WAI |
6、禁食对受辐照小鼠粪便代谢途径的改变
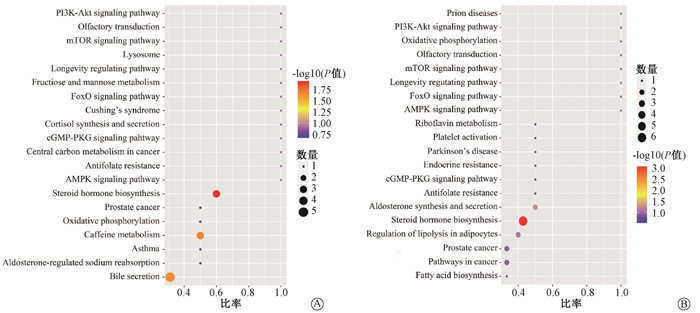
利用京都基因和基因组百科全书(KEGG)数据库对禁食和未禁食的受辐照小鼠的差异代谢产物进行代谢通路的富集分析。涉及到的信号通路包括类固醇激素生物合成、醛固酮的合成和分泌、胆汁分泌和咖啡因代谢,其中正负离子模式下都受到扰动且发生最显著变化的代谢通路为类固醇激素生物合成(图 4)。
|
图 4 KEGG富集代谢途径分析A. 负离子模式;B. 正离子模式 Figure 4 KEGG enrichment analysis A. negative ion; B. positive ion |
讨论
肠道是机体重要的消化器官,在物质代谢过程中发挥重要的作用。肠道微生态系统是哺乳动物体内最庞杂的微生态系统,肠道菌群是肠道微生物的重要组成部分[6]。正常生理状态下,肠道菌群从饮食中摄取营养物质和能量[7],进而促进生长发育和物质代谢以及调节平衡代谢免疫等过程[8-9]。
粪便代谢物是宿主和肠道菌群共代谢的产物,反映肠道菌群状态的同时,也在共栖菌与宿主之间起着桥梁作用[10]。新近的研究报道显示,肠道微生物组,尤其是肠道微生物代谢产物通过调节宿主特殊的信号通路,直接调节宿主的生理进程[11]。饮食可以改变肠道菌群的结构及代谢产物种类数量[9]。代谢组学是一种研究生物标本中的小分子代谢物的系统组学方法,它通过考察生物体受刺激后,其代谢产物的变化以研究生物体系代谢途径。近年来,其在放射损伤的诊断[12-15]和辐射损伤机制的阐明[16],以及辐射损伤防护代谢物的发现[17]等方面的研究中起着不可忽视的作用[18]。急性放射性肠损伤发生后,会导致与之相关的代谢网络发生变化[17]。
本研究通过非靶向代谢组学评价了禁食对肠型急性辐射损伤小鼠的干预作用,结果表明,禁食具有显著干预小鼠肠型急性辐射损伤程度的作用。研究中以C57BL6/J小鼠的单次腹部照射作为肠型急性辐射损伤模型,前期工作已经研究了肠型急性辐射损伤小鼠的肠道损伤的形态学及肠道菌群结构的变化[2],本研究重点对该模型进行非靶向代谢组学的测定。
禁食可以促进组织再生[19],提高肠道干细胞功能[19]。过往文献报道,哺乳动物在禁食72 h内不会引起胃排空和死亡[20-21]。本研究结果显示,与全身照射9 Gy组比较,照射前禁食48和24 h的小鼠受照后的中位生存期提高了1和4 d,提示照射前禁食48和24 h对急性电离辐射损伤有一定的调节作用。通过局部腹部照射模型评价禁食对急性肠型辐射损伤的干预作用,本研究结果表明,照射前禁食显著提高了γ射线照射小鼠的生存时间,表明禁食可以影响肠型急性辐射损伤。为了进一步确定禁食对小鼠粪便代谢物的影响,采用15 Gy γ射线腹部局部照射禁食24 h的小鼠,并在辐照后3.5 d取材进行相关检测,照射前禁食24 h能够提高受照小鼠的体重和脾脏指数,提示照射前禁食24 h对电离辐射引起的免疫器官损伤有一定的调节作用。
肠道代谢物由饮食、机体代谢物以及微生物代谢物组成,这些物质可以塑造微生物群与宿主之间的相互作用关系[22]。代谢组学实验结果分析显示,类固醇激素生物合成途径存在着显著的不平衡状态。类固醇激素对机体发展、应激反应、抗炎、免疫调节和改善新陈代谢等方面有明确的作用。该结果可能与应激反应调节、抗炎相关,具体的分子机制还需要更深一步的研究。
本研究通过非靶向代谢组学测定研究了禁食对小鼠急性放射性肠损伤的影响,解析了其粪便代谢物,发现类固醇激素生物合成代谢通路发生了显著变化,提示照射前禁食或营养调节可缓解辐射引起的肠道损伤,为肿瘤放疗患者和职业接触辐射人员的辐射防护提供新的研究思路。
利益冲突 由署名作者按以下贡献声明独立开展,未接受有关公司的任何资助,不涉及各相关方的利益冲突
志谢 感谢中国医学科学院医学与健康科技创新工程、服务“一带一路”战略先导科研专项(2017-I2M-3-019, 2017-I2M-B & R-13)、中国医学科学院放射医学研究所青年科研骨干项目(2019033)对本研究的资助
作者贡献声明 路璐负责实验设计、数据分析和论文撰写;张俊伶、李德冠协助实验;樊赛军指导实验设计和论文的修改
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [2] |
Lu L, Jiang M, Zhu C, et al. Amelioration of whole abdominal irradiation-induced intestinal injury in mice with 3, 3'-Diindolylmethane (DIM)[J]. Free Radic Biol Med, 2019, 130: 244-255. DOI:10.1016/j.freeradbiomed.2018.10.410 |
| [3] |
Cui M, Xiao H, Li Y, et al. Faecal microbiota transplantation protects against radiation-induced toxicity[J]. EMBO Mol Med, 2017, 9(4): 448-461. DOI:10.15252/emmm.201606932 |
| [4] |
王津晗, 路倩颖, 纪凯华, 等. 基于转录组测序的放射性肠损伤基因动态变化望[J]. 中华放射医学与防护杂志, 2018, 38(2): 81-86. Wang JH, Lu QY, Ji KH, et al. The dynamic changes of gene expressions in radiation-injured intestine based on RNA-sequence analysis[J]. Chin J Radiol Med Prot, 2018, 38(2): 81-86. DOI:10.3760/cma.j.issn.0254-5098.2018.02.001 |
| [5] |
路璐, 李德冠, 张俊伶, 等. 不同剂量137Cs γ-射线辐射后造血干/祖细胞辐射敏感性差异研究[J]. 天津医药, 2016, 44(3): 314-317. Lu L, Li DG, Zhang JL, et al. The difference in the radiosensitivity between hematopoietic stem and progenitor cells after different doses of137Cs γ-radiation[J]. Tianjin Med J, 2016, 44(3): 314-317. DOI:10.11958/20150115 |
| [6] |
Park W. Gut microbiomes and their metabolites shape human and animal health[J]. J Microbiol, 2018, 56(3): 151-153. DOI:10.1007/s12275-018-0577-8 |
| [7] |
Rey FE, Gonzalez MD, Cheng J, et al. Metabolic niche of a prominent sulfate-reducing human gut bacterium[J]. Proc Natl Acad Sci USA, 2013, 110(33): 13582-13587. DOI:10.1073/pnas.1312524110 |
| [8] |
Fung TC, Olson CA, Hsiao EY. Interactions between the microbiota, immune and nervous systems in health and disease[J]. Nat Neurosci, 2017, 20(2): 145-155. DOI:10.1038/nn.4476 |
| [9] |
Honda K, Littman DR. The microbiota in adaptive immune homeostasis and disease[J]. Nature, 2016, 535(7610): 75-84. DOI:10.1038/nature18848 |
| [10] |
付业佩, 孙启慧, 李灿, 等. 基于粪样代谢组学研究麻黄细辛附子汤对肾阳虚外感小鼠的干预作用[J]. 中药材, 2017, 40(8): 1926-1930. Fu YP, Sun QH, Li C, et al. Study on the intervention effect of Mahuang Xixin Fuzi decoction on Kidney-Yang dificiency syndrome mice model infected with influenza virus a based on fecal metabolomics[J]. J Chin Med Mater, 2017, 40(8): 1926-1930. DOI:10.13863/j.issn1001-4454.2017.08.040 |
| [11] |
Descamps HC, Herrmann B, Wiredu D, et al. The path toward using microbial metabolites as therapies[J]. EBioMedicine, 2019, 44: 747-754. DOI:10.1016/j.ebiom.2019.05.063 |
| [12] |
Lanz C, Patterson AD, Slavik J, et al. Radiation metabolomics. 3. Biomarker discovery in the urine of gamma-irradiated rats using a simplified metabolomics protocol of gas chromatography-mass spectrometry combined with random forests machine learning algorithm[J]. Radiat Res, 2009, 172(2): 198-212. DOI:10.1667/RR1796.1 |
| [13] |
Johnson CH, Patterson AD, Krausz KW, et al. Radiation metabolomics. 4. UPLC-ESI-QTOFMS-Based metabolomics for urinary biomarker discovery in gamma-irradiated rats[J]. Radiat Res, 2011, 175(4): 473-484. DOI:10.1667/RR2437.1 |
| [14] |
Li HH, Lin YT, Laiakis EC, et al. Serum metabolomic alterations associated with Cesium-137 internal emitter delivered in various dose rates[J]. Metabolites, 2020, 10(7): 270. DOI:10.3390/metabo10070270 |
| [15] |
Satyamitra MM, Cassatt DR, Hollingsworth BA, et al. Metabolomics in radiation biodosimetry: current approaches and advances[J]. Metabolites, 2020, 10(8): 328. DOI:10.3390/metabo10080328 |
| [16] |
Wu H, Xu C, Gu Y, et al. An improved pseudotargeted GC-MS/MS-based metabolomics method and its application in radiation-induced hepatic injury in a rat model[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2020, 1152: 122250. DOI:10.1016/j.jchromb.2020.122250 |
| [17] |
Guo H, Chou WC, Lai Y, et al. Multi-omics analyses of radiation survivors identify radioprotective microbes and metabolites[J]. Science, 2020, 370(6516): eaay9097. DOI:10.1126/science.aay9097 |
| [18] |
刘海翔, 王治东, 陈英. 代谢组学研究方法及其在放射医学领域的应用展望[J]. 中华放射医学与防护杂志, 2012, 32(2): 221-224. Liu HX, Wang ZD, Chen Y. Metabonomics research methods and their application prospects in the field of radiation medicine[J]. Chin J Radiol Med Prot, 2012, 32(2): 221-224. DOI:10.3760/cma.j.issn.0254-5098.2012.02.031 |
| [19] |
Mihaylova MM, Cheng CW, Cao AQ, et al. Fasting activates fatty acid oxidation to enhance intestinal stem cell function during homeostasis and aging[J]. Cell Stem Cell, 2018, 22(5): 769-778.e4. DOI:10.1016/j.stem.2018.04.001 |
| [20] |
Sokolović M, Wehkamp D, Sokolović A, et al. Fasting induces a biphasic adaptive metabolic response in murine small intestine[J]. BMC Genomics, 2007, 8: 361. DOI:10.1186/1471-2164-8-361 |
| [21] |
Brito MV, Yasojima EY, Teixeira RK, et al. Fasting does not induce gastric emptying in rats[J]. Acta Cir Bras, 2015, 30(3): 165-169. DOI:10.1590/S0102-865020150030000001 |
| [22] |
Franzosa EA, Sirota-Madi A, Avila-Pacheco J, et al. Gut microbiome structure and metabolic activity in inflammatory bowel disease[J]. Nat Microbiol, 2019, 4(2): 293-305. DOI:10.1038/s41564-018-0306-4 |
 2021, Vol. 41
2021, Vol. 41


