2. 中山大学肿瘤防治中心放疗科, 华南肿瘤学国家重点实验室肿瘤医学协同创新中心, 广州 510060
2. Department of Radiation Oncology, Sun Yat-sen University Cancer Center, State Key Laboratory of Oncology in South China, Collaborative Innovation Center for Cancer Medicine, Guangzhou 510060, China
图像引导放射治疗(image-guided radiotherapy, IGRT)在精准放疗实施中是非常重要的[1],目前在临床中多数采用锥形束CT(cone-beam computed tomography, CBCT)影像引导技术,监测肿瘤位置和修正摆位误差[2]。但是,相比磁共振成像(magnetic resonance imaging, MRI),CBCT图像软组织分辨率不高,而且增加了额外辐射剂量[3]。磁共振加速器系统(MR-Linac,Unity)由1.5T磁共振扫描系统(荷兰,Philips公司)和7 MV直线加速器(瑞典,Elekta公司)组成[4]。通过每次治疗前的磁共振影像生成在线自适应治疗计划,修正由于摆位和器官形变造成的误差。并且可在照射中和照射后采集磁共振影像评估治疗效果。此外,还可以在照射中实时扫描动态磁共振影像,监控肿瘤靶区或危及器官的运动情况。近年来,已有磁共振加速器临床应用经验的报道[5-8]。Intven等[9]通过评估直肠癌自适应放射治疗靶区受照剂量分析,得出基于1.5T磁共振加速器上开展直肠癌在线自适应放射治疗是可行的。但头颈部肿瘤自适应放疗后靶区和危及器官实际受照剂量的文献报道尚少。本研究通过回顾性分析头颈部肿瘤患者在磁共振加速器上开展自适应放射治疗后靶区和危及器官实际受照剂量和分次间的照射剂量,并与常规放射治疗进行比较,探讨头颈部肿瘤患者基于磁共振加速器系统自适应放射治疗的可行性。
资料与方法 1、临床资料及治疗系统回顾性选取2019年在中山大学肿瘤防治中心采用磁共振加速器系统治疗的6例头颈部肿瘤患者资料,其中1例鼻腔黑色素瘤、1例脑胶质瘤、1例鼻咽癌脑转移瘤和3例鼻咽癌。患者均取仰卧位,发泡胶+热塑膜固定头颈部,采用荷兰Philips大孔径CT获得定位CT影像,扫描层厚为0.3 cm,CT扫描床板替换为磁共振加速器专用治疗床,记录定位床值(couch index)。同时,患者按相同体位固定方式运用磁共振模拟定位机(Ingenia 3.0T, Philips)进行磁共振定位扫描,获取T1加权(TR=4.98 ms, TE=2.39 ms, 翻转角=12°)、T2加权(TR=5 712 ms, TE=110 ms, 翻转角=90°)和T1加权增强图像。上述定位影像传输至Monaco计划系统,由一位放疗科主任医师勾画靶区和危及器官,在肿瘤体积(gross tumor volume,GTV)或临床肿瘤区(clinical tumor volume,CTV),外扩边界3 mm生成计划靶区(planning tumor volume,PTV)。
2、参考计划设计运用ElektaUnity磁共振加速器(瑞典,Elekta公司)专用的计划系统Monaco(v5.40.01)进行计划设计。该计划系统采用GPUMCD(graphic processing unit (GPU)-based Monte Carlo dose calculation platform)剂量计算算法,且考虑了1.5T磁场对剂量的影响[10]。6例患者计划均采用9个射野(160°、120°、80°、40°、0°、320°、280°、240°、200°),根据处方剂量要求生成调强放射治疗(intensity modulated radiotherapy, IMRT)计划。所有计划均同时满足处方剂量覆盖靶区体积95%以上,最大剂量 < 110%处方剂量。危及器官限制剂量基于国际辐射单位与测量委员会(ICRU)83号报告,其中,脑干最大剂量<54 Gy,视交叉和视神经最大剂量均<50 Gy,眼晶状体最大剂量<10 Gy,眼球最大剂量<20 Gy。目前该磁共振加速器系统仅支持静态(step-and-shoot)调强照射技术。因磁共振加速器13°方向设置有低温恒温管,所以在10°~20°方向尽量避免布置射野。计划中心点固定在机架等中心位置,在治疗床上方13 cm。治疗计划参数设置中计算网格为0.3 cm,每控制点统计不确定度为3%,最小子野面积为4 cm2,最小子野宽度为0.6 cm,每个子野最小5 MU,每个计划最多设置100个子野。
3、在线计划设计取患者在治疗前的在线磁共振影像,其扫描序列选用3D T2序列,层厚为1 mm。扫描参数为:TR 2 100 ms、TE 295 ms、翻转角90°、平均扫描时间为6 min。采用基于位置修正的自适应(adapt to position, ATP)放射治疗模式,修正摆位误差。可通过在线MRI影像与计划CT进行配准,获得移动参数,调整计划中心点,重新优化计算得到在线计划进行治疗。本研究使用在线计划系统(on-line Monaco)采用Optimize Shapes优化方式重新优化计划,并由临床医生判断计划是否满足要求。
4、分次间剂量评估将每次治疗时在磁共振加速器上获得的MRI影像与计划CT配准后,基于MRI影像勾画靶区和危及器官,将勾画的结构复制到CT上,再根据在线计划的剂量分布,评估每个治疗分次中PTV处方剂量覆盖百分体积(V100%)和眼球、眼晶状体、视神经、视交叉和脑干的最大剂量和平均剂量。
5、累积剂量评估将每次治疗时的照射剂量叠加后得到整个疗程内靶区和危及器官的实际受照剂量,并与参考计划进行比较分析。
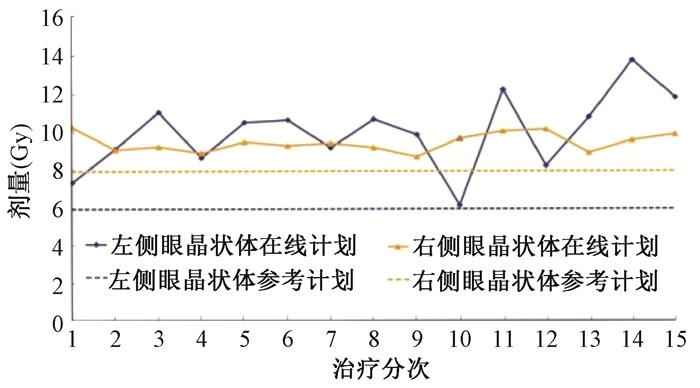
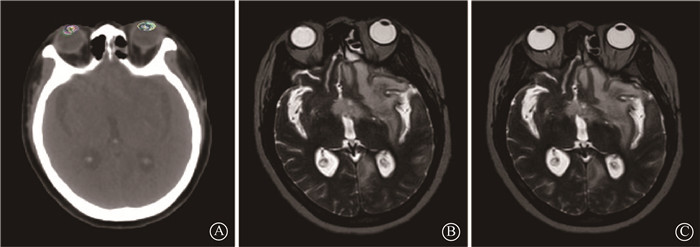
结果 1、分次间剂量评估6例患者的PTV处方剂量覆盖分次间变化<1%。脑干的平均剂量变化为-11.6%~-0.5%,最大剂量变化为-4.03%~10.65%;视神经平均剂量变化为-10.72%~7.15%,最大剂量变化为-1.98%~7.75%;视交叉平均剂量变化为-7.26%~0.47%,最大剂量变化为-3.16%~3.78%。眼球和眼晶状体剂量分次间变化幅度较为明显,眼球平均剂量变化为-23.08%~19.08%,最大剂量变化为-30.45%~10.94%;眼晶状体平均剂量变化为-15.93%~88.98%,最大剂量变化为-28.03%~98.25%。其中1例头颈部肿瘤患者15个治疗分次中的眼晶状体剂量的变化情况及运动范围见图 1,2。
|
图 1 头颈部肿瘤患者眼晶状体最大剂量不同治疗分次间剂量变化 Figure 1 The inter-fraction maximum dose variation of lens for apatient with head and neck cancer |
|
图 2 患者眼晶状体的运动范围和不同治疗分次MRI影像中眼晶状体的位置 A.在CT上显示眼晶状体位置的运动范围;B.第7治疗分次;C.第14治疗分次 Figure 2 Range of motion of lens and lens locations in MRI images during each treatment fraction A. Range of motion of lens shown on a CT image during each treatment fraction; B.The seventh treatment fraction; C. the fourteenth treatment fraction |
2、累积剂量评估
结果显示,6例患者PTV处方剂量覆盖百分体积与参考计划差异<1%。脑干的平均剂量变化为-9.08%~1.9%,最大剂量变化为-14.18%~ 2.62%;眼球平均剂量变化为-15.39%~2.33%;视神经平均剂量变化为-7.11%~ 3.09%,最大剂量变化为-5.16%~5.19%;视交叉平均剂量变化为-4.90%~-0.44%,最大剂量变化为-6.64%~0.38%。对于眼晶状体剂量叠加,由于形变较大,剂量叠加后无法准确得出其最大剂量,所以只能评估平均剂量的变化。除1位患者眼晶状体剂量与参考计划相比,均减少2.03%~7.22%,但是其他5位患者眼晶状体照射剂量都有所增加,最多增加了31.74%。
讨论磁共振加速器治疗流程和传统加速器治疗流程差异较大,在治疗前按照定位CT所设计的IMRT计划不用于实际照射,只作为参考计划用于生成在线计划。在每次治疗前,须扫描得到当前分次的MRI影像,与定位CT影像进行配准后,可选择基于位置修正的ATP或基于形变修正的自适应放射治疗(adapt to shape, ATS)。ATP治疗模式主要目的是修正摆位误差,根据配准结果,调整计划中心点,按照CT现有的勾画结构,重新优化计算生成在线计划进行治疗。该模式和目前临床应用中的基于CBCT引导的治疗模式相似,但是磁共振加速器治疗床不能移动,需要根据配准结果调整计划中心点,重新优化计算生成新的在线计划用于治疗。ATS治疗模式主要目的是修正器官或靶区形变误差,将CT影像上的勾画结构形变到MRI影像上,在MRI上重新勾画或修改结构,同时将CT上不同结构的平均相对电子密度值填充至MRI相对应的结构上,生成合成CT(synthetic CT),并在MRI上重新优化计算生成在线自适应治疗计划。在本研究中,头颈部肿瘤患者在治疗过程中误差主要来源是摆位误差,器官发生形变可能性较小,所以在该研究中均选择ATP治疗模式。
对于头颈部肿瘤常规放射治疗,仅在首次治疗时采用电子射野影像装置(EPID)验证摆位,且只根据治疗前设计生成的计划评估靶区和危及器官的照射剂量,所以可将磁共振加速器治疗前根据定位CT设计的参考计划等同于常规传统放射治疗方式的剂量分布。而在ATP治疗流程中,每个治疗分次中都是采用优化过的新计划进行治疗,不能只通过参考计划去评估靶区和危及器官的受照剂量。所以本研究通过回顾性分析头颈部肿瘤患者在磁共振加速器上开展ATP自适应放射治疗后靶区与危及器官累积照射剂量和分次间的剂量变化,探讨头颈部肿瘤患者基于磁共振加速器系统的自适应放射治疗的可行性。
通过分次间剂量评估结果显示,在线计划靶区剂量变化与参考计划相比无明显差异。脑干、视交叉和视神经分次间剂量变化幅度也较小,因为这些器官在治疗过程中未发生形变且不会由于运动导致其位置发生变化,所以剂量未发生明显变化。同时该结果也证明了目前对头颈部肿瘤患者治疗时采用发泡胶+热塑膜的固定方式,其固定效果和摆位重复性均满足临床预期。但是值得注意的是,眼晶状体分次间剂量变化幅度较大,其中有1位患者眼晶状体剂量明显高于参考计划,有两次治疗计划中剂量增加了两倍。累积剂量评估结果显示,参考计划和在线计划靶区剂量无明显差异,本研究中有5例患者的脑干、视交叉、视神经受照剂量却均低于参考计划。该结果说明磁共振加速器ATP治疗流程通过在线MRI影像引导可以有效修正摆位误差,另外由于在线计划采用Optimize Shapes方式,优化过程中是基于参考计划的剂量分布进行优化,所以导致在线计划危及器官剂量低于参考计划。结果中眼晶状体累积剂量相比参考计划增加,主要原因是由于治疗时患者眼晶状体的不自主运动。
眼晶状体是头颈部肿瘤放射治疗中需要重点限值剂量的危及器官,已有多篇研究在讨论眼晶状体受照剂量与白内障等由于放疗造成的眼部疾病之间的关系[11-12],但是这些研究均基于放疗前根据定位CT设计的放疗计划中眼晶状体剂量得出的结论。本研究发现患者在治疗过程中眼晶状体不自主运动,导致实际受照剂量与基于定位CT所生成的计划剂量差别较大,尤其对于眼晶状体在高剂量区附近的患者,虽然基于定位CT设计的放疗计划中剂量满足临床要求,但是治疗过程中如果眼晶状体运动到高剂量区,有可能接受到很高剂量的照射,将会造成严重放疗后遗症。基于本研究结果,单独根据定位CT评估其受照剂量不符合实际结果,建议在治疗时告知患者保持眼晶状体位置不动,或在设计放疗计划时根据其运动范围增加外扩边界后优化,降低治疗过程中由于眼晶状体运动造成的剂量不确定。根据本研究中患者眼晶状体的运动情况,需外扩5~6 mm边界才可覆盖其运动范围,但本研究讨论病例数目较少,之后可进行更大样本研究分析,得到基于人群的眼晶状体运动范围确定其外扩边界,以降低其剂量不确定性。
磁共振加速器系统以其磁共振影像的良好的影像学特性,在肿瘤精确放射治疗和自适应放射治疗中将扮演重要的角色。在本研究中,只讨论了头颈部肿瘤患者在磁共振加速器上开展ATP治疗模式的可行性,该治疗模式可有效修正患者摆位误差,并可通过其在线优化算法可降低危及器官剂量。对于肿瘤消退或器官形变的影响,在磁共振加速器上可采用ATS治疗模式进行修正形变误差,近年来也已有多篇文献报道了基于磁共振加速器开展ATS自适应放射治疗的可行性研究。Werensteijn\|Honingh等[13]和Intven等[9]报道了在磁共振加速器上开展盆腔淋巴结和直肠癌自适应放射治疗的可行性。Paulson等[14]也将4D-MRI应用在磁共振加速器系统中以修正呼吸运动的影响。他们开展ATS治疗时每个分次需要48 min,在临床实践中会造成时间成本的增加,还需要进一步优化和完善治疗流程。在头颈部肿瘤中开展ATS相关的研究尚少。已有研究报道证明头颈部肿瘤在治疗过程中,尤其是鼻咽癌,随着照射剂量增加,肿瘤消退较为明显,鼻咽癌患者可在自适应放射治疗中有很大的临床获益,Chen等[15]报道采用自适应放射治疗后其两年生存率可达88%,相比未采用自适应放疗的79%,结果有统计学差异。磁共振加速器为开展在线自适应放射治疗提供了很大便利,在鼻咽癌自适应放射治疗领域将会有很大的应用前景,同时也需要进一步研究探讨。
本研究结果显示,靶区和危及器官实际照射剂量变化满足临床要求,提示头颈部肿瘤基于磁共振加速器系统的自适应放射治疗方案是可行的。另外,研究发现在治疗过程中由于眼晶状体的不自主运动,导致其实际受照剂量与参考计划差异较大,建议需采取对眼晶状体增加外扩边界后优化放疗计划等方法降低实际治疗过程中剂量的不确定,应在临床实践中予以考虑。
利益冲突 所有作者没有任何利益冲突, 未接受任何不当的职务或财务利益
志谢 本研究接受中华国际医学交流基金会肿瘤精准放疗星火计划临床科研基金项目(HDRS2020030205)支持
作者贡献声明 丁寿亮负责研究设计和撰写论文;刘红冬参与研究设计和论文修改;王彬、李永宝、刘镖水、夏云飞参与患者治疗和数据收集;黄晓延和吴德华负责研究设计
| [1] |
Verellen D, De Ridder M, Linthout N, et al. Innovations in image-guided radiotherapy[J]. Nat Rev Cancer, 2007, 7(12): 949-960. DOI:10.1038/nrc2288 |
| [2] |
Jaffray DA, Siewerdsen JH, Wong JW, et al. Flat-panel cone-beam computed tomography for image-guided radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2002, 53(5): 1337-1349. DOI:10.1016/s0360-3016(02)02884-5 |
| [3] |
Kerkhof EM, van der Put RW, Raaymakers BW, et al. Intrafraction motion in patients with cervical cancer: The benefit of soft tissue registration using MRI[J]. Radiother Oncol, 2009, 93(1): 115-121. DOI:10.1016/j.radonc.2009.07.010 |
| [4] |
Raaymakers BW, Lagendijk JJ, Overweg J, et al. Integrating a 1.5 T MRI scanner with a 6 MV accelerator: proof of concept[J]. Phys Med Biol, 2009, 54(12): N229-237. DOI:10.1088/0031-9155/54/12/N01 |
| [5] |
Winkel D, Bol GH, Kiekebosch IH, et al. Evaluation of online plan adaptation strategies for the 1.5T MR-linac based on "First-In-Man" treatments[J]. Cureus, 2018, 10(4): e2431. DOI:10.7759/cureus.2431 |
| [6] |
Chen X, Prior P, Chen GP, et al. Technical note: dose effects of 1.5 T transverse magnetic field on tissue interfaces in MRI-guided radiotherapy[J]. Med Phys, 2016, 43(8): 4797. DOI:10.1118/1.4959534 |
| [7] |
Nachbar M, M nnich D, Kalwa P, et al. Comparison of treatment plans for a high-field MRI-linac and a conventional linac for esophageal cancer[J]. Strahlenther Onkol, 2019, 195(4): 327-334. DOI:10.1007/s00066-018-1386-z |
| [8] |
Padgett KR, Simpson GN, Llorente R, et al. Feasibility of adaptive MR-guided stereotactic body radiotherapy (SBRT) of lung tumors[J]. Cureus, 2018, 10(4): e2423. DOI:10.7759/cureus.2423 |
| [9] |
Intven M, de Mol van Otterloo SR, Mook S, et al. Online adaptive MR-guided radiotherapy for rectal cancer; feasibility of the workflow on a 1.5T MR-linac: clinical implementation and initial experience[J]. Radiother Oncol, 2021, 154: 172-178. DOI:10.1016/j.radonc.2020.09.024 |
| [10] |
Hissoiny S, Raaijmakers AJ, Ozell B, et al. Fast dose calculation in magnetic fields with GPUMCD[J]. Phys Med Biol, 2011, 56(16): 5119-5129. DOI:10.1088/0031-9155/56/16/003 |
| [11] |
Prior P, Chen X, Botros M, et al. MRI-based IMRT planning for MR-linac: comparison between CT- and MRI-based plans for pancreatic and prostate cancers[J]. Phys Med Biol, 2016, 61(10): 3819-3842. DOI:10.1088/0031-9155/61/10/3819 |
| [12] |
Nguyen SM, Sison J, Jones M, et al. Lens dose-response prediction modeling and cataract incidence in patients with retinoblastoma after lens-sparing or whole-eye radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2019, 103(5): 1143-1150. DOI:10.1016/j.ijrobp.2018.12.004 |
| [13] |
Werensteijn-Honingh AM, Kroon PS, Winkel D, et al. Feasibility of stereotactic radiotherapy using a 1.5 T MR-linac: Multi-fraction treatment of pelvic lymph node oligometastases[J]. Radiother Oncol, 2019, 134: 50-54. DOI:10.1016/j.radonc.2019.01.024 |
| [14] |
Paulson ES, Ahunbay E, Chen X, et al. 4D-MRI driven MR-guided online adaptive radiotherapy for abdominal stereotactic body radiation therapy on a high field MR-Linac: Implementation and initial clinical experience[J]. Clin Transl Radiat Oncol, 2020, 23: 72-79. DOI:10.1016/j.ctro.2020.05.002 |
| [15] |
Chen AM, Daly ME, Cui J, et al. Clinical outcomes among patients with head and neck cancer treated by intensity-modulated radiotherapy with and without adaptive replanning[J]. Head Neck, 2014, 36: 1541-1546. DOI:10.1002/hed.23477 |
 2021, Vol. 41
2021, Vol. 41


