2. 中国科学技术大学物理学院, 合肥 230026
2. School of Physics, University of Science and Technology of China, Hefei 230026, China
近距离治疗被应用于中晚期宫颈癌治疗已在临床得到多年的广泛使用及推广[1-3]。局部失控和复发是造成宫颈癌治疗失败的首要原因,所占比例约为60%~70%[4]。为提高肿瘤局部控制率,需要在控制危及器官(OARs)放疗剂量前提下,保证靶区尽量接受预期足量照射。而近距离治疗剂量的精确评估对实现该目标至关重要,对于宫颈癌治疗成败具有重要意义。
临床上常用近距离治疗剂量计算方法有两种:基于均匀水模型的TG43号报告的[5-6]剂量率计算公式(TG43-BT),以及基于模型的剂量计算算法(BV\|BT)[7]。目前,国内少见这两类算法在实际病例中剂量计算精度分析研究报道,本研究拟采用基于CT影像的EGSnrc蒙特卡罗程序(MC\|BT)对近距离治疗患者剂量分布进行模拟,并将该方法计算结果与上述两种常用方法结果进行对比,以评估组织非均匀对宫颈癌近距离治疗剂量分布的影响,为实际临床剂量评估提供参考。
资料与方法 1、临床资料回顾性选取2018年1月至2020年6月安徽省肿瘤医院放射治疗室收治的局部晚期宫颈鳞癌患者11例。根据宫颈癌国际妇产科协会(FIGO)指定标准,分期为ⅡB ~ⅢB期。所有病例均在完成体外照射40 Gy(总剂量46 Gy/23次)后,开始接受CT引导的三维近距离治疗,1次/周,共5次。
2、计划前准备所有患者治疗前半小时口服500 ml水溶液(含20 ml泛影葡胺造影剂);排空膀胱后取截石位,并用真空垫固定体位;外阴消毒后插入Foley导尿管,并向导尿管球囊中注入7 ml生理盐水,为方便组织勾画,向膀胱注入100 ml盐水稀释的泛影葡胺造影剂,其中泛影葡胺造影剂浓度为5%,并用该浓度液体对直肠进行冲灌;选择合适的宫腔管加阴道穹隆施源器(Fletcher型),阴道填塞纱布以保护直肠膀胱;利用体外固定装置将施源器与后装专用转运床的可移动床板固定。所有患者均采用固定扫描,电流400 mAs,电压120 kV,层厚2.5 mm,通过美国GE公司16排放疗专用大孔径CT模拟定位系统Discovery CT 590进行图像采集,再将CT影像传至后装计划系统(Brachytherapy Planning v15.5)。根据指南要求,由主管医生完成高危靶区(HRCTV)及膀胱、直肠、小肠、乙状结肠等OARs勾画,由高年资物理师在计划系统中勾画并重建三管施源器。
3、剂量计算(1) TG43-BT:在固定体积的均匀水介质计算模型基础上,选择计划系统中基于TG43公式的剂量计算模块进行计划设计,采用逆向优化和图形优化相结合的方式,使得单次物理剂量满足临床靶区体积HRCTV D90 ≥ 6 Gy,膀胱D2 cm3≤ 5 Gy,直肠、小肠和乙状结肠D2 cm3≤ 4.2 Gy。
(2) BV-BT:采用目前临床常用求解基于网格线性玻尔兹曼方程的瓦里安Acuros Brachy Vision计划系统(美国瓦里安公司)完成剂量计算。利用CRIS062型号电子密度模体[8],根据120 kV和400 mAs扫描条件下的CT值-物理密度转换关系表(表 1)在计划系统内创建CT刻度曲线,并在厂家指导下添加非人体组织的钛合金等材料密度值。将所有患者TG43-BT计划的CT影像、组织勾画文件(RS)和治疗计划文件(RP)导入计划系统。最后,使用系统中AcurosTM BV计算模块,重新获取新的剂量分布,1个病例平均计算耗时 < 3 min。
|
|
表 1 不同物质扫描CT值与物理密度转换关系 Table 1 Transformation relationship between CT numbers and physical density of different substances |
(3) MC-BT: 本研究使用最新版EGSnrc版本[9]计算非均匀介质中吸收剂量,并以参考文献[3]为基础,通过剂量率常数的复算及与国外文献数据比较的方法,验证本研究建模的可靠性。首先,结合文献[10]给出的物质成分,参考已有CT值-物质密度转换关系表,建立介质成分表和密度斜坡函数。其次,使用CTC-auto软件将患者CT影像文件(.dcm)转换为EGSnrc可识别的计算模体格式(.egsphant)[11],再根据患者计划文件确定放射源在模体中的空间坐标。最后,利用DOSXYZnrc模块计算不同放射源位置条件下模体中的吸收剂量率,参考放射源在不同位置处的驻留时间,将组织中吸收剂量进行累加。
模拟时选用软件系统库里的6号源,使用XCOM光子截面库和192Ir源能谱。每次模拟统计的粒子数为109,计算体元为2.5 mm3,并利用DOSXYZnrc模块复算相关文献结果[12],以确保本研究模拟计算准确性。本研究的模拟对象为11例三通道近距离治疗局部晚期宫颈癌患者,共有驻留位置186个。计算所用设备CPU型号为Intel(R) Core(TM) i9-9820X,内存16 G,采用18线程并行计算,每个驻留位置平均计算时长约1.2 h,计算总时长近230 h。
4、数据采集针对3种方法生成的剂量分布文件,分别提取记录HRCTV的D98、D90和D50;3、6、9和12 Gy剂量线包裹体积V3 Gy、V6 Gy、V9 Gy、V12 Gy;各OARs的D2 cm3。
5、统计学处理采用SPSS 26.0软件进行统计分析,计量资料符合正态分布,数据采用
不同靶区体积剂量和各剂量区体积的对比结果见表 2。其中,TG43-BT计划的HRCTV平均D90分别超出BV-BT和MC-BT剂量的4.936 %和4.460 %。TG43-BT计划的靶区HRCTV体积受量D98、D90和D50均高于MC-BT,且差异具有统计学意义(t=6.218、11.962、15.489,P < 0.05)。同时,TG43-BT计划的各剂量区体积(V3 Gy、V6 Gy、V9 Gy和V12 Gy)与MC-BT计划比较差异均有统计学意义(t=8.399、12.086、9.592、6.764,P < 0.05)。对于BV-BT计划的HRCTV D98、D90和剂量区体积V3 Gy、V6 Gy、V9 Gy,与MC-BT计划比较差异均无统计学意义(P > 0.05)。但HRCTV D50、高剂量区体积V12 Gy和MC-BT计划的差异有统计学意义(t=-2.798、-4.162,P < 0.05)。
|
|
表 2 11例局部晚期宫颈鳞癌患者不同剂量计算方法各靶区体积剂量和各剂量区体积比较( |
2、OARs剂量
3种不同算法的OARs体积剂量D2 cm3对比结果见表 3。TG43-BT计划与MC-BT计划相比,二者的膀胱、直肠和小肠的D2 cm3剂量差异有统计学意义(t=-15.128、-3.542、-3.803,P < 0.05),且TG43-BT的直肠、小肠、乙状结肠的D2 cm3平均受量均高于MC-BT计划。此外,BV-BT计划与MC-BT计划的直肠、小肠、乙状结肠的D2 cm3剂量差异均无统计学意义(P>0.05),但两者膀胱D2 cm3受量差异有统计学意义(t=-4.53,P < 0.05)。
|
|
表 3 11例局部晚期宫颈鳞癌患者不同剂量计算方法OARs的D2 cm3剂量比较(Gy, |
3、各算法剂量分布对比
本研究采用BrachyGuide软件[13]分析患者同一层面两种不同算法的等剂量曲线和剂量差异分布图,结果见图 1,图中棕红、红色、橘色、黄色和淡绿色曲线分别为12、9、6、4.8和3 Gy等剂量曲线,彩色云图为两种算法的百分剂量差异。由图 1可以看出,与TG43-BT和BV-BT相比,MC-BT主要在造影剂存在位置(膀胱等)以及施源通道附近剂量高出6%~10%,其余范围均低于另外两种算法。而对比BV-BT和TG43-BT,BV-BT仅在近源位置高出TG43-BT计划约8%。
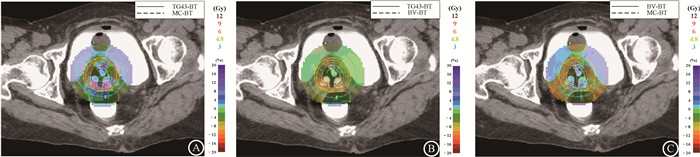
|
图 1 11例局部晚期宫颈鳞癌患者不同算法的近距离治疗剂量分布A. TG43-BT和MC-BT; B. TG43-BT和BV-BT; C. BV-BT和MC-BT Figure 1 Comparison of dose distribution for 11 patients with locally advanced cervical squamous cancer obtained by different algorithms A. TG43-BT versus MC-BT; B. TG43-BT versus BV-BT; C. BV-BT versus MC-BT |
讨论
近距离治疗以其陡峭的剂量梯度,能在大幅提高肿瘤原发部位剂量的同时,保证周围OARs受到相对较低剂量,已经成为宫颈癌治疗中必不可少的补量手段。AAPM发布的TG43号[5]报告及TG43-U1号[6]报告给出了近距离治疗的剂量计算方法(TG43-BT方法),它以单个线源在固定体积的均匀水模体中吸收剂量率为基础,优点是易于理解,计算效率高,在临床上应用最为广泛。但是该算法存在明显的缺陷,原因在于:①该方法未考虑人体组织非均匀性、施源器材料和元素组成成分及人体实际尺寸等因素对剂量影响。②与外照射采用的MV级X射线相比,近距离治疗使用发出低能光子的放射源,上述因素对该能段光子-物质反应的剂量计算影响更为显著。如Fotina等[14]于乳腺癌近距离治疗中近源位置及皮肤表面,采用TG43-BT方法的吸收剂量高估值达20%,同时高估了肺的剂量近10%。另有研究显示,TG43-BT得出的靶区剂量比MC-BT的计算结果高出10%,直肠受量D2 cm3高出了约21.49%[15-16]。2012年AAPM发布的TG186号[7]报告推荐采用基于模型的剂量计算算法,在一定程度上解决了非均匀组织剂量计算问题,提升了原有TG43-BT计算精度[17-18],但是较于MC-BT仍有不可忽视的差异。Dagli等[19]利用BV-BT和MC-BT方法对同一例宫颈癌近距离治疗进行计划计算,结果表明膀胱、直肠、乙状结肠体积受量D2 cm3差异分别为11%、2%和11%。Mikell等[20]分别采用BV-BT和MCNPX计算带屏蔽块施源器附近剂量分布,发现无屏蔽块处剂量差异约2%左右,而带有屏蔽块施源器附近两者算法的剂量差别高达9%。Hofbauer等[21]和Libby等[22]研究均显示,TG43-BT和BV-BT计算方法均可满足临床计算效率要求,但计算精度需要得到进一步验证。值得注意的是,多数文献未详细描述患者放疗前准备工作,可能会造成文献研究结果存在差异。因此,有必要采用蒙特卡罗研究方法对本治疗中心的宫颈癌近距离治疗病例进行系统评估。
本研究结果表明,TG43-BT算法普遍高估了靶区剂量和各剂量区体积,临床靶区剂量重要的评估参数HRCTV D90高出了近5%,原因在于该算法忽略了施源器材料对吸收剂量的影响。而在BV-BT算法中,其对靶区受量(HRCTV D98和D90)和较低剂量区(V3 Gy、V6 Gy和V9 Gy)的计算精度与MC-BT无明显差异,但对于剂量参数HRCTV的D50和高量区V12 Gy的评估与MC-BT差异具有统计学意义,与文献[23]报道相符,原因在于BV-BT对施源器材料吸收剂量的计算不能达到与蒙卡同样的精度。对比分析3种算法的OARs受量,TG43-BT计算的直肠、小肠、乙状结肠D2 cm3剂量普遍高于MC-BT,BV-BT和MC-BT对上述OARs剂量计算无显著差异。此外,为便于组织勾画,本中心所有三维近距离治疗患者膀胱将注入了5%浓度的泛影葡胺溶液,其密度大于纯水。模拟结果显示TG43-BT和BV-BT对该物质的吸收剂量计算精度存在欠缺,造成两种临床常用算法中膀胱吸收剂量D2 cm3明显低于MC-BT。
综上所述,宫颈癌近距离治疗剂量评估需要考虑组织非均匀性影响,其中TG43-BT算法高估了靶区剂量和OARs受量,可能会有肿瘤受照剂量不足的风险;BV-BT算法兼顾了计算精度和临床效率,可用于靶区和多数OARs剂量评估,但对于近源高剂量区、被充盈膀胱等物质密度梯度较大位置的剂量评估需谨慎;MC-BT计算精度高,缺点是耗时较长,目前不适合日常临床使用,建议可作为各中心剂量评估的依据参考。
利益冲突 所有署名作者按以下贡献声明独立开展,未接受有关公司的任何赞助
志谢 感谢中国科学技术大学基本科研业务费创新团队培育基金(WK2030040089);感谢重庆医科大学附属第二医院肿瘤中心物理师黄顺平老师在本研究BV-BT计算部分提供的技术支持
作者贡献声明 吴爱林负责构思、模拟计算、论文撰写;姜潇负责英文摘要、图表修改;吴爱东、朱磊、杨益东负责立意确认、文字修改;刘云琴、钱立庭负责病例选择、协助写作
| [1] |
Koh WJ, Abu-Rustum NR, Bean S, et al. Cervical cancer, version 3.2019, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2019, 17(1): 64-84. DOI:10.6004/jnccn.2019.0001 |
| [2] |
朱雅迪, 吴爱林, 刘云琴, 等. 三种局部补量技术在晚期宫颈癌放疗中的应用研究[J]. 中华放射医学与防护杂志, 2020, 40(4): 296-301. Zhu YD, Wu AL, Liu YQ, et al. Application of three different kinds of local boost techniques in radiotherapy for locally advanced cervical cancer[J]. Chin J Radiol Med Prot, 2020, 40(4): 296-301. DOI:10.3760/cma.j.issn.0254-5098.2020.04.009 |
| [3] |
吴爱林, 吴爱东, 刘云琴, 等. 宫颈癌二维近距离后装治疗中危及器官参考点剂量与三维体积剂量的相关性研究[J]. 中华放射医学与防护杂志, 2016, 36(11): 847-851. Wu AL, Wu AD, Liu YQ, et al. Study of association on between OARs reference points doses and OARs 3D volume doses in 2D intracavitary brachytherapy for cervical cancer[J]. Chin J Radiol Med Prot, 2016, 36(11): 847-851. DOI:10.3760/cma.j.issn.0254-5098.2016.11.010 |
| [4] |
Tyagi N, Lewis JH, Yashar CM, et al. Daily online cone beam computed tomography to assess interfractional motion in patients with intact cervical cancer[J]. Int J Radiat Oncol Biol Phys, 2011, 80(1): 273-280. DOI:10.1016/j.ijrobp.2010.06.003 |
| [5] |
Nath R, Anderson LL, Luxton G, et al. Dosimetry of interstitial brachytherapy sources: recommendations of the AAPM Radiation Therapy Committee Task Group No. 43. American Association of Physicists in Medicine[J]. Med Phys, 1995, 22(2): 209-234. DOI:10.1118/1.597458 |
| [6] |
Rivard MJ, Coursey BM, DeWerd LA, et al. Update of AAPM Task Group No. 43 Report: a revised AAPM protocol for brachytherapy dose calculations[J]. Med Phys, 2004, 31(3): 633-674. DOI:10.1118/1.1646040 |
| [7] |
Beaulieu L, Carlsson Tedgren Å, Carrier JF, et al. Report of the Task Group 186 on model-based dose calculation methods in brachytherapy beyond the TG-43 formalism: current status and recommendations for clinical implementation[J]. Med Phys, 2012, 39(10): 6208-6236. DOI:10.1118/1.4747264 |
| [8] |
Chaikh A, Giraud JY, Balosso J. Effect of the modification of CT scanner calibration curves on dose using density correction methods for chest cancer[J]. Irbm, 2014, 35(5): 255-261. DOI:10.1016/j.irbm.2014.06.002 |
| [9] |
Chambeiland M, Taylor R, Rogers D, et al. egs_brachy: a versatile and fast Monte Carlo code for brachytherapy[J]. Phys Med Biol, 2016, 61(23): 8214-8231. DOI:10.1088/0031-9155/61/23/8214 |
| [10] |
Schneider W, Bortfeld T, Schlegel W. Correlation between CT numbers and tissue parameters needed for Monte Carlo simulations of clinical dose distributions[J]. Phys Med Biol, 2000, 45(2): 459-478. DOI:10.1088/0031-9155/45/2/314 |
| [11] |
Ottosson RO, Behrens CF. CTC-ask: a new algorithm for conversion of CT numbers to tissue parameters for Monte Carlo dose calculations applying DICOM RS knowledge[J]. Phys Med Biol, 2011, 56(22): N263-274. DOI:10.1088/0031-9155/56/22/N01 |
| [12] |
吴爱林, 吴爱东, 朱磊, 等. 瓦里安高剂量率铱源剂量学参数的蒙特卡罗模拟研究[J]. 中华放射医学与防护杂志, 2018, 38(11): 859-864. Wu AL, Wu AD, Zhu L, et al. Monte Carlo simulation of dosimetric parameters of Varian HDR 192Ir sourcel[J]. Chin J Radiol Med Prot, 2018, 38(11): 859-864. DOI:10.3760/cma.j.issn.0254-5098.2018.11.012 |
| [13] |
Pantelis E, Peppa V, Lahanas V, et al. Brachy guide: a brachytherapy-dedicated DICOM RT viewer and interface to Monte Carlo simulation software[J]. J Appl Clin Med Phys, 2015, 16(1): 208-218. DOI:10.1120/jacmp.v16i1.5136 |
| [14] |
Fotina I, Zourari K, Lahanas V, et al. A comparative assessment of inhomogeneity and finite patient dimension effects in 60Co and 192Ir high-dose-rate brachytherapy[J]. J Contemp Brachytherapy, 2018, 10(1): 73-84. DOI:10.5114/jcb.2018.74327 |
| [15] |
Ma Y, Lacroix F, Lavallée MC, et al. Validation of the oncentra brachy advanced collapsed cone engine for a commercial 192Ir source using heterogeneous geometries[J]. Brachytherapy, 2015, 14(6): 939-952. DOI:10.1016/j.brachy.2015.08.003 |
| [16] |
Abe K, Kadoya N, Sato S, et al. Impactofacommercially-available model-based dose calculation algorithm on treatment planning of high-dose-rate brachytherapy in patients with cervical cancer[J]. J Radiat Res, 2018, 59(2): 198-206. DOI:10.1093/jrr/rrx081 |
| [17] |
Jacob D, Lamberto M, De Souza Lawrence L, et al. Clinical transition to model-based dose calculation algorithm: A retrospective analysis of high-dose-rate tandem and ring brachytherapy of the cervix[J]. Brachytherapy, 2017, 16(3): 624-629. DOI:10.1016/j.brachy.2017.02.008 |
| [18] |
Sinnatamby M, Nagarajan V, Reddy KS, et al. Comparison of image-based three-dimensional treatment planning using AcurosTM BV and AAPM TG-43 algorithm for intracavitary brachytherapy of carcinoma cervix[J]. J Radiother Pract, 2016, 15(3): 254-262. DOI:10.1017/S1460396916000248 |
| [19] |
Dagli A, Yurt F, Yegin G. Evaluation of Brachy Dose Monte Carlo code for HDR brachytherapy: dose comparison against Acuros®BV and TG-43 algorithms[J]. J Radiother Pract, 2019, 19(1): 76-83. DOI:10.1017/S1460396919000220 |
| [20] |
Mikell JK, Klopp AH, Price M, et al. Commissioning of a grid-based Boltzmann solver for cervical cancer brachytherapy treatment planning with shielded colpostats[J]. Brachytherapy, 2013, 12(6): 645-653. DOI:10.1016/j.brachy.2013.04.007 |
| [21] |
Hofbauer J, Kirisits C, Resch A, et al. Impact of heterogeneity-corrected dose calculation using a grid-based Boltzmann solver on breast and cervix cancer brachytherapy[J]. J Contemp Brachytherapy, 2016, 8(2): 143-149. DOI:10.5114/jcb.2016.59352 |
| [22] |
Libby B, Ter-Antonyan R, Schneider BF. Comparison of TG43 to Acuros dose calculations for high-dose-rate gynecological brachytherapy[J]. Brachytherapy, 2011, 10: S66. DOI:10.1016/j.brachy.2011.02.122 |
| [23] |
Manning S, Nyathi T. An investigation into the accuracy of AcurosTM BV in heterogeneous phantoms for a 192 Ir HDR source using LiF TLDs[J]. Australas Phys Eng Sci Med, 2014, 37(3): 505-514. DOI:10.1007/s13246-014-0279-4 |
 2021, Vol. 41
2021, Vol. 41


