在发生核事故或放射性恐怖袭击的情况下,迫切地需要对潜在受照人员进行快速、准确的医学分类,进而为临床救治提供科学依据[1-2]。研究表明,应用实时荧光定量聚合酶链反应(PCR)批量检测人外周血中辐射敏感基因的表达变化,可以满足事故下快速、高通量生物剂量估算的要求[3-5]。本课题组前期通过统计学方法将一组辐射敏感基因的表达水平变化进行组合,构建剂量评价模型,进而在一定程度上提高了剂量估算的准确度[6]。目前,基因表达变化作为生物剂量计的研究大多只关注单一剂量率照射,而在事故现场,由于人群与核爆中心的距离以及建筑物的屏蔽程度不同,使得受照人员所接受的剂量率也不完全相同,这种情况下,应用已有的生物剂量估算方法,可能会影响对真实辐射暴露水平的判断[7-8]。因此,本研究将探讨不同剂量率对辐射敏感基因表达变化的影响,为建立稳定、可靠和准确的辐射生物剂量计奠定理论基础。
材料与方法 1、仪器与试剂RPMI 1640培养基购于美国Hyclone公司,胎牛血清购于美国GIBCO公司,RNAprep Pure血液总RNA提取试剂盒购于天根生化科技(北京)有限公司,高容量cDNA反转录试剂盒Kit和SYBR select master mix购于美国Thermo Fisher公司,7500 Fast实时荧光定量PCR仪购自美国Thermo Fisher公司,SMA4000紫外分光光度仪购于美国Merinton公司。
2、血样采集在签署知情同意书的条件下,采集3名健康人(均为女性,无吸烟、饮酒史,半年内无服药史以及未接受过影像学检查史,年龄分别为24、25和26岁)离体外周血各23 ml,肝素锂抗凝。将每份血液平均分为15份,每份均为1.5 ml。
3、血样照射和培养采用北京师范大学60Co γ射线源照射血样,源靶距为79.5 cm,平均照射野为30 cm×30 cm,吸收剂量率分别为0.2、1和2 Gy/min,照射剂量为0、1、2、4和6 Gy。照射后,将血样接种于含有10%胎牛血清的RPMI 1640培养基中,置于37℃、5% CO2饱和湿度下继续培养24 h。
4、血液总RNA的提取和cDNA的合成收集血液细胞,利用RNAprep Pure血液总RNA提取试剂盒提取总RNA,紫外分光光度计下测定RNA浓度和纯度。取200 ng RNA,用高容量cDNA反转录试剂盒合成cDNA,反应体系为20 μl,反应条件为:25℃ 10 min,37℃ 120 min,85℃ 5 min,4℃终止。
5、引物设计与合成依据GeneBank数据库的基因信息,应用Primer Premier 5.0软件设计实时定量PCR反应的引物。CDKN1A、MDM2、PCNA、FDXR、GADD45 A、PHPT1、ASTN2、TNFSF4、POLH、GDF-15、PPM1D、β-肌动蛋白和B2M的引物序列见参考文献[9]。
6、实时荧光定量PCR检测基因表达变化采用SYBR Green实时荧光定量PCR方法,用7500 fast实时荧光定量PCR仪进行检测。取1 μl cDNA模板,在20 μl的反应体系中进行PCR反应。PCR反应条件为:95℃ 10 min;95℃ 15 s,60℃ 40 s,40个循环。每个样品设3个复孔,每次实时定量PCR反应后进行熔解分析,以排除引物二聚体的影响,同时设置空白对照组。
7、PCR检测数据的分析用比较Ct值方法,以β-肌动蛋白和B2M为内参基因,相对定量11个辐射敏感基因mRNA的表达水平,以未照射血样中各个基因的mRNA表达量为1,照射样品中相应基因mRNA的表达量均为未照射样品的倍数。其中,内参基因Ct值的计算方法见参考文献[10]。
8、统计学处理GraphPad Prism 8.0软件作图,SPSS 25.0软件分析实验数据。经检验,数据符合正态分布,基因相对表达量以x±s表示。两组间比较采用独立样本t检验;多组间比较经方差齐性检验采用单因素方差分析;单基因剂量-效应关系采用线性回归分析,基因组合表达模型采用逐步回归法。P < 0.05为差异有统计学意义。
结果 1、不同剂量率60Co γ射线照射后辐射敏感基因表达的剂量-效应关系剂量率分别为0.2、1和2 Gy/min 60Co γ射线照射离体人外周血0、1、2、4和6 Gy后,CDKN1A、MDM2、PCNA、FDXR、GADD45A、PHPT1、ASTN2、TNFSF4、POLH、GDF-15和PPM1D 11个基因的表达量,见表 1。在同一照射剂量率下,11个基因的表达量均随着受照剂量的增加而增加,呈现良好的剂量-效应关系,拟合的线性回归方程R2为0.744~0.998,进行回归方程的方差分析假设检验,P < 0.05。0.2、1.0和2.0 Gy/min剂量率60Co γ射线照射1~6 Gy后,与空白对照组(0 Gy)相比,GADD45 A、PHPT1和PPM1D3个基因的相对表达量均明显增加(P < 0.05);在2~6 Gy剂量范围内,CDKN1A、MDM2、PCNA、FDXR、ASTN2、TNFSF4、POLH和GDF-15基因的相对表达量较0 Gy组明显升高(P < 0.05)。
|
|
表 1 不同剂量率60Co γ射线照射后辐射敏感基因表达的剂量-效应关系 Table 1 Dose-responses of the gene expression safter γ-irradiation at different dose-rates |
2、不同剂量率60Co γ射线在相同剂量照射后基因表达水平的改变
3种不同剂量率诱导的离体人外周血中11个基因表达水平在0、1、2、4和6 Gy不同剂量时呈现剂量依赖性增加(图 1)。其中0.2 Gy/min 60Co γ射线照射2 Gy后,CDKN1A、FDXR、PHPT1和TNFSF4基因的表达量明显高于1.0和2.0 Gy/min剂量率组,差异具有统计学意义(CDKN1A:t=3.73、5.73,P < 0.05;FDXR:t=2.44、2.77,P < 0.05;PHPT1:t=3.53、2.68,P < 0.05;TNFSF4:t=2.43、2.05,P < 0.05);60Co γ射线照射6 Gy后,0.2和1.0 Gy/min诱导的PPM1D基因的表达量明显高于2.0 Gy/min剂量率组(t=3.82、2.54,P < 0.05)。其他基因在各剂量组的表达水平不受剂量率的影响,差异无统计学意义(P> 0.05)。
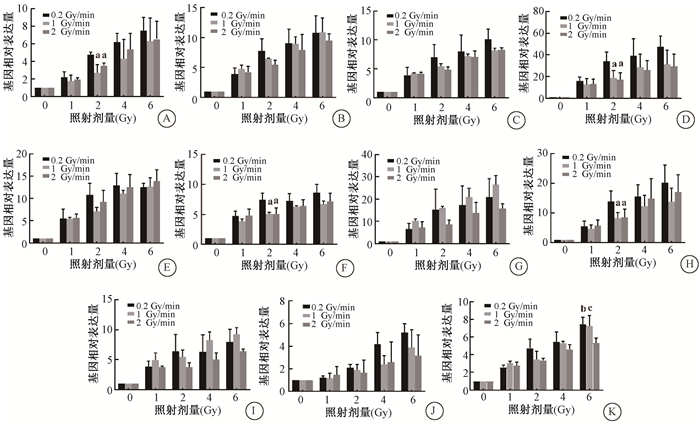
|
注:a照射2 Gy后,与0.2 Gy/min剂量率组相比,t=3.73、5.73、2.44、2.77、3.53、2.68、2.43、2.05,P < 0.05;照射6 Gy后,b与0.2 Gy/min剂量率组相比,t=2.54,P < 0.05;c与1.0 Gy/min剂量率组相比,t=3.82,P < 0.05 图 1 不同剂量率60Co γ射线照射后人外周血辐射敏感基因表达水平的变化A. CDKN1A;B. MDM2;C. PCNA;D. FDXR;E. GADD45A;F.PHPT1;G.ASTN2;H.TNFSF4;I. POLH;J.GDF-15;K.PPM1D Figure 1 Changes of gene expression levels in human peripheral blood irradiated with 60Co γ-rays at different dose rates A. CDKN1A; B. MDM2; C. PCNA; D.FDXR; E. GADD45A; F.PHPT1; G.ASTN2; H.TNFSF4; I. POLH; J.GDF-15;K.PPM1D |
3、不同剂量率对基因组合表达模型建立的影响
采用逐步回归法建立用于估算不同剂量率60Co γ射线照射后生物剂量的基因组合表达模型,得到基因组合表达模型(表 2)0.2 Gy/min:y=0.396 + 0.576PPM1D + 0.325GDF-15-0.060ASTN2(F=148.48,P < 0.001,R2=0.976);1 Gy/min:y=0.465 + 0.277PPM1D + 0.192GADD45A(F=158.41,P < 0.001,R2=0.964);2 Gy/min:y=-0.341 + 1.210PPM1D - 0.047FDXR(F=116.39,P < 0.001,R2=0.951),其中y为照射剂量(Gy),基因名称代表辐射诱导该基因的相对表达量。
|
|
表 2 不同剂量率基因组合表达模型的建立 Table 2 Establishment of the combination gene expression model under different dose rates of irradiation |
讨论
电离辐射作用于人体后,可以激活复杂的信号转导通路,而基因表达改变则是辐射反应最敏感的指标之一。研究表明,在一定条件下,电离辐射诱导的基因表达改变呈现良好的剂量-效应关系和时间响应范围,满足成为新型辐射生物剂量计的基本条件[11-12]。本课题组前期已对性别和年龄因素对辐射敏感基因表达水平的影响进行了系统研究[9]。而剂量率效应则是影响生物剂量估算准确度的另一个重要因素[13-14]。目前,国内外关于电离辐射的剂量率是否影响基因水平表达改变的研究报道不多。因此,本研究在前期工作的基础上,继续探索辐射敏感基因在受到不同剂量率的射线照射后其表达水平是否存在差异。
本研究应用3种不同剂量率的60Co γ射线对3例离体人外周血进行0~6 Gy照射后,分析11个辐射敏感基因(CDKN1A、MDM2、PCNA、FDXR、GADD45A、PHPT1、ASTN2、TNFSF4、POLH、GDF-15和PPM1D)的表达改变。结果显示3个剂量率组中11个基因的表达水平均呈现剂量-依赖性地增加,其中1 Gy/min剂量率组的基因表达水平与之前的研究结果相一致[6],表明上述辐射敏感基因在不同批次实验中具有较好的重复性。
已有研究表明,在低传能线密度(LET)电离辐射照射后,剂量率对染色体畸变剂量-效应关系的影响有严格的定量关系,在一定的剂量范围内,照射剂量相同时,诱发的畸变随剂量率的增加而增加[15]。因此,在生物剂量估算时,要考虑剂量率对观察指标的影响。本研究利用3种不同剂量率射线,0、1、2、4和6 Gy照射同一离体人外周血样品,观察各个基因的表达改变是否一致。结果显示,CDKN1A、FDXR、PHPT1、TNFSF4和PPM1D的基因表达水平在特定剂量点(2或6 Gy)呈现一定的剂量率差异;其他基因在各个剂量率组中的相对表达量差异无统计学意义,提示在较高的剂量率范围内,剂量率的不同可能会影响辐射敏感基因的表达水平改变。由于本实验采用的样品数量较少,并且辐射诱导的人外周血基因表达水平改变可能会受到个体差异等因素的影响,所以需要进一步扩大样本量验证本研究中各辐射敏感基因的剂量率效应。
在辐射诱导的基因表达水平改变的研究中,由于单一辐射敏感基因的表达受到很多因素的影响,如个体差异性、年龄和性别因素等,使其在生物剂量估算中的应用受到了很大的限制[16]。为了提高剂量估算的准确度,应用一组辐射敏感基因的表达变化对受照射个体进行辐射暴露水平评估具有较好的可行性[17]。本研究利用统计学方法分别构建3种不同剂量率60Co γ射线照射后辐射生物剂量评价模型,进一步观察剂量率对基因组合表达模型建立的影响。结果表明,虽然单个基因在相同剂量点的表达量受剂量率的影响比较有限,但在建立基因组合表达模型的过程中,纳入模型中的辐射敏感基因种类或数量却不完全相同,这主要与逐步回归的统计算法有关。3个剂量率评价模型由2~3个基因组成,其中共同纳入的基因是PPM1D,回归方程R2值为0.975~0.990,均明显高于单个基因在3个剂量率组中剂量-效应曲线的R2值,表明基因组合表达模型较单基因的剂量-效应曲线更适用于生物剂量估算。
本研究对不同剂量率60Co γ射线照射后辐射敏感基因表达水平的变化进行了初步的分析,研究结果表明在较高剂量率范围内,辐射诱导的人外周血基因表达水平变化可能受到剂量率的影响。通过建立不同剂量率的基因组合表达模型,可以更加快速和准确地对复杂事故情况下的辐射剂量进行评估。由于本研究的剂量率范围比较局限,下一步将对低剂量率和高剂量率进行系统研究,明确剂量率对基因表达水平变化的影响范围,进一步优化基因组合表达模型。
利益冲突 无
作者贡献声明 李爽负责实验操作、数据统计分析以及论文撰写;陆雪负责实验操作和数据整理;蔡恬静协助实验完成;田梅、刘青杰指导实验方案设计、结果分析和论文修改
| [1] |
Kulka U, Abend M, Ainsbury E, et al. RENEB-Running the European Network of biological dosimetry and physical retrospective dosimetry[J]. Int J Radiat Biol, 2017, 93(1): 2-14. DOI:10.1080/09553002.2016.1230239 |
| [2] |
Wojcik A, Oestreicher U, Barrios L, et al. The RENEB operational basis: complement of established biodosimetric assays[J]. Int J Radiat Biol, 2017, 93(1): 15-19. DOI:10.1080/09553002.2016.1235296 |
| [3] |
Macaeva E, Mysara M, De Vos WH, et al. Gene expression-based biodosimetry for radiological incidents: assessment of dose and time after radiation exposure[J]. Int J Radiat Biol, 2019, 95(1): 64-75. DOI:10.1080/09553002.2018.1511926 |
| [4] |
Lacombe J, Sima C, Amundson SA, et al. Candidate gene biodosimetry markers of exposure to external ionizing radiation in human blood: a systematic review[J]. PLoS One, 2018, 13(6): e0198851. DOI:10.1371/journal.pone.0198851 |
| [5] |
Balog RP, Chang P, Javitz HS, et al. Development of a point-of-care radiation biodosimeter: studies using novel protein biomarker panels in non-human primates[J]. Int J Radiat Biol, 2020, 96(1): 35-46. DOI:10.1080/09553002.2018.1532612 |
| [6] |
Li S, Lu X, Feng JB, et al. Developing gender-specific gene expression biodosimetry using a panel of radiation-responsive genes for determining radiation dose in human peripheral blood[J]. Radiat Res, 2019, 192(4): 399-409. DOI:10.1667/RR15355.1 |
| [7] |
Paul S, Smilenov LB, Elliston CD, et al. Radiation dose-rate effects on gene expression in a mouse biodosimetrymodel[J]. Radiat Res, 2015, 184(1): 24-32. DOI:10.1667/RR14044.1 |
| [8] |
Ghandhi SA, Smilenov LB, Elliston CD, et al. Radiation dose-rate effects on gene expression for human biodosimetry[J]. BMC Med Genomics, 2015, 8: 22. DOI:10.1186/s12920-015-0097-x |
| [9] |
李爽, 陆雪, 封江彬, 等. 性别和年龄对60Co γ射线照射离体人外周血辐射敏感基因mRNA表达的影响[J]. 癌变·畸变·突变, 2019, 31(6): 421-427. Li S, Lu X, Feng JB, et al. Efects of gender and age on expression of radiation-responsive genes in irradiated human peripheral blood samples[J]. Carcin Teratogen Mut, 2019, 31(6): 421-427. DOI:10.3969/j.issn.1004-616x.2019.06.001 |
| [10] |
Brzóska K, Kruszewski M. Toward the development of transcriptional biodosimetry for the identification of irradiated individuals and assessment of absorbed radiation dose[J]. Radiat Environ Biophys, 2015, 54(3): 353-363. DOI:10.1007/s00411-015-0603-8 |
| [11] |
Port M, Majewski M, Herodin F, et al. Validating baboon ex vivo and in vivo radiation-related gene expression with corresponding human data[J]. Radiat Res, 2018, 189(4): 389-398. DOI:10.1667/RR14958.1 |
| [12] |
O'Brien G, Cruz-Garcia L, Majewski M, et al. FDXR is a biomarker of radiation exposure in vivo[J]. Sci Rep, 2018, 8(1): 684. DOI:10.1038/s41598-017-19043-w |
| [13] |
Shuryak I, Ghandhi SA, Turner HC, et al. Dose and dose-rate effects in a mouse model of internal exposure from 137Cs. Part 2: integration of gamma-H2AX and gene expression biomarkers for retrospective radiation biodosimetry[J]. Radiat Res, 2020, online ahead of print. DOI: 10.1667/RADE-20-00042.1.
|
| [14] |
Chadwick KH. Towards a new dose and dose-rate effectiveness factor (DDREF)? Some comments[J]. J Radiol Prot, 2017, 37(2): 422-433. DOI:10.1088/1361-6498/aa6722 |
| [15] |
Pham ND, Nguyen MH, Tran Q, et al. Determination of spontaneous dicentric frequencies and establishment of dose-response curves after expose of human peripheral blood lymphocytes to low- and high-dose rate 60Co gamma rays-the basis for cytogenetic biodosimetry in Vietnam[J]. Int J Radiat Biol, 2019, 95(3): 307-313. DOI:10.1080/09553002.2019.1549754 |
| [16] |
Agbenyegah S, Abend M, Atkinson MJ, et al. Impact of inter-individual variance in the expression of a radiation-responsive gene panel used for triage[J]. Radiat Res, 2018, 190(3): 226-235. DOI:10.1667/RR15013.1 |
| [17] |
Sproull M, Camphausen K. State-of-the-art advances in radiation biodosimetry for mass casualty events involving radiation exposure[J]. Radiat Res, 2016, 186(5): 423-435. DOI:10.1667/RR14452.1 |
 2021, Vol. 41
2021, Vol. 41


