2. 安徽慧软科技有限公司, 合肥 230088;
3. 安徽省肿瘤医院放疗科, 合肥 230031;
4. 中国科学技术大学附属第一医院放疗科, 合肥 230031;
5. 安徽省药品审评查验中心 安徽省药品核查中心, 合肥 230000
2. Anhui Wisedom Technology Co. Ltd, Hefei 230088, China;
3. Department of Radiotherapy, Anhui Cancer Hospital, Hefei 230031, China;
4. Department of Radiotherapy, The First Affiliated Hospital, University of Science and Technology of China, Hefei 230031, China;
5. Anhui Drug Evaluation and Inspection Center, Anhui Drug Inspection Center, Hefei 230000, China
调强放射治疗(IMRT)是肿瘤治疗的主流技术之一。然而,IMRT计划的制定需要反复权衡优化参数,费时费力,其质量也与物理师的经验能力等密切相关[1-2]。基于经验的自动计划(KBP)[3-5]为弥补人工计划的不足提供了可能[6-7]。随着人工智能的发展,有研究基于深度学习方法准确预测出IMRT的三维剂量分布[8-13],而新的KBP方法即基于预测剂量的自动计划方兴未艾[5, 14]。现有相关研究常假设预测剂量是准确的,追求优化结果与预测值一致,因此高度依赖预测剂量的准确性。当预测偏差较大时,自动计划的质量将受到影响。此外,预测剂量并不一定是适合临床的帕累托最优解,仅考虑实现预测剂量易限制参数求解空间。
本研究提出了基于预测剂量的自调节IMRT自动计划方法,并在30例直肠癌病例上验证了算法对预测剂量的偏差的鲁棒性。本研究基于中国科学技术大学核医学物理研究所联合开发的商用放射治疗计划软件DeepPlan[15-16]开发实现,其剂量计算精度通过了《YY/T 0889-2013调强放射治疗计划系统性能和试验方法》标准测试[17]。
资料与方法1. 测试数据: 本研究测试数据为2015至2018年于中国科学技术大学附属第一医院接受直肠癌术后放射治疗的30例病例。患者的增强CT数据经美国GE公司Discovery CT590模拟定位机扫描获得。治疗医师参考CT和磁共振图像(MR)的融合影像完成临床靶体积(CTV)和危及器官(OARs)的勾画,CTV均匀外扩7 mm并按临床要求修改生成计划靶体积(PTV)。治疗计划采用6 MV X射线、5个共面射野,经Pinnacle 9.1治疗计划系统设计得到。所有的治疗计划均经过上级主管物理师和主任医生审核确认,并达到临床治疗需求。靶区处方剂量为50 Gy,分25次照射,V93%≥100%,V100%≥95%,V107% < 10%,V110% < 5%,Dmax < 56 Gy。各重要器官的剂量约束为:小肠V10 < 80%,V35 < 35%,V50 < 10%,Dmax < 52 Gy;膀胱V45 < 70%,V50 < 30%,Dmax < 52 Gy;股骨头V50 < 5%,Dmax < 52 Gy。其中Vx%为剂量在x%处方剂量以上的靶区体积占靶区总体积的百分比;Vx为剂量在x Gy剂量以上的某OAR体积占其总体积的百分比;Dmax为最高剂量限值。测试病例时,自动计划采用与临床计划相同的配置参数,如CT、勾画信息、加速器参数、剂量计算网格、射束数目和方向等。
2. 剂量预测模型:采用Zhou等[18]提出的基于3D CNN模型[19]和Residual Network的3D U-Res-Net_B卷积神经网络,对30例病例进行剂量预测[20]。该网络输入CT图像、PTV和OARs的勾画信息及射束信息,输出预测的三维剂量。在测试集上,体素的预测剂量和临床剂量平均偏差为[-1.94%,1.58%],平均绝对偏差(MAEs)为(3.92±4.16)%,大部分等剂量面的Dice相似性系数在0.9以上,优于3D U-Res-Net_O和常见的3D U-Net网络,预测精度较高。
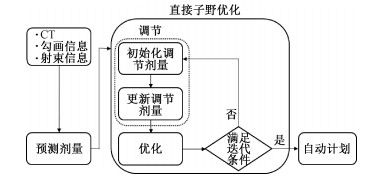
3. 自动计划方法:尽管预测剂量在平均意义上接近临床计划,但仍会出现与临床计划偏差较大的情况,如靶区欠剂量或者OARs高剂量,因此很难确保由此产生的自动计划能满足临床要求。为解决这一问题,本文提出的自动计划方法计算流程如图 1。在获得预测剂量后,直接子野优化(DAO)[17, 21]的每次迭代可以分为调节和优化两部分,其中调节的目的是构建调节剂量;而优化的目的则是以该剂量为优化目标,约束每次迭代中的实际剂量接近调节剂量。
|
图 1 自动计划方法流程 Figure 1 Process of the automatic planning method |
4. 调节方法:先输入预测剂量,其次在DAO的每次迭代中,初始化调节剂量,令其等于预测剂量,再更新调节剂量。式(1)~(3)分别描述了调节剂量在PTV、OARs和其他区域的更新方法。
| $ {D_{\rm{a}}}\left( m \right) = \left\{ \begin{array}{l} {D_{{\rm{PTV}}}}\left( m \right)\;{\rm{if}}\;{D_{{\rm{PTV}}}}\left( m \right) > {D_{\rm{p}}}\left( m \right)\\ {D_{\rm{p}}}\left( m \right)\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{\rm{else}} \end{array} \right. $ | (1) |
| $ {D_{\rm{a}}}\left( n \right) = {\rm{ }}\left\{ \begin{array}{l} {D_{{\rm{OAR}}}}\left( n \right)\;{\rm{if}}\;{D_{{\rm{OAR}}}}\left( n \right) < {D_{\rm{p}}}\left( n \right)\\ {D_{\rm{p}}}\left( n \right)\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{\rm{else}} \end{array} \right. $ | (2) |
| $ {D_{\rm{a}}}\left( k \right) = {D_p}\left( k \right)\;{\rm{if}}\;k \notin {\rm{PTV}}\;{\rm{and}}\;k \notin {\rm{OAR}} $ | (3) |
式中,DPTV、DOAR分别为本次迭代中PTV和OARs的当前剂量;Dp、Da分别为预测剂量和调节剂量;m、n、k为相应区域的体素编号。
更新的过程可表述为:根据上次迭代结果计算当前剂量,并与调节剂量逐体素对比,若调节剂量低于当前剂量且体素属于PTV,提高剂量到DPTV(i);若调节剂量高于当前剂量且体素属于OARs,降低剂量到DOAR(i)。
优化时,计算目标函数值,采用共轭梯度法优化迭代强度分布、子野形状和子野权重。考虑到调节方法可能使靶区违反最大剂量约束,为约束靶区中的过高剂量,本研究在目标函数中添加了最大剂量约束,以约束过高剂量点出现。式(4)为目标函数定义。式中,Dm为靶区最高剂量限值。若当前剂量低于靶区最高剂量限制时,δm为0,否则为1。ωPTV、ωOAR、ωmax为目标权重。
| $ \begin{array}{l} {\rm{Min}}F = {\omega _{{\rm{PTV}}}}{\Sigma _{{\rm{PTV}}}}{({D_{{\rm{PTV}}}}\left( i \right) - {D_{\rm{a}}}\left( i \right))^2} + {\omega _{{\rm{OAR}}}}{\Sigma _{{\rm{OAR}}}}\\ {[{D_{{\rm{oar}}}}\left( i \right) - {D_{\rm{a}}}\left( i \right)]^2} + {\omega _{{\rm{max}}}}{\Sigma _{{\rm{PTV}}}}{\delta _{\rm{m}}}{[{D_{{\rm{PTV}}}}\left( i \right) - {D_{\rm{m}}}\left( i \right)]^2} \end{array} $ | (4) |
由于勾画信息中PTV和OAR存在重叠部分,这部分体素高于或低于预测剂量都会计算损失值,从而导致优化方向的不确定。因此,PTV的权重需要大于OAR以确保治疗效果。本方法在所有病例上测试确定出一组权重,这组权重确保了绝大部分病例的治疗靶区接受到足够的剂量,同时危及器官的受照剂量尽可能无明显增加。
5. 结果评价方法:统计并分析了临床计划、预测剂量以及自动计划的DVH指标和适形性指数(CI)[22]、均匀性指数(HI)[23]等参数。逐体素计算临床计划与自动计划、临床计划与预测剂量的剂量差异,分析三者在剂量分布上的接近程度。
6. 统计学处理:由于数据具有相关性且非正态分布,使用SPSS 25.0对统计结果进行非参数配对样本Wilcoxon符号秩检验,P < 0.05为差异具有统计学意义。
结果1. PTV剂量学指标比较: 表 1统计了PTV的剂量学指标。预测剂量的指标V100%均值和标准差为(92.90±2.13)%,低于临床计划(95.03±0.91)%,差异具有统计学意义(t=29.0,P < 0.05);而自动计划的V100%为(94.67±1.96)%,与临床计划的差异无统计学意义(P>0.05)。自动计划的V107%和V110%高于临床计划,且差异有统计学意义(t=178.5~358.5,P < 0.05)。但在其他指标上,自动计划与临床计划的指标差异均无统计学意义(P>0.05)。CI和HI指数临床计划与自动计划接近;而预测剂量的CI较低,与临床计划的差异具有统计学意义(t=86,P < 0.05)。
|
|
表 1 30例PTV剂量学指标对比(x±s) Table 1 Comparison of dosimetric indicators for 30 cases(x±s) |
2. OAR剂量学指标比较: 表 2统计了临床计划、自动计划和预测剂量OAR的V10、V20、V30、V40和处方单指标等数据。可见,预测剂量与自动计划在大部分指标上和临床计划无明显差异。但在部分指标上,例如小肠V20、V35,膀胱V40、V50,左右股骨头的V20 ~V40等,自动计划的剂量低于预测值和临床值,且差异具有统计学意义(t=4.5~118.0,P < 0.05)。
|
|
表 2 30例危及器官剂量指标统计(x±s) Table 2 Statistics of dosimetric indicators for OARs in 30 cases(x±s) |
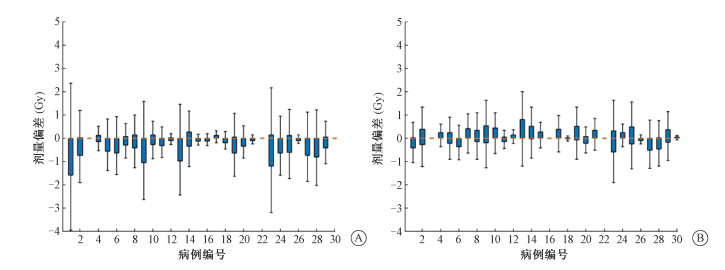
3. 三维剂量分布比较: 逐体素计算每个患者的临床计划和预测剂量、临床计划与自动计划的剂量差值,绘制箱线图(图 2)。从差异的总体分布上看,预测剂量与临床计划的差异波动较大,最小差异接近0 Gy,但是最大差异接近4 Gy。自动计划和临床计划的体素剂量最为接近,最大差异不超过2 Gy,且大部分病例的偏差集中在1 Gy内。对于预测剂量和临床计划存在较大差异的情况,如1、9和23号病例等,自动计划明显缩小了与临床剂量的差异。
|
图 2 不同病例的三维剂量偏差A. 预测剂量与临床计划三维剂量偏差;B. 自动计划与临床计划三维剂量偏差 Figure 2 3D dose difference in multiple cases A. Dose difference between predicted dose and clinical plans; B. Dose difference between automated plans and clinical plans |
讨论
KBP方法常依赖人为构建的特征如重叠体积直方图或预测DVH等实现自动计划,因此存在不足,如特征对自动计划的重要性和完备性未知;DVH缺少空间信息,同一DVH可能对应多种剂量分布等[8]。基于深度学习的剂量预测方法能自动提取有效特征,输出三维剂量分布,有效克服了以上缺陷。对自动计划而言,预测剂量仅是第一步,而设计优化方法实现预测剂量的研究仍然缺乏。现有基于预测剂量的自动计划方法,如Fan等[14]基于体素剂量的优化和Babier等[5]基于预测剂量DVH的优化方法,对预测的准确性敏感度高。考虑到神经网络的预测结果容易受到数据集等多种因素影响,现有方法难以应用到复杂的临床实践。本研究基于3D U-Res-Net_B网络预测直肠癌病例的三维剂量,提出了自调节调强放疗自动计划方法,与现有同类方法相比,首次考虑了预测剂量的偏差对自动计划质量的影响,增强了基于预测剂量的自动计划方法的鲁棒性。为更清楚地对比预测剂量、自动计划和临床计划的剂量差异,本研究未对结果做剂量归一化处理。
根据DVH指标的统计数据,预测剂量在PTV的处方剂量指标V100%上低于临床治疗要求,这意味着其在治疗靶区欠剂量。这种情况并非个例,Kearney等[24]的研究也表明:部分神经网络预测出的剂量在V100%和V95%指标上低于临床计划。治疗靶区欠剂量会降低治疗计划质量,影响治疗效果。而现有基于预测剂量的自动计划方法[5, 14]均以预测剂量为优化目标,因此无法修正预测剂量的偏差。本研究以调节剂量为优化目标,当预测值在靶区欠剂量时,实现了自动计划V100%与临床计划的差异无统计学意义,具有修正欠剂量偏差、提高自动计划鲁棒性的能力。此外,自动计划VDmax与临床值的差异不具有统计学意义,表明调节方法未导致靶区剂量大幅超过最高剂量限值;预测剂量的CI指数较低,而自动计划的CI接近临床计划,证明自动计划可以改善剂量分布的适形度。自动计划靶区V107%和V110%较高,但少见文献报告其与放疗不良反应相关。
小肠是直肠癌放疗需要保护的危及器官,10~30 Gy的低剂量受照体积与腹泻及血液学不良反应相关较强,而高剂量照射体积与晚期肠道不良反应发生率相关[25-26],因此,在放疗中必须关注其剂量限值。自动计划与临床计划在大部分小肠DVH指标上的差异无统计学意义,表明自动计划和临床计划的小肠受照射剂量相近。此外,在小肠V20、V35,膀胱V40、V50,左右股骨头的V20 ~V40等多项指标上,自动计划不仅优于预测剂量,还低于临床计划。这表明预测剂量在这些指标上偏高,存在进一步优化的空间,而自动计划改进了剂量分布,取得了超过模板库的水平。
临床计划和预测剂量在三维剂量分布上的差异表明:尽管深度学习能准确预测大部分病例的剂量,但是在个别病例上仍存在较大差异。有研究发现临床的体素剂量和对应预测值差异或达到15%以上[9]。本研究能缩小预测值与临床计划的偏差,使其三维剂量更加接近临床剂量。这种能力在偏差较大的病例,如1、9和23号病例上体现更加明显。
作为前瞻性研究,本研究假设物理师在使用自动计划前已确定射束的数目和方向。然而在IMRT放疗中,射束的数目和角度的最优化也是重要的研究课题[30]。此外,容积旋转调强放疗(VMAT)因其速度快、适形好的优点逐步受到更多关注。因此,本研究未来的工作将聚焦于多种布野条件下的IMRT自动计划方法和VMAT自动计划方法,并进一步改进剂量预测和优化方法,提高方法的通用性和实用性,推动自动计划应用到临床治疗。
利益冲突 所有研究者未因进行该研究接受任何不正当职务或利益,在此对研究的独立性和科学性予以保证
作者贡献声明 闫永恒负责研究的设计、实现及论文撰写;潘茂云、周解平、吴爱东、吴文华负责数据的收集、处理和分析;徐榭、裴曦负责研究设计、技术指导和论文修改
| [1] |
Nelms BE, Robinson G, Markham J, et al. Variation in external beam treatment plan quality: An inter-institutional study of planners and planning systems[J]. Pract Radiat Oncol, 2012, 2(4): 296-305. DOI:10.1016/j.prro.2011.11.012 |
| [2] |
Moore KL, Schmidt R, Moiseenko V, et al. Quantifying unnecessary normal tissue complication risks due to suboptimal planning: A secondary study of RTOG 0126[J]. Int J Radiat Oncol Biol Phys, 2015, 92(2): 228-235. DOI:10.1016/j.ijrobp.2015.01.046 |
| [3] |
Chanyavanich V, Das SK, Lee WR, et al. Knowledge-based IMRT treatment planning for prostate cancer[J]. Med Phys, 2011, 38(5): 2515-2522. DOI:10.1118/1.3574874 |
| [4] |
McIntosh C, Purdie TG. Voxel-based dose prediction with multi-patient atlas selection for automated radiotherapy treatment planning[J]. Phys Med Biol, 2017, 62(2): 415-431. DOI:10.1088/1361-6560/62/2/415 |
| [5] |
Babier A, Mahmood R, McNiven AL, et al. Knowledge-based automated planning with three-dimensional generative adversarial networks[J]. Med Phys, 2020, 47(2): 297-306. DOI:10.1002/mp.13896 |
| [6] |
Moore KL. Automated radiotherapy treatment planning[J]. Semin Radiat Oncol, 2019, 29(3): 209-218. DOI:10.1016/j.semradonc.2019.02.003 |
| [7] |
Hussein M, Heijmen B, Verellen D, et al. Automation in intensity modulated radiotherapy treatment planning-a review of recent innovations[J]. Br J Radiol, 2018, 91(1092): 20180270. DOI:10.1259/bjr.20180270 |
| [8] |
Barragán-Montero AM, Nguyen D, Lu W, et al. Three-dimensional dose prediction for lung IMRT patients with deep neural networks: robust learning from heterogeneous beam configurations[J]. Med Phys, 2019, 46(8): 3679-3691. DOI:10.1002/mp.13597 |
| [9] |
Nguyen D, Long T, Jia X, et al. A feasibility study for predicting optimal radiation therapy dose distributions of prostate cancer patients from patient anatomy using deep learning[J]. Sci Rep, 2019, 9(1): 1076. DOI:10.1038/s41598-018-37741-x |
| [10] |
Ma M, Kovalchuk N, Buyyounouski MK, et al. Incorporating dosimetric features into the prediction of 3D VMAT dose distributions using deep convolutional neural network[J]. Phys Med Biol, 2019, 64(12): 125017. DOI:10.1088/1361-6560/ab2146 |
| [11] |
Liu Z, Fan J, Li M, et al. A deep learning method for prediction of three-dimensional dose distribution of helical tomotherapy[J]. Med Phys, 2019, 46(5): 1972-1983. DOI:10.1002/mp.13490 |
| [12] |
Kajikawa T, Kadoya N, Ito K, et al. Automated prediction of dosimetric eligibility of patients with prostate cancer undergoing intensity-modulated radiation therapy using a convolutional neural network[J]. Radiol Phys Technol, 2018, 11(3): 320-327. DOI:10.1007/s12194-018-0472-3 |
| [13] |
Chen X, Men K, Li Y, et al. A feasibility study on an automated method to generate patient-specific dose distributions for radiotherapy using deep learning[J]. Med Phys, 2019, 46(1): 56-64. DOI:10.1002/mp.13262 |
| [14] |
Fan J, Wang J, Chen Z, et al. Automatic treatment planning based on three-dimensional dose distribution predicted from deep learning technique[J]. Med Phys, 2019, 46(1): 370-381. DOI:10.1002/mp.13271 |
| [15] |
郭翌. 基于深度学习的图像配准方法在放疗计划系统DeepPlan中的应用研究[D]. 合肥: 中国科学技术大学, 2020. Guo Y.Study and application of deep learning based image registration in the deepplan treatment planning system[D].Hefei: University of Science and Technology of China, 2020. |
| [16] |
霍万里. 基于笔形束算法的质子剂量计算方法研究及其在放疗计划系统DeepPlan中的应用[D]. 合肥: 中国科学技术大学, 2019. Huo WL.Study and application of proton dose calculation of pencil-beam algorithms for the DeepPlan treatment planning system[D].Hefei: University of Science and Technology of China, 2019. |
| [17] |
程博, 方诗杰, 任强, 等. DeepPlan系统中快速直接子野优化在临床中的应用研究[J]. 中华放射医学与防护杂志, 2020, 40(12): 938-944. Chen B, Fang SJ, Ren Q, et al. Study on the clinical application of the fast direct apeture optimization of DeepPlan treatment planning system[J]. Chin J Radiol Prot, 2020, 40(12): 938-944. DOI:10.3760/cma.j.issn.0254-5098.2020.12.008 |
| [18] |
Zhou J, Peng Z, Song Y, et al. A method of using deep learning to predict three-dimensional dose distributions for intensity-modulated radiotherapy of rectal cancer[J]. J Appl Clin Med Phys, 2020, 21(5): 26-37. DOI:10.1002/acm2.12849 |
| [19] |
Anwar SM, Majid M, Qayyum A, et al. Medical image analysis using convolutional neural networks: a review[J]. J Med Syst, 2018, 42(11): 226. DOI:10.1007/s10916-018-1088-1 |
| [20] |
Yu L, Chen H, Dou Q, et al. Automated melanoma recognition in dermoscopy images via very deep residual networks[J]. IEEE Trans Med Imaging, 2017, 36(4): 994-1004. DOI:10.1109/TMI.2016.2642839 |
| [21] |
裴曦, 曹瑞芬, 景佳, 等. 调强放射治疗子野权重优化方法研究[J]. 原子核物理评论, 2011, 28(1): 103-108. Pei X, Cao RF, Jing J, et al. A method of segment weight optimization for intensity modulated radiation therapy[J]. Nucl Phys Rev, 2011, 28(1): 103-108. DOI:10.11804/NuclPhysRev.28.01.103 |
| [22] |
Paddick I. A simple scoring ratio to index the conformity of radiosurgical treatment plans[J]. J Neurosurg, 2000, 93(supplement_3): 219-222. DOI:10.3171/jns.2000.93.supplement |
| [23] |
Hodapp N. The ICRU Report 83:prescribing, recording and reporting photon-beam intensity-modulated radiation therapy (IMRT)[J]. Strahlenther Onkol, 2012, 188(1): 97-99. DOI:10.1007/s00066-011-0015-x |
| [24] |
Kearney V, Chan JW, Haaf S, et al. DoseNet: a volumetric dose prediction algorithm using 3D fully-convolutional neural networks[J]. Phys Med Biol, 2018, 63(23): 235022. DOI:10.1088/1361-6560/aaef74 |
| [25] |
Sebag-Montefiore D, Stephens RJ, Steele R, et al. Preoperative radiotherapy versus selective postoperative chemoradiotherapy in patients with rectal cancer (MRC CR07 and NCIC-CTG C016): a multicentre, randomised trial[J]. Lancet, 2009, 373(9666): 811-820. DOI:10.1016/s0140-6736(09)60484-0 |
| [26] |
Guillem JG, Díaz-González JA, Minsky BD, et al. cT3N0 rectal cancer: potential overtreatment with preoperative chemoradiotherapy is warranted[J]. J Clin Oncol, 2008, 26(3): 368-373. DOI:10.1200/JCO.2007.13.5434 |
| [27] |
Sadeghnejad Barkousaraie A, Ogunmolu O, Jiang S, et al. A fast deep learning approach for beam orientation optimization for prostate cancer treated with intensity-modulated radiation therapy[J]. Med Phys, 2020, 47(3): 880-897. DOI:10.1002/mp.13986 |
 2021, Vol. 41
2021, Vol. 41


