放射治疗是局部晚期前列腺癌的主要治疗方法,照射剂量越高,肿瘤控制率越好[1],但是直肠与前列腺相邻,直肠是限制照射剂量的主要危及器官[2]。因此,在前列腺与直肠之间植入水凝胶,增加两者间距,可以提高前列腺照射剂量的同时降低直肠损伤。
水凝胶是一种可吸收的聚乙二醇水凝胶(polyethylene glycol hydrogel,PEG), 经直肠超声引导植入前列腺与直肠之间,形成水凝胶间隔,可稳定存在3个月,6个月后液化吸收[3-4]。目前国外已有大量文献对其进行研究报道,因此,本文对近几年发表的有关前列腺癌患者植入水凝胶后放疗的对照试验数据进行Meta分析,探讨植入水凝胶后对直肠剂量,肠道不良反应以及患者生活质量的影响。
资料与方法1.检索策略:检索数据库包括PubMed、Web of Science、Cochrane Library、Embase、CNKI和维普数据库;检索主题词主要包括prostate cancer、Polyethylene-glycol hydrogel/PEG、radiotherapy、前列腺癌、水凝胶、放射治疗。
2.选择标准:①纳入标准:病理学证实前列腺癌患者;研究类型是临床对照试验;研究设计是植入水凝胶与未植入水凝胶的比较;可提取完整数据。②排除标准:综述、个案、会议及动物试验;无法获取全文;试验数据不完整;同一数据重复报道。
3.文献筛选和数据提取:由两名研究者对检索结果独立进行阅读文题和摘要筛选,当两名研究者意见出现分歧时与第3位研究者进行讨论决定,最终提取纳入文献的基本资料,包括:作者、发表时间、病例数、治疗方案,直肠与前列腺间距,直肠V70、直肠D2 cm3,以及患者生活质量评分,常采用扩展性前列腺癌复合指数量表(the expanded prostate cancer index composite,EPIC)进行评估,此量表从尿失禁、尿路刺激、排便、性功能、内分泌5个方面评估前列腺癌患者生活质量,对于患者生活质量通过排便次数、排便症状以及是否便血等进行评估[5]。对数据不完整的研究,尽可能联系作者获得。
4.文献质量评价:纳入后的文献采用Cochrane质量评价标准,包括:随机序列的产生、分配隐藏、对研究者和受试者施盲、研究结局盲法评价、结局数据的完整性、选择性报道研究结果、其他偏倚,7个项目得分分为“低风险”“不明确风险”“高风险”。
5.统计学处理:采用Revman 5.3统计软件处理数据,直肠V70、直肠D2 cm3、患者生活质量的数据为连续性变量,使用平均差(mean difference,MD)作为效应指标和95%可信区间(confidence internal,CI)表示,肠道不良反应的数据为二分类变量,使用比值比(odds ratio,OR)作为效应指标和95%CI表示。采用χ2及I2统计量作为研究异质性检验方法,各研究间统计学无异质性(P>0.1,I2<50%)时,采用固定效应模型分析;存在异质性(P<0.1,I2>50%)时,采用随机效应模型分析。采用漏斗图分析发表偏倚。P<0.05为差异有统计学意义。
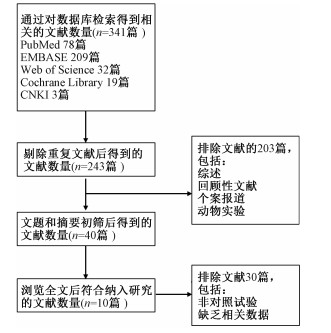
结果1.检索结果与基本特征:共检索相关文献341篇,剔除重复文献(98篇)后剩余243篇,阅读文题和摘要后,排除不相关文献、综述、个案报道、动物实验等(203篇),剩余40篇,进一步阅读全文,最终纳入10篇相关文献进行分析[6-15]。文献筛选流程见图 1。本研究共纳入患者1 360例,其中水凝胶组患者690例,对照组患者670例,患者基本特征见表 1。
|
图 1 文献筛选流程图 Figure 1 Literature screening process |
|
|
表 1 纳入文献基本特征 Table 1 The characteristics of the included studies |
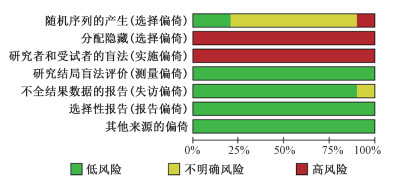
2.纳入文献质量评价结果:采用Cochrane质量评价标准对纳入研究的10篇文献进行质量评价,针对每篇纳入研究的每项偏倚风险进行判断,其中由于研究的特殊性,文献双盲无法实现,属高风险偏倚,质量评价结果见图 2。
|
图 2 文献质量Cochrane质量评价 Figure 2 Cochrane risk of bias assessment among individual studies |
3.Meta分析结果
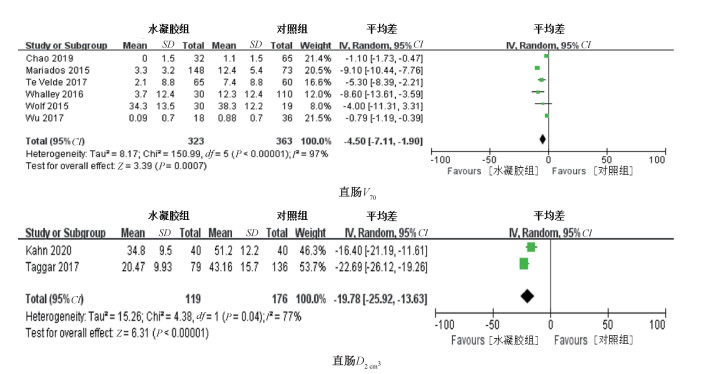
(1) 直肠剂量:①直肠V70(直肠接受≥70 Gy剂量的体积):共有6项研究报道了直肠V70研究结果,异质性检验显示各研究间存在异质性(P<0.001,I2=97%)采用随机效应模型进行分析,结果显示植入水凝胶后直肠V70较对照组明显降低(MD=-4.5,95%CI为-7.11~-1.90,P<0.001)。②直肠D2 cm3(2 cm3直肠体积接受的剂量):共有2项研究报道了直肠D2 cm3研究结果,异质性检验显示各研究间存在异质性(P=0.04,I2=77%)采用随机效应模型进行分析,结果显示植入水凝胶后直肠D2 cm3较对照组明显降低(MD=-19.78,95%CI为-25.92~-13.63,P<0.001),见图 3。
|
图 3 水凝胶组与对照组直肠剂量的Meta分析 Figure 3 Meta-analysis of rectal dose in hydrogel group and control group |
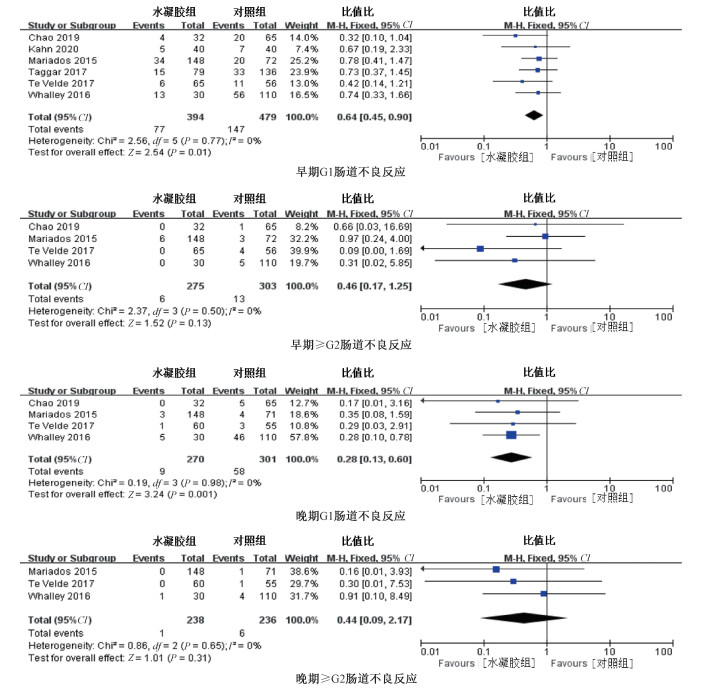
(2) 肠道不良反应:①早期G1肠道不良反应:共有6项研究报道了早期G1肠道不良反应研究结果,异质性检验显示各研究间不存在异质性(P=0.77,I2=0)采用固定效应模型进行分析,结果显示植入水凝胶后早期G1肠道不良反应较对照组明显改善(OR=0.64,95%CI为0.45~0.90,P=0.01)。②早期≥G2肠道不良反应:共有4项研究报道了早期≥G2肠道不良反应研究结果,异质性检验显示各研究间不存在异质性(P=0.5,I2=0)采用固定效应模型进行分析,结果显示两组差异无统计学意义(OR=0.46,95%CI为0.17~1.25,P=0.13)。③晚期G1肠道不良反应:共有4项研究报道了晚期G1肠道不良反应研究结果,异质性检验显示各研究间不存在异质性(P=0.98,I2=0)采用固定效应模型进行分析,结果显示植入水凝胶后晚期G1肠道不良反应较对照组明显改善(OR=0.28,95%CI为0.13~0.60,P=0.001)。④晚期≥G2肠道不良反应:共有3项研究报道了晚期≥G2肠道不良反应研究结果,异质性检验显示各研究间不存在异质性(P=0.65,I2=0%)采用固定效应模型进行分析,结果显示两组差异无统计学意义(OR=0.44,95%CI为0.09~2.17,P=0.31),见图 4。
|
图 4 水凝胶组与对照组肠道不良反应的Meta分析 Figure 4 Meta-analysis of rectal toxic effects in hydrogel group and control group |
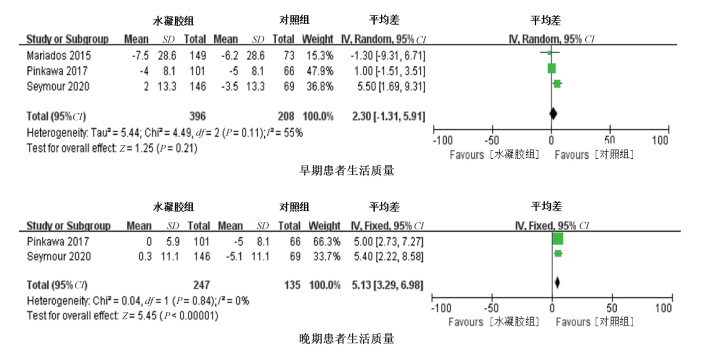
(3) 患者生活质量:①早期患者生活质量:共有3项研究报道了早期患者生活质量研究结果,异质性检验显示各研究间存在异质性(P=0.11,I2=55%)。采用随机效应模型进行分析,结果显示两组早期患者生活质量相近(MD=2.30,95%CI为-1.31~5.91,P=0.21)。②晚期患者生活质量:共有2项研究报道了晚期患者生活质量研究结果,异质性检验显示,各研究间不存在异质性(P=0.84,I2=0)。采用固定效应模型进行分析,结果显示,植入水凝胶后晚期患者生活质量较对照组明显提高(MD=5.13,95%CI为3.29~6.98,P<0.001),见图 5。
|
图 5 水凝胶组与对照组患者生活质量的Meta分析 Figure 5 Meta-analysis of bowel quality of life in hydrogel group and control group |
4.异质性分析:异质性检验显示直肠V70、直肠D2 cm3和早期患者生活质量各研究间存在异质性,因直肠D2 cm3和早期患者生活质量纳入研究文献较少,无法行亚组分析,对水凝胶组与对照组直肠V70纳入研究根据放疗方案分为调强放射治疗IMRT组和近距离治疗BT或调强放射治疗联合近距离治疗(IMRT+BT)组进行亚组分析探讨异质性来源:①IMRT组:共纳入4项研究结果,异质性检验显示各研究间存在异质性(P= 0.10,I2=52%),研究结果显示,水凝胶组患者直肠V70较对照组显著下降,差异有统计学意义(MD=-7.43,95%CI为-9.94~-4.93,P<0.001)。②BT或IMRT+BT组:共纳入2项研究结果,异质性检验显示,各研究间不存在异质性(P=0.42,I2=0%),研究结果显示水凝胶组患者直肠V70较对照组显著下降,差异有统计学意义(MD=-0.88,95%CI为-1.20~-0.54,P<0.001),见图 6。

|
注:IMRT.调强放射治疗;BT.近距离治疗 图 6 水凝胶组与对照组直肠V70亚组分析 Figure 6 Subgroup analysis of rectal V70 in hydrogel group and control group |
5.敏感性分析:利用敏感性分析对直肠V70和肠道不良反应研究进行分析,结果显示逐次剔除单个研究后分析结果与原来的研究结果没有差异。因直肠D2 cm3和患者生活质量纳入研究不足,故未行敏感性分析。
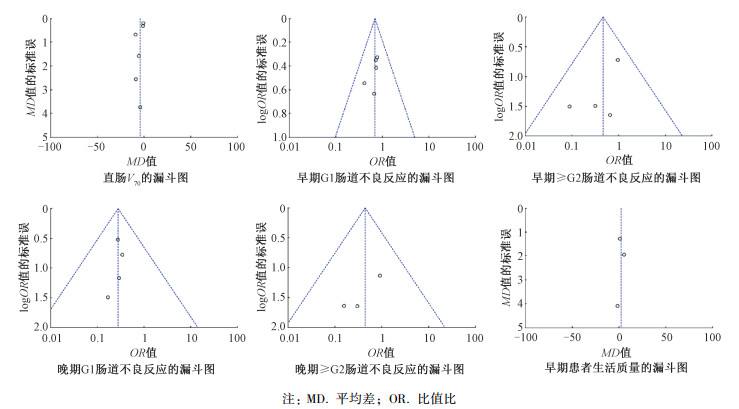
6.发表偏倚分析:水凝胶组与对照组在直肠V70和肠道不良反应和早期患者生活质量的漏斗图基本呈现左右对称形的漏斗形,提示无明显发表偏倚。由于直肠D2 cm3和晚期患者生活质量纳入研究只有2项,不能评估对称性,见图 7。
|
注:MD.平均差;OR.比值比 图 7 发表偏倚评价 Figure 7 Publication bias analysis |
讨论
放射性直肠炎是前列腺癌放疗常见并发症之一,据报道2级以上晚期肠道不良反应发生率为6%~28%[16-17],严重影响患者生活质量。目前研究表明,在前列腺与直肠间植入水凝胶,可以有效增加两者间距,降低直肠照射剂量,减少肠道不良反应,从而提高患者生活质量。有5项研究[6, 8, 11-13]报道植入水凝胶后前列腺与直肠间距增加到10~13.9 mm,然而目前没有关于最佳间距的报道。Pinkawa等[18]把前列腺癌患者随机分为两组,第1组前列腺与直肠间距平均为11 mm,直肠V70为6.0%,相对减少62.5%;而第2组间距平均为15 mm,直肠V70为2.0%,相对减少80.0%。对于植入水凝胶的成功率,Mariados等[6]和Te Velde等[14]的研究分别报道了2例和5例患者因间隔分离不对称或穿刺针穿入直肠中导致分离不成功,其他研究成功率均为100%。关于植入水凝胶术后并发症,只有Wu等[9]报道了1位患者术后出现会阴脓肿,后行切开引流和抗感染治疗后好转。一项回顾性研究指出[19],患者植入水凝胶后发生术后并发症包括里急后重(0.14%)、直肠不适(1.19%)和细菌性前列腺炎(0.44%),均未影响患者正常生活。
在直肠剂量方面,选择直肠V70和直肠D2 cm3作为评价指标,因为有研究表明前列腺癌患者接受外照射治疗,直肠V70≥15%与肠道不良反应密切相关[20],同样Huang等[21]研究证实这个结论,而且也有文献证实在前列腺癌近距离治疗中直肠D2 cm3与肠道不良反应之间存在显著相关性[22]。植入水凝胶可以显著降低直肠V70和直肠D2 cm3,但是结果存在异质性,对直肠V70纳入文献进行亚组分析,两组分析结果差异均具有统计学意义,IMRT组仍存在异质性,而BT或IMRT+BT组不存在异质性,认为放疗技术可能是异质性来源。分析原因可能是,BT较IMRT有剂量快速跌落特性,增加前列腺与直肠间距,剂量下降更明显[23]。植入水凝胶后行IMRT,Pinkawa等[24]研究结果显示,直肠V70相对下降58%(植入前17.2%;植入后7.5%,P<0.01);同样,Weber等[25]研究表明,直肠V70相对下降46%(植入前9.8%;植入后5.3%,P=0.012)。植入水凝胶后行IMRT+BT,Chao等[12]研究表明,直肠V70相对下降100%(植入前86%;植入后0,P<0.001)。
在肠道不良反应方面,结果显示植入水凝胶后可以降低早期和晚期G1肠道不良反应,但是在Mariados等[6]研究中水凝胶组早期G1肠道不良反应发生率高于对照组(34.2%和31.5%,P>0.05),差异无统计学意义,因为研究把植入水凝胶后患者出现暂时的会阴部不适纳入早期放疗导致的不良反应,然而晚期肠道不良反应较少受水凝胶本身的干扰,能更好地反映水凝胶的作用,水凝胶组晚期G1肠道不良反应发生率低于对照组(2%和7%,P=0.044),差异有统计学意义。Miller等[26]纳入水凝胶相关文献并进行Meta分析,结果提示水凝胶组晚期≥G2级肠道不良反应较对照组显著降低(1.5%、5.7%,P=0.05),差异具有统计学意义。可是Whalley等[8]研究显示水凝胶组和对照组晚期≥G2级肠道不良反应发生率分别为3.3%和3.6%,结果差异并无统计学意义,同样Kahn等[13]和Te Velde等[14]的研究均得出相同的结果。本文对纳入文献进行研究显示,水凝胶组与对照组晚期≥G2级肠道不良反应差异无统计学意义(P=0.31)。分析原因可能是:①有研究报道,前列腺癌放疗后晚期≥G2级肠道不良反应最佳随访时间是17个月,在1.5年和4.5年存在两个峰值,随访时间的不足和不一致可能导致结果存在差异[27]。②纳入研究数量有限,不足以探讨植入水凝胶与早期和晚期≥G2级肠道不良反应关系。因此,有关晚期≥G2肠道不良反应结果仍需大量随机对照试验同时统一随访时间进行佐证。
前列腺癌患者患者生活质量采用EPIC评估,本文研究结果显示,植入水凝胶后虽然可以提高早期生活质量,但差异无统计学意义,可能与植入水凝胶导致会阴部不适有关。对于晚期生活质量研究结果显示差异具有统计学意义,与Hamstra等[28]研究结果一致,随访36个月时水凝胶组和间隔组患者患者生活质量评分下降5分和10分的比例分别是14%、41%和5%、21%,相对下降了70%,同时水凝胶组患者患者生活质量评分比对照组平均高5.8分(P=0.002)。同样,Karsh等[29]结果也证实这一结果。
本研究对于直肠V70的异质性根据IMRT和BT或BT+IMRT进行亚组分析,认为放疗的技术可能是其异质性的来源,对于晚期≥G2肠道不良反应得出与之前不一致的结论,仍需进一步研究。本研究的不足之处是:①纳入文献数量有限,部分研究为非随机对照试验,对研究结果产生偏倚。②部分文献没有明确报道直肠V70结果,选用相近的直肠V60、直肠V75给与替代研究,同时放疗方案和剂量不一致,都对研究结果造成影响。③部分文献未获得完整数据。④随访时间不足和不一致,无法充分评估晚期肠道不良反应和晚期生活质量。
综上所述,前列腺癌患者放疗前植入水凝胶,成功率较高,并发症较少,有效分离前列腺与直肠,降低直肠剂量,减少早期和晚期G1肠道不良反应,提高患者晚期患者生活质量,但是由于纳入研究较少,随访时间不足和不一致,对于晚期肠道不良反应和晚期患者生活质量仍需大量随机对照试验进行证实。
利益冲突 无
作者贡献声明 杨烨负责采集数据和论文撰写;侯彦杰、李险峰负责总体文章修改;薛少军、刘焕茹负责查找文献
| [1] |
Viani GA, Stefano EJ, Afonso SL. Higher-than-conventional radiation doses in localized prostate cancer treatment: a meta-analysis of randomized, controlled trials[J]. Int J Radiat Oncol Biol Phys, 2009, 74(5): 1405-1418. DOI:10.1016/j.ijrobp.2008.10.091 |
| [2] |
Kang MH, Yu YD, Shin HS, et al. Difference in the rate of rectal complications following prostate brachytherapy based on the prostate-rectum distance and the prostate longitudinal length among early prostate cancer patients[J]. Korean J Urol, 2015, 56(9): 637-643. DOI:10.4111/kju.2015.56.9.637 |
| [3] |
Montoya J, Gross E, Karsh L. How I do it: Hydrogel spacer placement in men scheduled to undergo prostate radiotherapy[J]. Can J Urol, 2018, 25(2): 9288-9293. |
| [4] |
Hatiboglu G, Pinkawa M, Vallée JP, et al. Application technique: placement of a prostate-rectum spacer in men undergoing prostate radiation therapy[J]. BJU Int, 2012, 110(11PtB): E647-E652. DOI:10.1111/j.1464-410X.2012.11373.x |
| [5] |
Skolarus TA, Dunn RL, Sanda MG, et al. Minimally important difference for the Expanded Prostate Cancer Index Composite Short Form[J]. Urology, 2015, 85(1): 101-105. DOI:10.1016/j.urology.2014.08.044 |
| [6] |
Mariados N, Sylvester J, Shah D, et al. Hydrogel spacer prospective multicenter randomized controlled pivotal trial: dosimetric and clinical effects of perirectal spacer application in men undergoing prostate image guided intensity modulated radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2015, 92(5): 971-977. DOI:10.1016/j.ijrobp.2015.04.030 |
| [7] |
Wolf F, Gaisberger C, Ziegler I, et al. Comparison of two different rectal spacers in prostate cancer external beam radiotherapy in terms of rectal sparing and volume consistency[J]. Radiother Oncol, 2015, 116(2): 221-225. DOI:10.1016/j.radonc.2015.07.027 |
| [8] |
Whalley D, Hruby G, Alfieri F, et al. SpaceOAR hydrogel in dose-escalated prostate cancer radiotherapy: rectal dosimetry and late toxicity[J]. Clin Oncol(R Coll Radiol), 2016, 28(10): e148-e154. DOI:10.1016/j.clon.2016.05.005 |
| [9] |
Wu SY, Boreta L, Wu A, et al. Improved rectal dosimetry with the use of SpaceOAR during high-dose-rate brachytherapy[J]. Brachytherapy, 2018, 17(2): 259-264. DOI:10.1016/j.brachy.2017.10.014 |
| [10] |
Pinkawa M, Berneking V, König L, et al. Hydrogel injection reduces rectal toxicity after radiotherapy for localized prostate cancer[J]. Strahlenther Onkol, 2017, 193(1): 22-28. DOI:10.1007/s00066-016-1040-6 |
| [11] |
Taggar AS, Charas T, Cohen GN, et al. Placement of an absorbable rectal hydrogel spacer in patients undergoing low-dose-rate brachytherapy with palladium-103[J]. Brachytherapy, 2018, 17(2): 251-258. DOI:10.1016/j.brachy.2017.11.006 |
| [12] |
Chao M, Ow D, Ho H, et al. Improving rectal dosimetry for patients with intermediate and high-risk prostate cancer undergoing combined high-dose-rate brachytherapy and external beam radiotherapy with hydrogel space[J]. J Contemp Brachytherapy, 2019, 11(1): 8-13. DOI:10.5114/jcb.2019.82836 |
| [13] |
Kahn J, Dahman B, McLaughlin C, et al. Rectal spacing, prostate coverage, and periprocedural outcomes after hydrogel spacer injection during low-dose-rate brachytherapy implantation[J]. Brachytherapy, 2020, 19(2): 228-233. DOI:10.1016/j.brachy.2019.11.002 |
| [14] |
Te Velde BL, Westhuyzen J, Awad N, et al. Late toxicities of prostate cancer radiotherapy with and without hydrogel SpaceOAR insertion[J]. J Med Imaging Radiat Oncol, 2019, 63(6): 836-841. DOI:10.1111/1754-9485.12945 |
| [15] |
Seymour ZA, Hamstra DA, Daignault-Newton S, et al. Long-term follow-up after radiotherapy for prostate cancer with and without rectal hydrogel spacer: a pooled prospective evaluation of bowel-associated quality of life[J]. BJU Int, 2020, 126(3): 367-372. DOI:10.1111/bju.15097 |
| [16] |
Zelefsky MJ, Levin EJ, Hunt M, et al. Incidence of late rectal and urinary toxicities after three-dimensional conformal radiotherapy and intensity-modulated radiotherapy for localized prostate cancer[J]. Int J Radiat Oncol Biol Phys, 2008, 70(4): 1124-1129. DOI:10.1016/j.ijrobp.2007.11.044 |
| [17] |
Vavassori A, Riva G, Spoto R, et al. High precision radiotherapy including intensity-modulated radiation therapy and pulsed-dose-rate brachytherapy for cervical cancer: a retrospective monoinstitutional study[J]. J Contemp Brachytherapy, 2019, 11(6): 516-526. DOI:10.5114/jcb.2019.90478 |
| [18] |
Pinkawa M, Klotz J, Djukic V, et al. Learning curve in the application of a hydrogel spacer to protect the rectal wall during radiotherapy of localized prostate cancer[J]. Urology, 2013, 82(4): 963-968. DOI:10.1016/j.urology.2013.07.014 |
| [19] |
Vaggers S, Rai BP, Chedgy E, et al. Polyethylene glycol-based hydrogel rectal spacers for prostate brachytherapy: a systematic review with a focus on technique[J]. World J Urol, 2020, 38(8): 1-12. DOI:10.1007/s00345-020-03414-6 |
| [20] |
Michalski JM, Yan Y, Watkins-Bruner D, et al. Preliminary toxicity analysis of 3-dimensional conformal radiation therapy versus intensity modulated radiation therapy on the high-dose arm of the Radiation Therapy Oncology Group 0126 prostate cancer trial[J]. Int J Radiat Oncol Biol Phys, 2013, 87(5): 932-938. DOI:10.1016/j.ijrobp.2013.07.041 |
| [21] |
Huang EH, Pollack A, Levy L, et al. Late rectal toxicity: dose-volume effects of conformal radiotherapy for prostate cancer[J]. Int J Radiat Oncol Biol Phys, 2002, 54(5): 1314-1321. DOI:10.1016/s0360-3016(02)03742-2 |
| [22] |
Van Gellekom = MP, Moerland MA, Van Vulpen M, et al. Quality of life of patients after permanent prostate brachytherapy in relation to dosimetry[J]. Int J Radiat Oncol Biol Phys, 2005, 63(3): 772-780. DOI:10.1016/j.ijrobp.2005.03.046 |
| [23] |
Chargari C, Deutsch E, Blanchard P, et al. Brachytherapy: An overview for clinicians[J]. CA Cancer J Clin, 2019, 69(5): 386-401. DOI:10.3322/caac.21578 |
| [24] |
Pinkawa M, Corral NE, Caffaro M, et al. Application of a spacer gel to optimize three-dimensional conformal and intensity modulated radiotherapy for prostate cancer[J]. Radiother Oncol, 2011, 100(3): 436-441. DOI:10.1016/j.radonc.2011.09.005 |
| [25] |
Weber DC, Zilli T, Vallee JP, et al. Intensity modulated proton and photon therapy for early prostate cancer with or without transperineal injection of a polyethylen glycol spacer: a treatment planning comparison study[J]. Int J Radiat Oncol Biol Phys, 2012, 84(3): e311-e318. DOI:10.1016/j.ijrobp.2012.03.028 |
| [26] |
Miller LE, Efstathiou JA, Bhattacharyya SK, et al. Association of the placement of a perirectal hydrogel spacer with the clinical outcomes of men receiving radiotherapy for prostate cancer: a systematic review and meta-analysis[J]. JAMA Netw Open, 2020, 3(6): e208221. DOI:10.1001/jamanetworkopen.2020.8221 |
| [27] |
Odrazka K, Dolezel M, Vanasek J, et al. Time course of late rectal toxicity after radiation therapy for prostate cancer[J]. Prostate Cancer Prostatic Dis, 2010, 13(2): 138-143. DOI:10.1038/pcan.2009.56 |
| [28] |
Hamstra DA, Mariados N, Sylvester J, et al. Continued benefit to rectal separation for prostate radiation therapy: final results of a phase Ⅲ trial[J]. Int J Radiat Oncol Biol Phys, 2017, 97(5): 976-985. DOI:10.1016/j.ijrobp.2016.12.024 |
| [29] |
Karsh LI, Gross ET, Pieczonka CM, et al. Absorbable hydrogel spacer use in prostate radiotherapy: a comprehensive review of phase 3 clinical trial published data[J]. Urology, 2018, 115(5): 39-44. DOI:10.1016/j.urology.2017.11.016 |
 2021, Vol. 41
2021, Vol. 41


