2. 复旦大学附属中山医院放疗科 复旦大学附属中山医院肿瘤防治中心, 上海 200032
2. Department of Radiation Oncology, Cancer Center, Zhongshan Hospital, Fudan University, Shanghai 200032, China
肝癌是最常见的恶性肿瘤之一[1]。肝细胞癌患者出现淋巴结转移(LNM)的发生率低[2],一旦出现LNM的肝细胞肝癌(HCC),患者预后差。本研究前期报道了放疗可以明显延长肝细胞癌腹腔LNM患者的总体生存期。但是,HCC发生心膈角或膈上的LNM更少见,其他肿瘤出现心膈角或膈上LNM也鲜有报道[3-5],目前缺少肝细胞癌患者伴有心膈角或膈上LNM的临床特点和治疗方法,尤其是放疗效果仍未明确。本研究对影像学上表现为心膈角或膈上LNM的肝细胞癌患者进行分析,探讨HCC出现心膈角或膈上LNM的诊断和生存情况。
资料与方法1.研究对象:本研究回顾性选取了2010年1月至2020年8月在复旦大学附属中山医院治疗的56例经病理诊断或临床诊断考虑为心膈角或膈上LNM的HCC患者,占同期行放疗的HCC患者的2.4%。按患者是否行外照射分为2组,外照射组和非外照射组,每组28例。
2.患者临床资料:患者的中位年龄53岁,范围36~77岁,男52例,女4例。所有患者的卡氏功能状态评分标准(KPS)评分均>80。本研究所有患者均签署了知情同意书。按照接受或不接受外照射,56例患者分为两组,外照射组28例接受了心膈角或膈上LN的外照射治疗。非外照射组28例未接受外照射,入组患者的临床基线资料见表 1。
|
|
表 1 两组肝细胞肝癌患者临床基线资料 Table 1 Clinical baseline data of HCC patients in two groups |
3.临床诊断心膈角或膈上LNM的标准:①HCC患者肝内病灶侵犯肝包膜,判断是否有包膜侵犯时,若肝内病灶手术者,术后发现心膈角或膈上淋巴结(LN)肿大,则回顾术前的影像学资料或手术记录,是否有肝内肿瘤出现包膜侵犯。②影像学(CT或MRI)存在心膈角或膈上LN肿大。③动态随访至少2个时段的影像学检查显示肿大的LN呈增大趋势,LN最大横断面上短径≥1 cm。
心膈角或膈上LNM典型分布。右侧膈上LN;右侧正中间心膈角LN:LN经过心脏和肝脏交角且垂直于水平面的直线;右侧心包膜心膈角LN:LN和心包膜紧邻;右侧后方心膈角LN;左侧前方心膈角LN;左侧后方心膈角LN。靠前的LN以心尖分左右,靠后的LN以主动脉左缘分左右。
4.诊断情况:①肝内病灶的诊断[6-7]:56例患者有35例进行了病理诊断(穿刺活检或手术治疗的标本),符合临床诊断标准的21例,其中甲胎蛋白(AFP)≥400 μg/L且有一种影像学检查确诊的18例,AFP < 400 μg/L且有两种影像学检查确诊的3例。②心膈角或膈上LNM的诊断:1例病理诊断;55例符合上述心膈角或膈上LNM的临床诊断标准。
5.LNM治疗剂量:外照射组患者行肝内病灶和心膈角或膈上LNM同时行外照射的有20例(71.4%),计划靶区(PTV)的剂量中位数为54 Gy(42~68 Gy),1.84~6 Gy/d,5 d/周。常规分割13例,非常规分割15例[生物等效剂量(BED10)58.5~96.0 Gy],非常规分割中12例靶区包括肝内肿瘤[8-9]。
6.放疗疗效和不良反应:根据放射治疗协作组(RTOG)标准进行不良反应评估[10-11]。所有患者在行外照射期间每周和外照射后3个月内进行急性不良反应的评价,包括血液学检查和增强CT或增强磁共振(MRI)。外照射3个月后至1年进行晚期不良反应的评价,期间每3个月做1次复查。LN的缓解率评价根据实体瘤的疗效评价标准(RECIST)评分1.1版[12],需要2名放疗科医生读片,并和放疗前的片子进行比较。心膈角或膈上LN的完全缓解为根据影像学检查LN完全消失。部分缓解定义为LN短径较治疗前减少≥30%。进展定义为LN长径或短径较治疗最佳效果时增大≥20%。稳定为LN反应在部分缓解和进展之间。AFP下降指数值< 20 μg/L或减少≥10%,AFP升高指数值上升≥10%。记录两组患者行外照射前与外照射后3个月的AFP。
7.统计学处理:所有数据使用SPSS 26.0统计软件分析。采用χ2检验或Fisher′s检验比较两组患者特征、LN缓解率、局部控制率,采用Kaplan-Meier法、Cox回归模型进行生存分析,P < 0.05为差异有统计学意义。
结果1.出现心膈角或膈上LNM时间:结果显示,患者从确诊肝癌到诊断心膈角或膈上LNM的中位时间为17.1个月。
2.LNM缓解情况:外照射组中完全缓解9例(32.14%),部分缓解9例(32.14%)。1年局部控制率,外照射组和非外照射组分别为37.0%和10.7%,差异有统计学意义(χ2=5.28,P < 0.05)。两组2年局部控制率差异无统计学意义(P>0.05)。
3.生存分析:截至2020年8月31日,外照射组2例存活,非外照射组1例存活。外照射组和非外照射组的1年和2年生存率分别为66.9%、25.0%和32.4%、4.8%,两组比较差异均有统计学意义(χ2=8.74、4.77,P < 0.05)。确诊LNM后中位随访时间为9.4个月(1.1~84个月),外照射组和非外照射组的中位生存分别为16.1个月(95%CI 9.00~23.21,RR=3.63)和6.9个月(95%CI 4.63~8.77,RR=1.06),两组比较差异有统计学意义(χ2=15.53,P < 0.05),见图 1。发现LN后中位随访时间15.8个月(1.3~96.8个月),外照射组和非外照射组的中位生存分别为21.9个月(95%CI 18.64~25.76,RR=1.82)和10.8个月(95%CI 5.73~15.07,RR=2.38),两组比较差异有统计学意义(χ2=6.41,P < 0.05),见图 1。
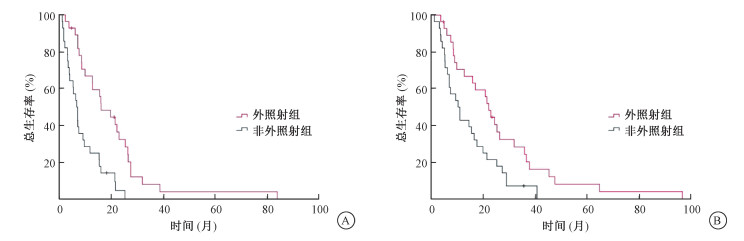
|
图 1 外照射组和非外照射组总生存率A. 确诊LNM后生存曲线;B.发现LN后生存曲线 Figure 1 Overall survival rate of EBRT group and non-EBRT group since LNM was diagnosed(A) and since LN was found(B) |
4.预后因素:单因素分析显示,脉管侵犯、肝内肿瘤多发、肝内肿瘤直径>5 cm、有胸部LNM、未行外照射、AFP≥400 μg/L是不良预后的影响因素。多因素分析显示,肝内肿瘤多发、肝内肿瘤直径>5 cm、未行外照射、AFP≥400 μg/L是不良预后的影响因素。预后与年龄、性别、HBsAg、肝功能、肝外转移、腹部LNM、LN数量无关。
5.AFP情况:确诊心膈角或膈上LNM后,3个月内AFP较外照射前升高,外照射组4例(14.3%),非外照射组13例(46.4%),两组比较差异有统计学意义(χ2=6.84,P < 0.05)。3个月内AFP较外照射前下降,外照射组5例(17.9%),非外照射组7例(25.0%),两组比较差异无统计学意义(P>0.05)。
6.不良反应:外照射组主要不良反应为胃肠道反应1级9例(32.1%)、2级3例(10.7%)、3级4例(14.3%),肝脏不良反应3级1例(3.6%),骨髓抑制1级3例(10.7%)、2级5例(17.9%)。
7.死亡原因:截至随访终点,外照射组共死亡26例,非外照射组共死亡27例。其中,外照射组和非外照射组死于肝内肿瘤未控制、腹腔淋巴结转移、肝外转移、非肿瘤相关原因分别为19例(73.1%)和25例(92.6%)、1例(3.8%)和1例(3.7%)、4例(15.4%)和1例(3.7%)、2例(7.7%)和0例(0.0%),差异均无统计学意义(P>0.05)。
讨论心膈角或膈上LNM不是肝细胞肝癌常见的转移部位。因此,目前缺乏心膈角或膈上LNM诊断和治疗的临床资料。外照射对有腹腔LNM的HCC患者是有效的治疗[13],但外照射对心膈角或膈上LNM患者是否有生存获益,目前不清。
心膈角或膈上LN周围无重要器官不会致命,本研究外照射组在总生存比非外照射组有延长,但无法区分肝内病灶还是LNM行外照射令患者生存获益。总体来说行外照射是获益的,在肝内病灶行外照射时,应尽可能把LN包括在放射野内。两组在肝内病灶导致死亡和腹腔淋巴结导致死亡差异无统计学意义。有研究认为肝内病灶控制不佳是不良预后因素,外照射提高肿瘤控制率,降低死亡率[14]。
本研究显示,AFP≥400 μg/L提示预后不佳,有研究认为AFP通过结合AFP受体(AFPR)激活PI3K/AKT等多种癌症相关基因或导致Ca2+内流后促进DNA合成,促进癌细胞增殖[15-16]。外照射组在3个月内控制AFP的能力比非外照射组好,所以外照射在短期内可延长生存。
本研究确定心膈角或膈上LNM的临床诊断标准,但尚需获得认可,特别是必须肿瘤侵犯肝包膜,这是因为心膈角或膈上LNM,都是通过肝包膜上的淋巴管而来。
本研究存在局限性:首先,作为回顾性研究,收集的资料有缺漏;其次,目前无公认的心膈角或膈上LNM的诊断标准;再者,样本量小,无法做前瞻性比较。
综上所述,心膈角或膈上LNM的HCC患者行外照射能延长总生存、提高LNM局部控制率。伴有肝内肿瘤多发、肝内肿瘤>5 cm、AFP≥400 μg/L、未行外照射者预后差。
利益冲突 无
作者贡献声明 叶婷负责收集资料、整理数据、统计分析、撰写及修改论文;曾昭冲负责研究设计和修改论文;杜世锁、孙菁、吴志峰、陈一兴、杨平、胡永、赵倩倩、张建英负责提供数据、统计分析和修改论文
| [1] |
安澜, 曾红梅, 郑荣寿, 等. 2015年中国肝癌流行情况分析[J]. 中华肿瘤杂志, 2019, 41(10): 721-729. DOI: 10.3760/cma.j.issn.0253-3766.2019.10.001.AnL, Zeng HM, Zheng RS, et al.Liver cancer epidemiology in China, 2015[J].Chin J Oncol, 2019, 41(10): 721-729.DOI: 10.3760/cma.j.issn.0253-3766.2019.10.001. |
| [2] |
Rim CH, Kim CY, Yang DS, et al. The role of external beam radiotherapy for hepatocellular carcinoma patients with lymph node metastasis: a meta-analysis of observational studies[J]. Cancer Manag Res, 2018, 10: 3305-3315. DOI:10.2147/CMAR.S175703 |
| [3] |
Barat M, Soyer P, Eveno C, et al. The presence of cardiophrenic angle lymph nodes is not an indicator of peritoneal carcinomatosis from colorectal cancer on MDCT: Results of a case-control study[J]. Eur J Surg Oncol, 2016, 42(2): 266-272. DOI:10.1016/j.ejso.2015.11.011 |
| [4] |
Eguchi T, Takasuna K, Nakayama A, et al. Cardiophrenic angle lymph node metastasis from a fallopian primary tumor[J]. Asian Cardiovasc Thorac Ann, 2012, 20(1): 74-76. DOI:10.1177/0218492311422756 |
| [5] |
St Laurent JD, Gockley AA, Cathcart AM, et al. Serous borderline tumor of the ovary with isolated cardiophrenic lymph node spread at diagnosis[J]. Gynecol Oncol Rep, 2020, 33: 100586. DOI:10.1016/j.gore.2020.100586 |
| [6] |
National Comprehensive Cancer Network.NCCN clinical practice guidelines in oncology: hepatobiliary cancers(Version 5.2020)[OL].National Comprehensive Cancer Network: NCCN, 2020[2020-08-04].http://guide.medlive.cn/guideline/21343.
|
| [7] |
国家卫生健康委员会医政医管局. 原发性肝癌诊疗规范(2019年版)[J]. 中华肝脏病杂志, 2020, 28(2): 112-128. Department of Medical Administration, National Health Commission of the People's Republic of China. Guidelines for diagnosis and treatment of primary liver cancer in China (2019 edition)[J]. Chin J Hepatol, 2020, 28(2): 112-128. DOI:10.3760/cma.j.issn.1007-3418.2020.02.004 |
| [8] |
Zhang HG, Chen YX, Hu Y, et al. Image-guided intensity-modulated radiotherapy improves short-term survival for abdominal lymph node metastases from hepatocellular carcinoma[J]. Ann Palliat Med, 2019, 8(5): 717-727. DOI:10.21037/apm.2019.11.17 |
| [9] |
Zeng ZC, Tang ZY, Fan J, et al. Consideration of role of radiotherapy for lymph node metastases in patients with HCC: retrospective analysis for prognostic factors from 125 patients[J]. Int J Radiat Oncol Biol Phys, 2005, 63(4): 1067-1076. DOI:10.1016/j.ijrobp.2005.03.058 |
| [10] |
Cox JD, Stetz J, Pajak TF, et al. Toxicity criteria of the Radiation Therapy Oncology Group(RTOG) and the European Organization for Research and Treatment of Cancer(EORTC)[J]. Int J Radiat Oncol Biol Phys, 1995, 31(5): 1341-1346. DOI:10.1016/0360-3016(95)00060-C |
| [11] |
Chen YX, Zeng ZC, Tang ZY, et al. Determining the role of external beam radiotherapy in unresectable intrahepatic cholangiocarcinoma: a retrospective analysis of 84 patients[J]. BMC Cancer, 2010, 10: 492. DOI:10.1186/1471-2407-10-492 |
| [12] |
Schwartz LH, Bogaerts J, Ford R. Evaluation of lymph nodes with RECIST 1.1[J]. Eur J Cancer, 2009, 45(2): 261-267. DOI:10.1016/j.ejca.2008.10.028 |
| [13] |
Chen YX, Zeng ZC, Fan J, et al. Defining prognostic factors of survival after external beam radiotherapy treatment of hepatocellular carcinoma with lymph node metastases[J]. Clin Transl Oncol, 2013, 15(9): 732-740. DOI:10.1007/s12094-012-0997-6 |
| [14] |
Zhang L, Yan L, Niu H, et al. A nomogram to predict prognosis of patients with unresected hepatocellular carcinoma undergoing radiotherapy: a population-based study[J]. J Cancer, 2019, 10(19): 4564-4573. DOI:10.7150/jca.30365 |
| [15] |
Chen W, Peng JJ, Ye JN, et al. Aberrant AFP expression characterizes a subset of hepatocellular carcinoma with distinct gene expression patterns and inferior prognosis[J]. J Cancer, 2020, 11(2): 403-413. DOI:10.7150/jca.31435 |
| [16] |
Li MS, Li PF, He SP, et al. The promoting molecular mechanism of alpha-fetoprotein on the growth of human hepatoma Bel7402 cell line[J]. World J Gastroenterol, 2002, 8(3): 469-475. DOI:10.3748/wjg.v8.i3.469 |
 2021, Vol. 41
2021, Vol. 41


