Cx43是缝隙连接蛋白家族的成员,可通过介导细胞间信号通讯,调控血管内皮细胞损伤。Cx43的功能与其表达水平及分布有密切联系[1],其表达及分布的变化发生在多种病理过程中[2-5]。Cx43蛋白的合成、组装、运输、降解与其磷酸化水平相关[6-7]。那么,在X射线照射引起的HUVEC细胞损伤中,Cx43的表达和分布是否会发生变化;若有变化,是通过哪条磷酸化通路产生的,值得探讨。对此,本研究检测了X射线照射HUVEC细胞后Cx43表达、分布以及磷酸化水平的变化。
血管内皮细胞生物力学性质(如刚性)的改变对受照组织病理进程具有重要意义[8]。血管内皮细胞的刚性变化会诱发细胞凋亡,促进血栓形成[9]。在辐射所致的出血综合征中,由于血管坚韧性降低,致使血液成分漏出血管外,而前期血管刚性的变化是决定性因素[10]。电离辐射诱导下血管内皮细胞刚性如何变化,目前还鲜见报道。Cx43蛋白是细胞间的连接蛋白,并与多种骨架蛋白相连或相互作用(如ZO-1、β-肌动蛋白等),在细胞刚性和形态维持中起重要作用[11-12],但其对血管内皮细胞刚性的影响目前仍不清楚。因此,本研究对受照HUVEC细胞的刚性变化进行检测,并通过干预Cx43的表达检测其在受照HUVEC细胞刚性变化中的作用。
材料与方法1. 主要试剂和仪器:胎牛血清(FBS)、RPMI 1640培养基均购自美国GIBCO公司,兔抗人Cx43抗体,β-tublin抗体购自美国Cell Signaling公司,Cx43 Ser279/282抗体(sc-12900)、Cx43 Ser368抗体(sc-25165)和Cx43 Tyr265抗体(sc-17220)均购自美国Santa Cruz公司,Western blot蛋白提取裂解液购自美国Pierce公司,发光检测试剂盒购自美国Millipore公司,蛋白定量试剂盒、硝酸纤维素膜均购自北京普利莱公司,牛血清白蛋白购自美国Amresco公司,Cx43过表达质粒(pCMV-Cx43)及空载质粒(pCMV5)均购自北京Biovector NTCC公司,过表达转染试剂LipofectamineTM 3000购自美国Invitrogen公司,质粒提取试剂盒购自德国QIAGEN公司,原子力显微镜探针CP-CONT-SiO购自德国sQube公司,Alexa Fluor 488二抗为美国Invitrogen公司产品,含DAPI的Mounting Medium(封片剂)购自美国Sigma公司,发光检测成像系统ChemiDoc XRC+为美国Bio-rad公司产品,原子力显微镜(型号AFM5500)购自美国安捷伦公司,激光共聚焦显微镜为Leica SP5检测系统。
2. 细胞培养:实验采用正常人脐静脉内皮细胞(HUVEC),由本实验室保存。细胞在含10% FBS的RPMI 1640培养基,37℃,5% CO2、饱和湿度下培养。
3. 细胞照射条件:细胞实验采用火箭军总医院医用直线加速器Precise(瑞典Elekta公司),剂量率为5 Gy/min,源靶距100 cm,吸收剂量为2.5、5、10、20 Gy,单次照射。
4. 质粒提取与转染
(1) 质粒的扩增:从含有抗生素的LB固体培养平板上挑取一个单菌落,接种到含有抗生素的LB液体培养基中生长。将液体培养基置于37℃、220 r/min的摇床中振荡8 h。之后将含有pCMV5或pCMV-Cx43质粒的感受态大肠杆菌10 μl到6 ml的LB培养基中,220 r/min,37℃过夜摇菌,约15 h。
(2) 质粒提取:按照说明书进行操作,简述如下:将菌液3 ml在4℃、6 000×g离心15 min,加入250 μl Buffer P1充分混匀(提前将RNase A加入Buffer P1),加入250 μl Buffer P2,轻柔颠倒4~6次混匀,室温孵育5 min。加入350 μl Buffer N3,立刻轻柔颠倒4~6次彻底混匀,冰上孵育20 min,以4℃、10 000 r/min离心10 min,取含有质粒的上清。加入柱子后离心,用70 μl pH 8.0的灭菌去离子水洗脱两次,在酶标仪上测定质粒的纯度以及浓度后备用。
5. 质粒转染:待细胞密度达到80%~90%时采用LipofectamineTM 3000对细胞进行转染,根据说明书进行操作:以6孔板为例,采用LipofectamineTM 3000对提取的质粒进行转染,细胞约为2×105个,首先用opti-MEM 125 μl稀释LipofectamineTM 3000 3.75 μl或7.5 μl,用125 μl的opti-MEM稀释DNA(5 μg)制备DNA预混液,然后加入P 3000充分混匀;按照1 ∶1的比例将稀释的LipofectamineTM 3000的液体与稀释的DNA混匀,室温孵育5 min,将DNA-脂质体复合物250 μl加入到细胞中,至孵箱中,检测24~72 h的过表达效率。
6. Western blot检测蛋白表达:提取细胞全蛋白并定量,与5×蛋白上样缓冲液混匀,置于沸水中加热5 min后,迅速放入冰中冷却。取各组等量蛋白行聚丙烯酰氨凝胶(SDS-PAGE)电泳,并采用硝酸纤维素膜转膜,5% BSA封闭后分别用Cx43,Cx43 Ser368,β-tublin等一抗孵育(稀释浓度1∶1 000),4℃过夜,二抗孵育(稀释浓度1 ∶2 000),室温1 h,滴加发光液,用发光检测成像系统拍摄条带图像检测蛋白表达。
7. 细胞免疫荧光检测蛋白分布:细胞用4%多聚甲醛-PBS固定10 min,磷酸盐缓冲液(PBS)洗,然后用1%的Triton X-100室温孵育8 min进行打孔,后用PBS洗,用1% SDS进行修复5 min,后用PBS洗。然后用含5% BSA-PBS室温孵育30 min进行封闭,后加入一抗(1 ∶100)4℃过夜。第二天PBS洗3次后用1 ∶500稀释的Alexa Fluor 488二抗进行标记,在室温孵育1 h,后用PBS洗3次,最后采用含DAPI的封片剂进行封片,用激光共聚焦显微镜40倍油镜,Zoom=2,NA=1.4,观测染色情况。
8. 原子力显微镜检测细胞刚性:将铺有HUVEC细胞的培养皿放置于原子力显微镜(AFM)样品盘上,在培养皿中加入3 ml PBS缓冲液,通过显微镜定位贴壁良好的HUVEC细胞。每个细胞选定测量区域后,用尖端粘有10 μm聚苯乙烯的探针测定力曲线,进针时间设为2 s。每个细胞重复采集10条力曲线,共取13个细胞。根据探针力常数、小球半径和探针灵敏度计算细胞在力曲线上某一压入深度时所受到的力,由Hertz′s模型计算得到杨氏模量即细胞刚性:
| $ F = \frac{4}{3} \cdot \frac{E}{{1 - {v^2}}}{R^{\frac{1}{2}}}{\delta ^{\frac{3}{2}}} $ | (1) |
式中,F为探针作用力;E为细胞的杨氏模量;δ为压入深度;R为针尖的曲率半径;ν为泊松比,一般认为细胞与不可压缩液体类似,ν=0.5。采用自行编写的软件计算出每一条力曲线在特定压入深度下对应的杨氏模量。
9. 统计学处理:所有实验重复3次,取均值。实验数据符合正态分布, 采用x±s表示,Graph pad统计软件对数据进行分析及作图。两组数据比较采用独立样本t检验,P<0.05为差异有统计学意义。Western blot图片灰度分析采用Image J图像处理软件进行分析。
结果1. X射线对Cx43表达的影响:为明确Cx43在X射线引起的血管内皮细胞损伤时的表达变化,使用Western blot方法检测HUVEC细胞受到10 Gy X射线照射后,Cx43表达水平随时间的变化(0、6、12、24和48 h)示于图 1,随照射剂量的变化(0、2.5、5、10和20 Gy)示于图 2。由图 1可见,HUVEC细胞在10 Gy照射后6~48 h表达量降低,差异具有统计学意义(t=3.262、3.708、3.686、6.825,P<0.05);由图 2可见,与0 Gy组相比,在受到不同剂量(2.5、5、10和20 Gy)照射后24 h Cx43表达水平的降低与受照剂量呈现剂量依赖性,差异具有统计学意义(t=3.034、10.720、13.130、13.650,P<0.05)。
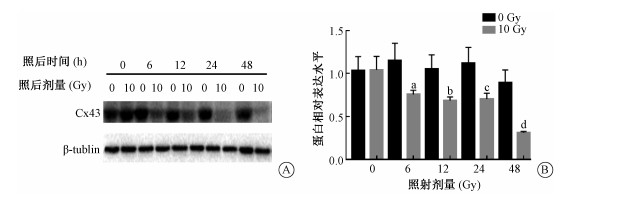
|
注:a 与0 Gy照后6 h组相比,t=3.262,P<0.05;b 与0 Gy照后12 h组相比,t=3.708,P<0.05;c 与0 Gy照后24 h组相比,t=3.686,P<0.05;d 与0 Gy照后48 h组相比,t=6.825,P<0.05 图 1 X射线照射后Cx43蛋白表达随时间的变化A. 受照后不同时间Cx43表达水平;B. 蛋白相对表达水平 Figure 1 Time response of the expression of Cx43 after X-rays irradiation A. The expression of Cx43 in HUVEC at different time after irradiation; B. Statistical chart of the relative expression level of Cx43 protein |
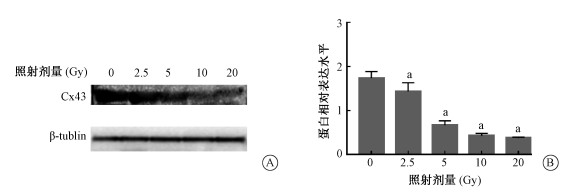
|
注:a 与0 Gy照后组相比,t=3.034、10.720、13.130、13.650,P<0.05 图 2 Cx43蛋白表达随照射剂量的变化A.不同照射剂量Cx43表达水平;B. 蛋白相对表达水平 Figure 2 Dose response of the expression of Cx43 with different dose of X-rays A. The expression of Cx43 in HUVEC with different irradiation doses; B. Statistical chart of the relative expression level of Cx43 protein |
2.X射线对Cx43蛋白分布的影响:采用免疫荧光方法检测HUVEC细胞受到5、10和20 Gy照射后24 h Cx43分布的变化,示于图 3。细胞在未受到照射时(0 Gy组)Cx43表达明显高于受照射组(5、10和20 Gy),差异具有统计学意义(t=5.401、7.155、7.918,P<0.05);0 Gy组Cx43大部分分布在两相邻细胞膜表面,少量分布在核周及细胞核内,受到5 Gy照射后,Cx43分布在核周及入核比例略有上升,而10和20 Gy照射后,Cx43大多数都分布在细胞核周或者入核,与0 Gy组相比,差异具有统计学意义(t=15.71、12.78,P<0.05),提示Cx43的分布受到X射线照射的影响,且随着照射剂量的增加,Cx43分布在核周和入核的数量增加。
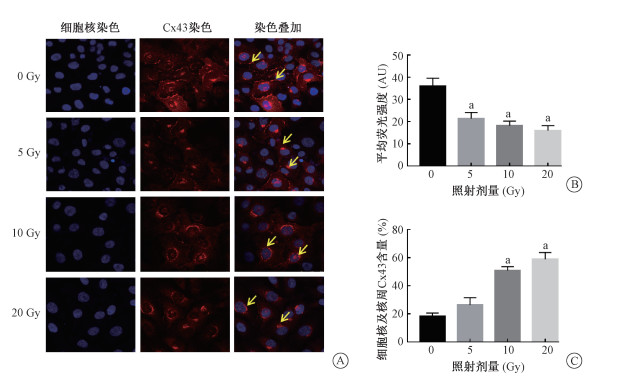
|
注:a 与0 Gy组相比,t=5.401、7.155、7.918、15.71、12.78,P<0.05;黄色箭头表示Cx43转位情况 图 3 不同剂量X射线照射对Cx43分布的影响×40 A. Cx43蛋白分布;B. 平均荧光强度;C. 在细胞核及核周的细胞占总细胞的百分比 Figure 3 Distribution of Cx43 in HUVEC with different irradiation doses ×40 A. Cellular distribution of Cx43 protein; B. Mean fluorescence density of protein; C. The percentage of Cx43 distributed in the nucleus and perinuclear cells in the total cells |
3. X射线对Cx43磷酸化的影响:Cx43的表达和分布受其C端磷酸化水平的影响,筛选出3个与Cx43的降解以及功能改变有重要关系的磷酸化位点Ser279/282、Ser368、Tyr265进行实验。通过Western blot方法检测细胞内Cx43以上3个磷酸化位点的磷酸化水平,如图 4所示,在受照后48 h Ser279/282以及Tyr265位点5 Gy组与对照组相比表达上升,而在10 Gy组中表达下降。Ser368位点在受照后24~48 h表达水平与对照组相比明显增加,且随剂量的增加而增加,有明显的剂量依赖性。
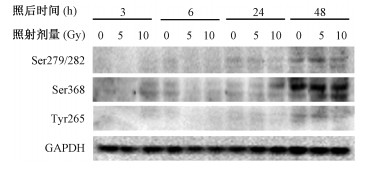
|
图 4 不同剂量照射下Cx43磷酸化水平变化 Figure 4 Phosphorylation levels of Cx43 in HUVEC with different irradiation doses |
4. Cx43对受照HUVEC细胞刚性的影响:结果示于图 5。采用Western blot对24~72 h各组细胞中Cx43的表达水平进行检测。结果显示,Cx43在检测范围内与对照组相比均能高表达,且7.5 μl LipofectamineTM 3000转染效率更好,据此,采用7.5 μl LipofectamineTM 3000、转染24 h的条件进行后续实验。
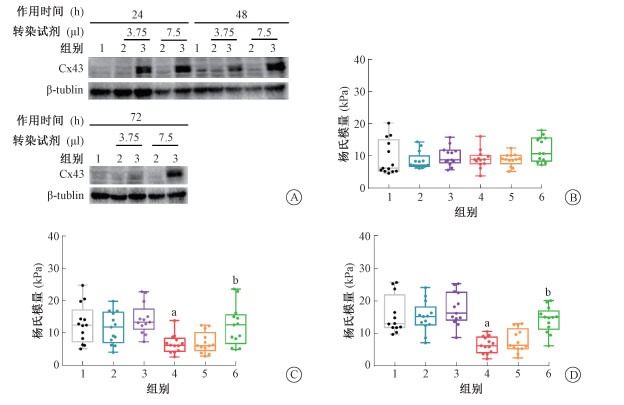
|
注:1. 空白对照组(control);2. 空载体组(pCMV5);3. Cx43过表达组(pCMV5-Cx43);4. 10 Gy照射对照组(IR);5. 10 Gy照射空载体组(IR-pCMV5);6. 10 Gy照射Cx43过表达组(IR-pCMV5-Cx43)。a 与空白对照组相比,t=3.362、5.122,P<0.05;b 与照射对照组相比,t=2.674、4.398,P<0.05 图 5 Cx43对受照HUVEC细胞刚性变化的影响A. Cx43过表达的鉴定;B~D. 各组细胞分别在探针压入50、100和200 nm时的细胞刚性变化 Figure 5 Influence of Cx43 on the stiffness of HUVEC cells irradiated by X-rays A. Identification of Cx43 overexpression; B-D. Stiffness of HUVEC in each group at 50, 100 and 200 nm indentation |
如图 5所示,压入50~200 nm时,无照射的过表达Cx43组(pCMV5-Cx43)与空载体组(pCMV5)相比,细胞杨氏模量略有增高,但差异不具有统计学意义;压入100和200 nm时,与空白对照组相比,照射对照组(IR)细胞杨氏模量明显降低,差异有统计学意义(t=3.362、5.122,P<0.05),说明受照细胞刚性变小,更容易发生形变。压入100和200 nm时,受照过表达Cx43组(IR-pCMV-Cx43)与受照空载体组(IR-pCMV5)相比,细胞杨氏模量增高,差异有统计学意义(t=2.674、4.398,P<0.05),说明Cx43的表达对受照细胞有恢复刚性的作用。
讨论Cx43蛋白是组成缝隙连接最重要的蛋白,在机体内分布广泛。新合成的Cx43结合到闰盘(由几百个缝隙连接蛋白组成)的外周,衰老且丧失功能的Cx43从闰盘的中间被内吞分解[13]。Cx43蛋白的快速周转,使细胞能迅速改变信号通路和与其相邻细胞间的通信,这在细胞损伤过程中尤为重要,如缺血、创伤、癌变或各种环境刺激[14]。因此,在损伤细胞中常常发生Cx43表达和分布的改变[15-17]。
对受照后Cx43表达变化的结果,报道不一致。在低剂量的γ射线作用的肿瘤细胞(如U87、BMG-1和HeLa)中Cx43表达增高[18]或者降低[19]均有报道;研究表明,单次亚致死剂量照射的心肌细胞中,Cx43表达水平增高[20];α射线照射后的HepG2细胞中检测到Cx43表达没有变化[21]。本研究中,在X射线照射后6~48 h,Cx43表达水平明显降低,并且呈现剂量依赖性地降低趋势,说明X射线可能通过降低Cx43表达调控HUVEC细胞功能。在电离辐射诱导Cx43表达水平改变的研究中,不同实验室因使用不同辐射和细胞类型导致研究得出不同的结果[22-24],这与辐射源、辐射剂量、细胞类型、细胞敏感性或损伤类型的多样性有关[25]。
许多研究表明,Cx43的分布变化与其功能密切相关。如在缺血再灌注损伤的大鼠模型中,心脏闰盘处Cx43的分布不规则,低表达miRNA-1阻止Cx43的分布变化,使Cx43顺利插入闰盘发挥作用,从而对大鼠心脏起到保护作用[26];另一项研究中,激素使Cx43分布发生变化,导致细胞凋亡增强、增殖减少[27];HIV感染导致的心脏疾病中,Cx43出现从细胞端分布变为侧分布,而异常Cx43定位的组织也显示钙超载、肌纤维膜萎缩和胶原积聚,这可能是HIV感染者心血管疾病高发病率的原因[28];研究报道多沙唑嗪(Doxazosin)抑制Cx43蛋白的不均一性分布,从而降低慢性炎症增加和心房纤颤发生率[29]。以上研究表明,在多种疾病模型中,Cx43的分布均发生了变化,而这种变化进一步影响Cx43组成通道的传导性质以及相关的下游钙信号、凋亡等信号通路变化,从而在细胞的损伤中发挥重要作用。本研究发现,在X射线照射后的HUVEC细胞中,Cx43从细胞间隙分布变化到细胞质、核周和入核的分布,提示受照后的HUVEC细胞中Cx43在功能上发生了变化。
对Cx43蛋白表达水平以及分布的调控主要是通过不同的激酶系统的激活完成的。Cx43的C端被证实有19个丝氨酸位点和2个酪氨酸位点可以被不同的激酶系统激活[30-31]。Cx43的磷酸化可在短时间内完成,而不同刺激物又可通过激活不同的磷酸化位点和相应通路,促使通道关闭和内化[32-33]。其中Ser279/282位点的作用是引起Cx43降解和通透性降低,这一磷酸化位点主要受到MAPK通路调控;Ser368位点的作用是减少Cx43聚集形成缝隙连接通道以及半通道,促进Cx43解聚/降解,降低缝隙连接传导,这一磷酸化位点主要受到PKC通路调控[34];Tyr265位点的作用是降低缝隙连接通道/半通道开放频率,促进降解,这一磷酸化位点主要受到V-Src通路调控。本研究中,Cx43降解的指示物Ser368位点的磷酸化水平显著增加,说明受照细胞中Cx43表达量的降低和分布的变化可能与PKC通路对Ser368位点磷酸化水平的调控有关。
细胞对力学刺激的不同响应决定着组织病理过程的发展[8]。一项研究皮肤辐射损伤小鼠模型的报道显示,受照后真皮层细胞弹性和刚性降低,导致皮肤增厚、纤维化和持续性脱发[35];动脉刚性的变化会影响循环系统中T细胞的表达和分泌[36]。另一项研究显示,动脉的刚性变化与心室收缩和舒张功能障碍有关[37]。以上研究均说明,细胞的刚性变化与组织或机体的损伤密切相关。本研究中,采用探针压入不同深度来模拟细胞受到不同压力作用时的变化,发现在压入100和200 nm时,受照射的HUVEC细胞刚性降低;使受照细胞内Cx43过表达后,细胞的刚性上升,说明Cx43具有维持细胞正常形态和刚性的作用。张宝平[38]发现,放疗后肝癌细胞较正常细胞刚性变小,而这种细胞力学性质的改变与癌细胞凋亡信号通路的激活密切相关。本课题组前期研究发现,Cx43有抑制受照HUVEC细胞凋亡的作用[39]。这可能与Cx43提高受照细胞刚性,从而抑制凋亡通路活化有关。
综上所述,X射线照射可导致HUVEC细胞内Cx43的Ser368位点磷酸化,促进Cx43降解和分布变化。此外,X射线照射使HUVEC细胞刚性降低,而提高Cx43的表达水平能促进受照细胞刚性的恢复。本研究为放射性人血管内皮细胞损伤的防护提供了潜在的作用靶点。
利益冲突 无
志谢 本研究接受卫生行业科研专项(201002009)资助,并感谢国家纳米中心刘景博士、敖卓工程师在原子力显微镜技术方面的指导和帮助
作者贡献声明 李辰负责实验操作、数据分析和论文撰写;田梅、苟巧指导论文修改;齐雪松指导实验;苏旭指导整体实验设计
| [1] |
Michela P, Velia V, Aldo P, et al. Role of connexin 43 in cardiovascular diseases[J]. Eur J Pharmacol, 2015, 768: 71-76. DOI:10.1016/j.ejphar.2015.10.030 |
| [2] |
Ivanova E, Kovacs-Oller T, Sagdullaev BT. Vascular pericyte impairment and connexin43 gap junction deficit contribute to vasomotor decline in diabetic retinopathy[J]. J Neurosci, 2017, 37(32): 7580-7594. DOI:10.1523/JNEUROSCI.0187-17.2017 |
| [3] |
Li L, Liu H, Xu C, et al. VEGF promotes endothelial progenitor cell differentiation and vascular repair through connexin 43[J]. Stem Cell Res Ther, 2017, 8(1): 237. DOI:10.1186/s13287-017-0684-1 |
| [4] |
Htet M, Nally JE, Shaw A, et al. Connexin 43 plays a role in pulmonary vascular reactivity in mice[J]. Int J Mol Sci, 2018, 19(7): 1891. DOI:10.3390/ijms19071891 |
| [5] |
Boulaksil M, Winckels SK, Engelen MA, et al. Heterogeneous Connexin43 distribution in heart failure is associated with dispersed conduction and enhanced susceptibility to ventricular arrhythmias[J]. Eur J Heart Fail, 2010, 12(9): 913-921. DOI:10.1093/eurjhf/hfq092 |
| [6] |
Solan JL, Lampe PD. Spatio-temporal regulation of connexin43 phosphorylation and gap junction dynamics[J]. Biochim Biophys Acta Biomembr, 2018, 1860(1): 83-90. DOI:10.1016/j.bbamem.2017.04.008 |
| [7] |
Solan JL, Lampe PD. Specific Cx43 phosphorylation events regulate gap junction turnover in vivo[J]. FEBS Lett, 2014, 588(8): 1423-1429. DOI:10.1016/j.febslet.2014.01.049 |
| [8] |
吕守芹, 杨帆, 龙勉. 细胞-分子生物力学研究进展[J]. 医用生物力学, 2009, 24(2): 79-84. Lyu SQ, Yang F, Long M. Advances in study on cellular and molecular biomechanics[J]. Med Biomech, 2009, 24(2): 79-84. |
| [9] |
Kaiser D, Freyberg MA, Schrimpf G, et al. Apoptosis induced by lack of hemodynamic forces is a general endothelial feature even occuring in immortalized cell lines[J]. Endothelium, 1999, 6(4): 325-334. DOI:10.3109/10623329909078499 |
| [10] |
刘树铮, 苏旭, 李修义, 等. 医学放射生物学[M]. 北京: 原子能出版社, 2010. Liu SZ, Su X, Li XY, et al. Medical radiobiology[M]. Beijing: Atomic Energy Press, 2010. |
| [11] |
Chen CH, Mayo JN, Gourdie RG, et al. The connexin 43/ZO-1 complex regulates cerebral endothelial F-actin architecture and migration[J]. Am J Physiol Cell Physiol, 2015, 309(9): C600-607. DOI:10.1152/ajpcell.00155.2015 |
| [12] |
Sorgen PL, Trease AJ, Spagnol G, et al. Protein-protein interactions with Connexin 43:Regulation and function[J]. Int J Mol Sci, 2018, 19(5): 1428. DOI:10.3390/ijms19051428 |
| [13] |
Lauf U, Giepmans BN, Lopez P, et al. Dynamic trafficking and delivery of connexons to the plasma membrane and accretion to gap junctions in living cells[J]. Proc Natl Acad Sci USA, 2002, 99(16): 10446-10451. DOI:10.1073/pnas.162055899 |
| [14] |
Márquez-Rosado L, Solan JL, Dunn CA, et al. Connexin43 phosphorylation in brain, cardiac, endothelial and epithelial tissues[J]. Biochim Biophys Acta, 2012, 1818(8): 1985-1992. DOI:10.1016/j.bbamem.2011.07.028 |
| [15] |
Fong JT, Kells RM, Gumpert AM, et al. Internalized gap junctions are degraded by autophagy[J]. Autophagy, 2012, 8(5): 794-811. DOI:10.4161/auto.19390 |
| [16] |
Johnson KE, Mitra S, Katoch P, et al. Phosphorylation on Ser-279 and Ser-282 of connexin43 regulates endocytosis and gap junction assembly in pancreatic cancer cells[J]. Mol Biol Cell, 2013, 24(6): 715-733. DOI:10.1091/mbc.E12-07-0537 |
| [17] |
Nickel B, Boller M, Schneider K, et al. Visualizing the effect of dynamin inhibition on annular gap vesicle formation and fission[J]. J Cell Sci, 2013, 126(Pt 12): 2607-2616. DOI:10.1242/jcs.116269 |
| [18] |
Ghosh S, Kumar A, Tripathi RP, et al. Connexin-43 regulates p38-mediated cell migration and invasion induced selectively in tumour cells by low doses of γ-radiation in an ERK-1/2-independent manner[J]. Carcinogenesis, 2014, 35(2): 383-395. DOI:10.1093/carcin/bgt303 |
| [19] |
Ghosh S, Kumar A, Chandna S. Connexin-43 downregulation in G2/M phase enriched tumour cells causes extensive low-dose hyper-radiosensitivity (HRS) associated with mitochondrial apoptotic events[J]. Cancer Lett, 2015, 363(1): 46-59. DOI:10.1016/j.canlet.2015.03.046 |
| [20] |
Viczenczova C, Szeiffova Bacova B, Egan Benova T, et al. Myocardial connexin-43 and PKC signalling are involved in adaptation of the heart to irradiation-induced injury: Implication of miR-1 and miR-21[J]. Gen Physiol Biophys, 2016, 35(2): 215-222. DOI:10.4149/gpb_2015038 |
| [21] |
Yang X, Xu S, Su Y, et al. Autophagy-Src regulates connexin43-mediated gap junction intercellular communication in irradiated HepG2 cells[J]. Radiat Res, 2018, 190(5): 494-503. DOI:10.1667/RR15073.1 |
| [22] |
Mathur A, Kumar A, Babu B, et al. In vitro mesenchymal-epithelial transition in NIH3T3 fibroblasts results in onset of low-dose radiation hypersensitivity coupled with attenuated connexin-43 response[J]. Biochim Biophys Acta Gen Subj, 2018, 1862(3): 414-426. DOI:10.1016/j.bbagen.2017.11.013 |
| [23] |
Autsavapromporn N, de Toledo SM, Little JB, et al. The role of gap junction communication and oxidative stress in the propagation of toxic effects among high-dose α-particle-irradiated human cells[J]. Radiat Res, 2011, 175(3): 347-357. DOI:10.1667/RR2372.1 |
| [24] |
Azzam EI, de Toledo SM, Little JB. Expression of connexin43 is highly sensitive to ionizing radiation and other environmental stresses[J]. Cancer Res, 2003, 63(21): 7128-35. DOI:10.1097/00130404-200311000-00008 |
| [25] |
Autsavapromporn N, De Toledo SM, Jay-Gerin JP, et al. Human cell responses to ionizing radiation are differentially affected by the expressed connexins[J]. J Radiat Res, 2013, 54(2): 251-259. DOI:10.1093/jrr/rrs099 |
| [26] |
Bian B, Yu XF, Wang GQ, et al. Role of miRNA-1 in regulating connexin 43 in ischemia-reperfusion heart injury: a rat model[J]. Cardiovasc Pathol, 2017, 27: 37-42. DOI:10.1016/j.carpath.2016.12.006 |
| [27] |
Hejmej A, Gòrowska E, Kotula-Balak M, et al. Androgen signaling disruption during fetal and postnatal development affects androgen receptor and connexin 43 expression and distribution in adult boar prostate[J]. Biomed Res Int, 2013, 2013: 407678. DOI:10.1155/2013/407678 |
| [28] |
Prevedel L, Morocho C, Bennett M, et al. HIV-associated cardiovascular disease: Role of connexin 43[J]. Am J Pathol, 2017, 187(9): 1960-1970. DOI:10.1016/j.ajpath.2017.05.011 |
| [29] |
Chen YY, Sun ZW, Jiang JP, et al. α-adrenoceptor-mediated enhanced inducibility of atrial fibrillation in a canine system inflammation model[J]. Mol Med Rep, 2017, 15(6): 3767-3774. DOI:10.3892/mmr.2017.6477 |
| [30] |
Solan JL, Lampe PD. Specific Cx43 phosphorylation events regulate gap junction turnover in vivo[J]. FEBS Lett, 2014, 588(8): 1423-1429. DOI:10.1016/j.febslet.2014.01.049 |
| [31] |
Giepmans BN. Gap junctions and connexin-interacting proteins[J]. Cardiovasc Res, 2004, 62(2): 233-245. DOI:10.1016/j.cardiores.2003.12.009 |
| [32] |
Crow DS, Beyer EC, Paul DL, et al. Phosphorylation of connexin43 gap junction protein in uninfected and Rous sarcoma virus-transformed mammalian fibroblasts[J]. Mol Cell Biol, 1990, 10(4): 1754-1763. DOI:10.1128/mcb.10.4.1754 |
| [33] |
Musil LS, Goodenough DA. Biochemical analysis of connexin43 intracellular transport, phosphorylation, and assembly into gap junctional plaques[J]. J Cell Biol, 1991, 115(5): 1357-1374. DOI:10.1083/jcb.115.5.1357 |
| [34] |
Lampe PD, TenBroek EM, Burt JM, et al. Phosphorylation of connexin 43 on serine368 by protein kinase C regulates gap junctional communication[J]. J Cell Biol, 2000, 149(7): 1503-1512. DOI:10.1083/jcb.149.7.1503 |
| [35] |
Thanik VD, Chang CC, Zoumalan RA, et al. A novel mouse model of cutaneous radiation injury[J]. Plast Reconstr Surg, 2011, 127(2): 560-568. DOI:10.1097/PRS.0b013e3181fed4f7 |
| [36] |
Eikendal ALM, Evelein AMV, Uiterwaal CSPM, et al. Relation between circulating inflammatory chemokines and vascular characteristics in healthy, young children[J]. J Am Heart Assoc, 2015, 4(12): e002346. DOI:10.1161/JAHA.115.002346 |
| [37] |
Fernandes VR, Polak JF, Cheng S, et al. Arterial stiffness is associated with regional ventricular systolic and diastolic dysfunction: the multi-ethnic study of atherosclerosis[J]. Arterioscler Thromb Vasc Biol, 2008, 28(1): 194-201. DOI:10.1161/ATVBAHA.107.156950 |
| [38] |
张宝平. 癌细胞力学性质测量及放射诱导下细胞损伤的生物力学研究[D]. 兰州: 兰州大学, 2016. DOI: 10.7666/d.D01032938.Zhang BP.Measurement of mechanical properties of cancer cells and biomechanical study of radiation-induced cell injury[D].Lanzhou: Lanzhou University, 2016.DOI: 10.7666/d.D01032938. |
| [39] |
李辰, 田梅, 苟巧, 等. 缝隙连接蛋白43在X射线诱导的人脐静脉内皮细胞凋亡中的作用及机制研究[J]. 中华放射医学与防护杂志, 2018, 38(10): 728-733. DOI: 10.3760/cma.j.issn.0254-5098.2018.10.002.LiC, Tian M, Gou Q, et al.Role of connexin 43 in X-ray induced apoptosis in human umbilical vein endothelial cells and its mechanism[J].Chin J Radiol Med Prot, 2018, 38(10): 728-733.DOI: 10.3760/cma.j.issn.0254-5098.2018.10.002. |
 2021, Vol. 41
2021, Vol. 41


