胰腺癌的发病率正在逐年增加,5年生存率仅为9%[1]。放疗是胰腺癌综合治疗中重要的方法之一[2],然而,辅助放疗并未改善胰腺癌生存[3],需要进一步探索放射治疗对胰腺癌的不良反应。上皮间质转化包含着复杂的分子和形态变化过程,表现为细胞间黏附力的降低和穿过上皮下基底膜的能力减弱已经被认为是影响转移的关键机制[4-5]。然而,辐射是否诱导胰腺癌细胞发生上皮间质转化,进而促进转移仍不十分明了。
基质金属蛋白酶(matrix metalloproteinase,MMPs)家族中MMP2和MMP9被证明具有改变肿瘤内血管生成,诱导上皮间质转化的功能。其与经典上皮间质转化(epithelial-mesenchymal transition,EMT)相关因子(E-cadherin、N-cadherin和Vimentin)一样,具有诱导内皮细胞发生迁移的功能[6]。转化生长因子β1(transforming growth factor-β1,TGF-β1)可以通过TGF-β1-SMAD3经典信号级联反应,激活多种分子表达,促进上皮间质转化[7],Mcdonald等[8]证实TGF-β1可以通过减少H3K9Me2组蛋白的甲基化,而激活E-cadherin的表达,诱导细胞发生上皮间质转化。研究发现,射线可以引发线粒体数量减少、膜电位破坏、ATP合成下降等线粒体功能障碍的表现[9]。前期研究表明,线粒体功能障碍与IKK-TGF-β1及细胞粘附等通路相关[10],而持续辐射通过NF-κB促进TGF-β1表达增加[11]。辐射引起TGF-β1的表达变化与胰腺癌细胞上皮间质转化尚待进一步探索。本研究参考临床常用辐射剂量,探究不同剂量辐射对胰腺癌细胞株受照后上皮间质转化的影响,探究TGF-β1表达增加在存活胰腺癌细胞株上皮间质转化中的作用,并提出了辐射对于线粒体功能障碍可能是胰腺癌细胞株上皮间质转化的关键原因,为进一步探究以线粒体功能分子和TGF-β1通路为靶点,降低胰腺癌患者放疗后远端转移、改善患者预后奠定了基础。
材料与方法1. 试剂及材料:人胰腺癌细胞株PATU8 988 t购自武汉普诺赛生命科技有限公司(货号CL-0579);澳洲胎牛血清(FBS,美国GIBCO公司);细胞RNA提取试剂盒(北京艾博公司);RT real-time PCR试剂盒(日本TaKaRa公司);CCK-8检测试剂盒(苏州阿玛迪公司);凋亡检测试剂盒(苏州阿玛迪公司);膜电位检测试剂盒(上海碧云天公司);siRNA(苏州吉玛公司);转染试剂(美国GenemuteTM公司);碳酰氰基-对-氯苯腙(CCCP)试剂(上海碧云天公司)。
2. 实验细胞及射线照射:使用含10% FBS的DMEM培养基,37℃、5%CO2的培养箱培养人胰腺癌细胞株,于培养瓶中接种后置于德国Siemens公司的Primus直线加速器进行6 MV X射线照射,照射条件:源靶距100 cm,照射野10 cm×10 cm,剂量率200 cGy/min。将人胰腺癌细胞株分为空白对照组、多次2 Gy受照组(2 Gy×20次,5次/周)和多次4 Gy受照组(4 Gy×10次,3次/周)。每组重复3次。
3. Real-time PCR检测:按照细胞RNA提取试剂盒步骤,提取细胞内总RNA,使用反转录试剂盒合成cDNA,采用SYBR Green荧光定量试剂盒进行测定。以β-肌动蛋白作为内参参照物,使用Prism设计引物,引物浓度为10 μmol/L,引物序列见表 1。PCR条件为:预变性95℃ 5 min、变性95℃ 5 s、退火54℃ 30 s、延伸72℃ 30 s、40个循环,每组重复3次,检测基因的循环数(Ct)值。
|
|
表 1 引物序列 Table 1 The sequence of primers |
4. Transwell实验:分别于射线照射48 h后,取7组细胞200 μl含5% FBS的培养基重悬细胞接种于上室,700 μl含有20% FBS的培养基加入下室,注意不要有气泡。37℃孵育24 h后,多聚甲醛固定30 min,结晶紫染色,棉签去除上室细胞后,显微镜下观察细胞迁移情况。
5. 细胞转染:分别收集空白对照组和多次受照组处于对数生长期的细胞,均匀铺在6孔板中,转染后24 h提取RNA。TGF-β1的siRNA序列为:正义链:GACACCAACUAUUGCUUCATT;反义链:UGAAGCAAUAGUUGGUGUCTT。NC阴性对照的siRNA序列为:正义链:UUCUCCGAACGUGUCA CGUTT;反义链:ACGUGACACGUUCGGAGAATT,Real-time PCR检测基因循环数(Ct)值,每组重复3次。
6. 线粒体膜电位检测:分别收集收集空白对照组和多次受照组处于对数生长期的细胞,均匀铺在6孔板中,24 h后收集细胞,按照说明书配置JC-1工作液,加入细胞中,37℃孵育20 min,用染色缓冲液清洗2次后,重悬细胞,流式上机检测细胞膜电位变化,每组重复3次。
7. 统计学处理:生物等效剂量(BED)=D[1+d/(α/β)],式中,D为物理总剂量;d为单次剂量;肿瘤组织α/β=10。使用SPSS 17.0软件进行数据处理。数据经正态性检验符合正态分布,以x±s表示。组间比较用配对t检验。使用2-△△Ct公式法分析real-time PCR检测数据。P < 0.05为差异有统计学意义。
结果1.多次受照对胰腺癌细胞上皮间质转化及TGF-β1含量的影响:辐射后存活肿瘤细胞会表现出上皮间质转化,迁移增加的特点。与空白对照组相比,多次2 Gy和多次4 Gy受照组,2周后存活肿瘤细胞迁移数(t=21.90、35.64,P < 0.05)均增加,如图 1所示;上皮间质转化分子E-cadherin表达下降(t=8.37、6.77,P < 0.05),N-cadherin(t=4.42、4.77,P < 0.05)、Vimentin(t=4.57、3.02,P < 0.05)、MMP2(t=7.27、26.08,P < 0.05)和MMP9(t=13.26、7.29,P < 0.05)表达均增加,TGF-β1(t=90.49、35.17,P < 0.05)的含量也增加,见表 2。
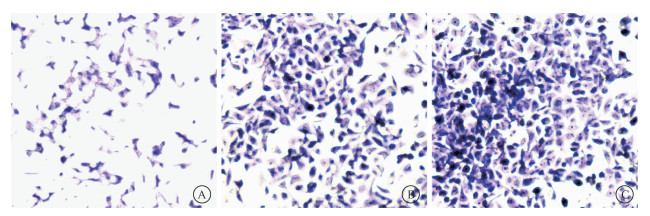
|
图 1 受照2周后存活细胞迁移改变×40 A. 空白对照组;B. 多次2 Gy受照组;C. 多次4 Gy受照组 Figure 1 Cell migration two weeks after irradiation ×40 A. Blank control group; B. Multiple dose group of 2 Gy; C. Multiple dose group of 4 Gy |
|
|
表 2 受照后不同组迁移性及TGF-β1含量对比结果(x±s) Table 2 Comparison of migration and TGF-β1 content among different groups after irradiation(x±s) |
相较于多次2 Gy受照组,多次4 Gy受照组TGF-β1的含量、上皮间质转化和迁移数增加幅度均更大(t=30.41、96.04,P < 0.05),推测TGF-β1的含量变化与上皮间质转化,迁移增加有相关性。计算得到,多次2 Gy受照组计算的生物等效剂量为48 Gy,多次4 Gy受照组为56 Gy,提示临床需要关注生物有效剂量的增加对于远端转移的影响。
2. 多次受照组TGF-β1含量与上皮间质转化及迁移的影响:使用小干扰RNA降低TGF-β1的含量后,存活肿瘤细胞会表现出上皮间质转化受抑制,迁移降低的特点,如图 2所示,transwell小室迁移数(t=38.66、11.54,P < 0.05)、TGF-β1(t=10.52、3.78,P < 0.05)、N-cadherin(t=4.62、10.32,P < 0.05)、Vimentin(t=4.76、3.80,P < 0.05)、MMP2(t=4.91、3.71,P < 0.05)和MMP9(t=6.25、6.81,P < 0.05)表达均降低,见表 3。
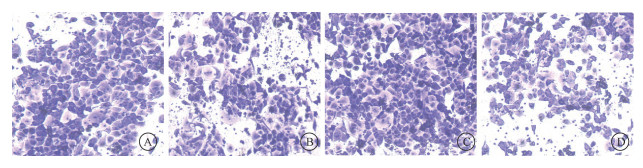
|
图 2 小干扰RNA敲低TGF-β1后迁移性对比结果×40 A. 多次2 Gy受照组;B. 多次2 Gy受照+siRNA- TGF-β1组;C. 多次4 Gy受照组;D. 多次4 Gy受照+siRNA- TGF-β1组 Figure 2 Comparison of migration among different groups after siRNA knockdown of TGF-β1 ×40 A. Multiple-dose group of 2 Gy; B. Multiple-dose group of 2 Gy with siRNA- TGF-β1; C. Multiple-dose group of 4 Gy; D. Multiple-dose group of 4 Gy with siRNA- TGF-β1 |
|
|
表 3 小干扰RNA敲低TGF-β1后迁移性对比结果(x±s) Table 3 Comparison of migration among different groups after siRNA knockdown of TGF-β1(x±s) |
3. 破坏线粒体功能后,对TGF-β1含量的影响:为了研究辐射后TGF-β1含量增加的原因,结合前期研究[10-11],推测与辐射引起的线粒体功能障碍有关,检测发现与空白组相比,多次受照组细胞表现出线粒体功能障碍的特点,具体表现为线粒体膜电位下降(t=6.94、29.71,P < 0.05),复合体相关亚基NDUFS1(t=14.98、14.80,P < 0.05)、S4(t=10.24、4.70,P < 0.05)、S5(t=7.28、11.11,P < 0.05)、V1(t=23.14、22.31,P < 0.05)、V2(t=82.62、26.89,P < 0.05)、A8(t=21.62、13.71,P < 0.05)、A9(t=14.43、11.74,P < 0.05)含量均下降。
进一步验证线粒体功能障碍与TGF-β1含量的相关性,本研究在PATU1 988 t细胞中加入10 μmol/L的CCCP,孵育2 h后破坏线粒体膜电位(t=16.51,P < 0.05),检测发现线粒体复合体相关亚基NDUFS1(t=10.57,P < 0.05)、S4(t=12.45,P < 0.05)、S5(t=19.43,P < 0.05)、V1(t=45.82,P < 0.05)、V2(t=10.94,P < 0.05)、A8(t=6.48,P < 0.05)、A9(t=6.04,P < 0.05)含量均下降,TGF-β1表达量(t=47.93,P < 0.05)增加,说明线粒体功能障碍可以促进TGF-β1表达量增加,见表 4。
|
|
表 4 受照后2周不同组线粒体功能及TGF-β1含量对比结果(x±s) Table 4 Comparison of mitochondrial function and TGF-β1 content among different groups after irradiations(x±s) |
4.破坏线粒体功能后,对胰腺癌细胞上皮间质转化的影响:在PATU1 988 t细胞中加入10 μmol/L的CCCP破坏线粒体功能后,上皮间质转化增强,表现为上皮间质转化相关分子含E-cadherin(t=11.93,P < 0.05)含量下降、N-cadherin(t=10.87,P < 0.05)、Vimentin(t=9.38,P < 0.05)、MMP2(t=8.07,P < 0.05)和MMP9(t=5.21,P < 0.05)表达均升高,见表 5。
|
|
表 5 破坏线粒体功能后上皮间质转化对比结果 Table 5 Comparison of EMT among different groups after disrupting mitochondrial function |
讨论
放疗是肿瘤治疗的主要方式之一[12],其在促进细胞凋亡的同时会改变肿瘤微环境,使残余肿瘤更容易发生转移[13-14]。本研究表明,辐射诱导存活的胰腺癌细胞发生上皮间质转化,迁移增加,因此,探究放疗促进肿瘤转移的机制并进行相应干预,是弥补放疗后转移复发风险增加的关键。
TGF-β1是一种普遍存在的生长因子,与细胞的增殖、迁移、分化和存活有关[15]。研究证实,放疗可以促进TGF-β1的表达,伴随炎症因子的分泌,改变肿瘤微环境[16],而肿瘤微环境的改变又可以进一步影响肿瘤的生物学行为。本研究也证实,多次X射线照射后,胰腺癌细胞的TGF-β1表达量增加,阻断TGF-β1的表达后,肿瘤细胞上皮间质转化下降,迁移力随之下降。有研究证明,线粒体功能障碍,活性氧的产生增加,通过逆向信号通路促进TGF-β1的分泌[10-11, 17]。Chen等[18]表明线粒体膜电位丧失后,TGF-β1定位于包括线粒体在内的细胞内膜结合区室中,并重新分布到细胞质中,增加胞质中TGF-β1的含量,线粒体膜电位变化还可以破坏代谢调节,下调线粒体蛋白和PGC-1α调控的转录因子,包括核呼吸因子1和线粒体转录因子A(TFAM),影响核内TGF-β1的转录[19]。本研究也证实,线粒体功能破坏可以促进TGF-β1的表达量增加。
总之,本研究发现辐射诱导存活胰腺癌细胞株TGF-β1的表达量升高,促进上皮间质转化和细胞迁移。辐射后细胞出现线粒体功能障碍,具体表现为膜电位下降和线粒体亚单位含量的减少。而线粒体功能障碍可以进一步诱导TGF-β1表达增加,促进细胞上皮间质转化和迁移的发生。合理推测,多次照射后胰腺癌细胞上皮间质转化和迁移能力增加,与线粒体功能障碍诱导的TGF-β1表达增加有关,提示对胰腺癌放疗的临床实践中,需关注照射后激活TGF-β1的效应,如能采取合适的针对TGF-β1的联合干预策略,有可能改善胰腺癌放疗的疗效。然而,由于目前暂无有效的线粒体功能改善手段,本研究未在多次受照组中进行线粒体功能回复研究,后续仍需进一步找寻线粒体的保护制剂,为胰腺癌综合治疗提供更精准度的治疗方案。
利益冲突 所有研究者未因该研究接受利益,并对真实性和科学性予以保证
作者贡献声明 肖国辉完成实验及撰写论文;厉娜、魏艳负责数据整理分析;徐会、彭晋协助修改论文;周福祥指导研究设计和论文修改
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. DOI:10.3322/caac.21590 |
| [2] |
Pereira P, Edwards KJ, Mandleywala K, et al. iNOS regulates the therapeutic response of pancreatic cancer cells to radiotherapy[J]. Cancer Res, 2020, 80(8): 1681-1692. DOI:10.1158/0008-5472 |
| [3] |
de Geus S, Eskander MF, Kasumova GG, et al. Stereotactic body radiotherapy for unresected pancreatic cancer: a nationwide review[J]. Cancer, 2017, 123(21): 4158-4167. DOI:10.1002/cncr.30856 |
| [4] |
Savagner P. Epithelial-mesenchymal transitions: from cell plasticity to concept elasticity[J]. Curr Top Dev Biol, 2015, 112: 273-300. DOI:10.1016/bs.ctdb.2014.11.021 |
| [5] |
Jolly MK, Somarelli JA, Sheth M, et al. Hybrid epithelial/mesenchymal phenotypes promote metastasis and therapy resistance across carcinomas[J]. Pharmacol Ther, 2019, 194: 161-184. DOI:10.1016/j.pharmthera.2018.09.007 |
| [6] |
Klein T, Bischoff R. Physiology and pathophysiology of matrix metalloproteases[J]. Amino Acids, 2011, 41(2): 271-290. DOI:10.1007/s00726-010-0689-x |
| [7] |
Shan B, Yao TP, Nguyen HT, et al. Requirement of HDAC6 for transforming growth factor-beta1-induced epithelial-mesenchymal transition[J]. J Biol Chem, 2008, 283(30): 21065-21073. DOI:10.1074/jbc.M802786200 |
| [8] |
Mcdonald OG, Wu H, Timp W, et al. Genome-scale epigenetic reprogramming during epithelial-to-mesenchymal transition[J]. Nat Struct Mol Biol, 2011, 18(8): 867-874. DOI:10.1038/nsmb.2084 |
| [9] |
Levy A, Stedman A, Deutsch E, et al. Innate immune receptor NOD2 mediates LGR5(+) intestinal stem cell protection against ROS cytotoxicity via mitophagy stimulation[J]. Proc Natl Acad Sci USA, 2020, 117(4): 1994-2003. DOI:10.1073/pnas.1902788117 |
| [10] |
Wei Y, Chen L, Xu H, et al. Mitochondrial dysfunctions regulated radioresistance through mitochondria-to-nucleus retrograde signaling pathway of NF-κB/PI3K/AKT2/mTOR[J]. Radiat Res, 2018, 190(2): 204-215. DOI:10.1667/RR15021.1 |
| [11] |
Wei J, Xu H, Liu Y, et al. Effect of captopril on radiation-induced TGF-β1 secretion in EA.Hy926 human umbilical vein endothelial cells[J]. Oncotarget, 2017, 8(13): 20842-20850. DOI:10.18632/oncotarget.15356 |
| [12] |
Zhang P, Wang L, Rodriguez-Aguayo C, et al. miR-205 acts as a tumour radiosensitizer by targeting ZEB1 and Ubc13[J]. Nat Commun, 2014, 5: 5671. DOI:10.1038/ncomms6671 |
| [13] |
Dignam JJ, Kocherginsky MN. Choice and interpretation of statistical tests used when competing risks are present[J]. J Clin Oncol, 2008, 26(24): 4027-4034. DOI:10.1200/JCO.2007.12.9866 |
| [14] |
Tsui D, Murtaza M, Wong A, et al. Dynamics of multiple resistance mechanisms in plasma DNA during EGFR-targeted therapies in non-small cell lung cancer[J]. EMBO Mol Med, 2018, 10(6): e7945. DOI:10.15252/emmm.201707945 |
| [15] |
Janssens K, Ten DP, Janssens S, et al. Transforming growth factor-beta1 to the bone[J]. Endocr Rev, 2005, 26(6): 743-774. DOI:10.1210/er.2004-0001 |
| [16] |
Mccann E, O'Sullivan J, Marcone S. Targeting cancer-cell mitochondria and metabolism to improve radiotherapy response[J]. Transl Oncol, 2021, 14(1): 100905. DOI:10.1016/j.tranon.2020.100905 |
| [17] |
Larson-Casey JL, Deshane JS, Ryan AJ, et al. Macrophage akt1 kinase-mediated mitophagy modulates apoptosis resistance and pulmonary fibrosis[J]. Immunity, 2016, 44(3): 582-596. DOI:10.1016/j.immuni.2016.01.001 |
| [18] |
Chen W, Frank ME, Jin W, et al. TGF-beta released by apoptotic T cells contributes to an immunosuppressive milieu[J]. Immunity, 2001, 14(6): 715-725. DOI:10.1016/s1074-7613(01)00147-9 |
| [19] |
Hickey FB, Corcoran JB, Docherty NG, et al. IHG-1 promotes mitochondrial biogenesis by stabilizing PGC-1α[J]. J Am Soc Nephrol, 2011, 22(8): 1475-1485. DOI:10.1681/ASN.2010111154 |
 2021, Vol. 41
2021, Vol. 41


