核辐射突发事件时需要对大人群进行快速检伤分类,而现有的生物剂量学方法尚不能满足快速、高通量的要求[1-2],因此,亟需探索新的辐射生物剂量学方法。代谢组学是研究生物系统全部代谢物的组成及其动态变化规律的学科,通过对细胞、组织或生物体系中小分子代谢物的分析,可反应机体代谢活动的变化和特定的生理状态[3]。过往已有应用代谢组学方法筛选辐射生物标志物[4-5],以及用于放疗患者诊断或预测预后指标的报道[6-7],但目前应用代谢物作为辐射剂量评价指标尚不多见。本研究以全身受照大鼠为模型,应用代谢组学方法筛选血浆中的辐射差异代谢物,并分析其变化特征,为核辐射生物标志物研究提供科学依据。
材料与方法1. 实验动物:SD大鼠75只(雄性,SPF级,6~8周,200~250 g,北京维通利华实验动物技术有限公司,生产许可证:SYXK京2016-0006),其中50只(发现集)用于筛选辐射差异代谢物,分为对照组和5个照射组,每组8~9只;25只(验证集)用于验证辐射差异代谢物对剂量分类的准确性,分为对照组和4个照射组,每组5只。本研究通过中国疾病预防控制中心辐射防护与核安全医学所实验动物伦理福利委员会审查(2019-001号)。
2.照射条件:对大鼠进行全身照射,照射源为60Co γ射线(北京市辐射中心),吸收剂量率为1 Gy/min。发现集大鼠的照射剂量分别为0、1、2、3、5、8 Gy,验证集大鼠的照射剂量分别为0、0.5、2.5、4、6 Gy。
3.样本制备:照射后4 h,采集大鼠血液约1 ml[眼内眦静脉、乙二胺四乙酸(EDTA)抗凝],4℃离心半径15 cm,3 000 r/min离心10 min,取上层血浆分装后冻存于-80℃冰箱。实验前取100 μl血浆在4℃解冻,加入300 μl乙腈,振荡混匀后4℃离心半径15 cm,12 000 r/min离心10 min,取上清100 μl,待测。应用所有血浆混合后的样本或氨基酸及酰基肉碱同位素内标(美国Cambridge Isotope Laboratories公司)作为质量控制样本。
4.液相色谱和质谱联用(LC-MS)条件:用超快速液相色谱(美国ThermoFisher公司)分离血浆样本,色谱柱为UPLC BEH Amide(美国Waters公司)。流动相A由乙腈、0.1%甲酸和10 mmol/L乙酸铵组成;流动相B由高纯水、0.1%甲酸和10 mmol/L乙酸铵组成。柱温为40℃,流速为0.3 ml/ min,进样量为1.0 μl。梯度洗脱条件为0~7 min,流动相A(95%);7~12 min,流动相A(50%);12 min,流动相A(95%)。用电喷雾离子源四极杆轨道离子阱质谱(美国ThermoFisher公司)进行超高分辨率一级全扫描,质荷比范围为50~1 500,离子源电压为3.7 kV。
5.统计学处理:用Xcalibur 2.2 SP1.48、Progenesis QI、Skyline、SIMCA-P 14.1软件进行数据采集和数据处理。用主成分分析(PCA)和正交偏最小二乘法判别分析(OPLS-DA)进行差异代谢物的筛选,用本地数据库和人类代谢组数据库(HMDB)进行代谢物鉴定,用MetaboAnalyst 5.0进行代谢通路分析和代谢物受试者工作特征曲线(receiver operating characteristic curve,ROC)分析。用SPSS 26.0软件进行统计学分析。代谢物浓度经正态性检验符合正态分布用x±s表示。各组间代谢物峰面积、代谢物浓度的比较经方差齐性检验采用单因素方差分析,两两比较采用LSD-t检验。P < 0.05为差异具有统计学意义。
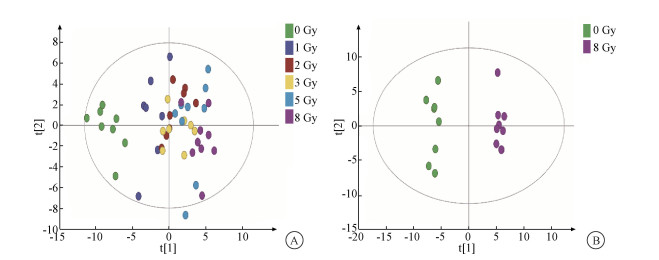
结果1. 辐射差异代谢物的筛选:为筛选辐射差异代谢物,应用非靶向代谢组学方法对发现集的50只大鼠的血浆样本进行分析。0~8 Gy组大鼠血浆样本PCA得分图结果表明,大鼠全身受照后,血浆代谢物发生了显著变化,1~8 Gy组与0 Gy组能被明显区分,而不同照射剂量组之间有部分重叠。将8 Gy组与0 Gy组进行OPLS-DA,两组可明显分开,其模型解释率和模型预测率分别为0.990和0.905,表明该模型具有良好的解释性和预测性,见图 1。
|
图 1 不同剂量照射后大鼠血浆样本的代谢组学分析A. 主成分分析得分图;B. 正交偏最小二乘方判别分析得分图 Figure 1 Metabolomics analysis of rat plasma after different doses of irradiation A. Score of principal component analysis; B. Score of orthogonal partial least squares discriminant analysis |
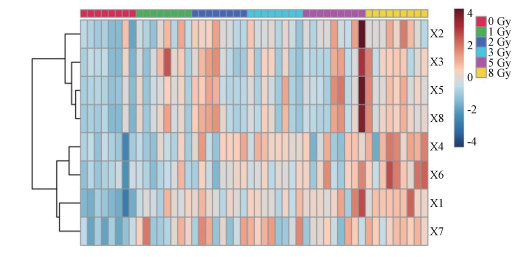
本研究辐射差异代谢物的筛选条件为:8 Gy组和0 Gy组代谢物的相对含量差异具有统计学意义(P < 0.05),且变量权重值(variable importance for the projection,VIP)>1。共鉴定出8个辐射差异代谢物(表 1),受照后均发生上调(图 2),包括胞嘧啶、己酰基肉碱、十八碳二烯酰基肉碱、亮氨酸、棕榈酰基肉碱、苯丙氨酸、苏氨酸、反式十八碳烯酰基肉碱。
|
|
表 1 大鼠受到8 Gy γ射线照射后4 h血浆差异代谢物 Table 1 Differential metabolites in rat plasma 4 h after 8 Gy γ-ray irradiation |
|
注:X1.胞嘧啶;X2.己酰基肉碱;X3.十八碳二烯酰基肉碱;X4.亮氨酸;X5.棕榈酰基肉碱;X6.苯丙氨酸;X7.苏氨酸;X8.反式十八碳烯酰基肉碱 图 2 大鼠受到8 Gy γ射线照射后4 h血浆差异代谢物热图 X1. Cytosine; X2. L-Hexanoylcarnitine; X3. Linoelaidylcarnitine; X4. L-Leucine; X5. L-Palmitoylcarnitine; X6. L-Phenylalanine; X7. L-Threonine; X8. Vaccenylcarnitine Figure 2 Heatmap of differential metabolites in rat plasma at 4 h after 8 Gy γ-ray irradiation |
2. 代谢通路分析:为探索辐射诱导大鼠血浆代谢途径的变化,将8个辐射差异代谢物进行代谢通路分析。结果表明,大鼠受到8 Gy 60Co γ射线照射后,共有7条代谢通路发生改变,包括缬氨酸、亮氨酸和异亮氨酸的生物合成,氨基酰-tRNA的生物合成,苯丙氨酸、酪氨酸和色氨酸的生物合成,苯丙氨酸代谢,甘氨酸、丝氨酸和苏氨酸代谢,脂肪酸降解,缬氨酸、亮氨酸和异亮氨酸的降解。
3. 辐射差异代谢物定量分析:为验证辐射差异代谢物对剂量分类的准确性和稳定性,对验证集的25只大鼠血浆样本进行分析,应用氨基酸及酰基肉碱同位素内标进行质量控制,在此基础上,测定已筛选出的8个辐射差异代谢物的浓度。内标化合物的相对标准偏差均在15 %以下,表明LC-MS系统稳定,数据可靠。
0~6 Gy 60Co γ射线照射后,胞嘧啶、己酰基肉碱、十八碳二烯酰基肉碱及棕榈酰基肉碱在受照后发生上调(F=13.276、2.918、4.966、6.597,P < 0.05,表 2),变化趋势与发现集结果一致,表明其具有良好的可重复性。与0 Gy组相比,胞嘧啶及棕榈酰基肉碱在2.5、4和6 Gy组均显著上调(P < 0.05);己酰基肉碱及十八碳二烯酰基肉碱在4和6 Gy组均显著上调(P < 0.05)。亮氨酸、苯丙氨酸、苏氨酸及反式十八碳烯酰基肉碱在受照后无明显变化(P>0.05)。
|
|
表 2 不同剂量60Co γ射线照射后大鼠血浆差异代谢物浓度(μg/ml, x±s) Table 2 Concentrations of differential metabolites in rat plasma after different doses of γ-ray irradiation (μg/ml, x±s) |
4. 受试者工作特征曲线分析:应用ROC对胞嘧啶、己酰基肉碱、十八碳二烯酰基肉碱、棕榈酰基肉碱区分特定剂量样本进行分析,曲线下面积(area under curve,AUC)均>0.75(表 3),其中AUC值最高的代谢物分别为胞嘧啶(0.96)、胞嘧啶(0.98)和棕榈酰基肉碱(0.93)。将胞嘧啶、己酰基肉碱、十八碳二烯酰基肉碱、棕榈酰基肉碱代谢物进行组合后,区分0 Gy与>0 Gy、< 2 Gy与≥2 Gy、< 5 Gy与≥5 Gy样本的AUC值分别为0.96、1和0.94。
|
|
表 3 大鼠血浆辐射差异代谢物受试者工作特征曲线区分不同剂量组的曲线下面积 Table 3 Area under curve of receiver operating characteristic of the differential metabolites in different dose group |
讨论
在大规模核辐射突发事件发生后,需要对潜在受照人员剂量水平进行快速评估,从而为医学应急和伤员救治提供依据[8]。当潜在受到照射人员过多时,医疗系统可能无法应对。此时需要设定一个合理的剂量水平对大人群进行分类,低于这一水平,预计不会影响生命,而高于这一水平,需要立即进行医疗救治从而提高生存率。剂量阈值一般为2 Gy,因为2 Gy以上的射线照射会导致个体急性放射损伤,如不能得到及时有效的医疗救治,会引起造血系统和胃肠道损伤,严重的可导致死亡。而受到低于2 Gy照射的个体,尽管也需要进行临床治疗,但无需特别紧急的处理[9]。快速、准确地对潜在受照人员进行剂量评估和医学分类,将应急状态下有限的医疗资源投入到需要立即救治的人员中,可以挽救更多人的生命。本研究应用代谢组学方法,分析了大鼠全身受照后4 h血浆代谢物的变化,并应用辐射差异代谢物对特定剂量进行分类。
本研究共筛选出了8个辐射差异代谢物,包括4个酰基肉碱、3个氨基酸及其衍生物和1个核苷酸。机体内的肉碱类化合物包括游离左旋肉碱和酰基肉碱,参与脂肪酸β氧化,为机体生命活动提供能量[10]。Obayashi等[11]研究表明己酰基肉碱可作为大鼠骨骼肌毒性的生物标志物。棕榈酰基肉碱具有脂肪酰化功能,在细胞凋亡、增殖等生物过程中具有重要作用[12]。Liu等[13]报道了小鼠在处于低氧状态下,棕榈酰基肉碱和十八碳二烯酰基肉碱显著上调。Pannkuk等[14]在对非人灵长类动物血清的研究中发现,丁酰基肉碱和戊酰基肉碱在受到γ射线7 d后会发生显著上调。亮氨酸、苯丙氨酸和苏氨酸均是人体必需氨基酸,参与激素和神经递质的合成,调控机体糖脂代谢和能量代谢,在代谢相关疾病治疗中具有重要作用[15]。贺晓兰等[16]报道了宫颈癌患者在放疗后的粪便中苯丙氨酸水平显著上升。过往研究还报道了苏氨酸在肺癌患者放疗后的血清中,以及大鼠受照后尿液中均发生显著变化[17-18]。胞嘧啶是组成DNA的4种基本碱基之一,Mak等[19]发现γ射线可导致胞嘧啶发生交联,可作为大鼠受照后尿液中的生物标志物。
应用不同批次的大鼠进行验证,发现8个辐射差异代谢物中,有4个(胞嘧啶、己酰基肉碱、十八碳二烯酰基肉碱及棕榈酰基肉碱)在受照后变化趋势一致,表明其具有一定的稳定性,具有作为辐射生物标志物的基础条件。进而究应用ROC分析而评估其对特定剂量分类的能力。AUC越大表示分类准确性越高,AUC >0.9表示具有很高的分类准确性,AUC >0.75表示具有较高的分类准确性。应用单一代谢物(胞嘧啶、己酰基肉碱、十八碳二烯酰基肉碱及棕榈酰基肉碱)区分特定剂量样本的AUC均>0.75,将其进行组合后,AUC值提高至0.90以上,较单一代谢物有所提高,提示其有可能作为辐射剂量分类的生物标志物。
代谢组学方法能够很好地反映细胞或组织所处环境,最接近表型,是深入探索机体与环境间联系的重要方法,已在肿瘤、心血管疾病、糖尿病等领域广泛应用[3]。代谢组学的研究样本,如血液或尿液,可微创或无创获得,能够反映机体功能或表型的变化;检测基于色谱-质谱联用平台,具有灵敏、快速、高通量的特点[20]。这些均是以代谢物作为辐射敏感标志物的优势条件。
综上所述,本研究应用代谢组学方法分析了大鼠全身受照后4 h血浆代谢物的变化,筛选出8个辐射差异代谢物,其中胞嘧啶、己酰基肉碱、十八碳二烯酰基肉碱及棕榈酰基肉碱具有良好的稳定性和可重复性,代谢物组合具有较高的分类准确性,有可能作为特定剂量分类的辐射敏感标志物。后续研究将增加照射后时间点,探索上述辐射敏感标志物的动态变化特征,并进一步分析其机制,为应用辐射敏感代谢物对潜在受照人员进行剂量分类提供科学依据。
利益冲突 无
作者贡献声明 赵骅负责实验操作、数据处理和论文撰写;习聪、田雪蕾协助实验动物处理和样本制备;刘海翔协助数据处理;田梅、刘青杰负责课题设计指导和论文修改
| [1] |
Sproull M, Camphausen K. State-of-the-art advances in radiation biodosimetry for mass casualty events involving radiation exposure[J]. Radiat Res, 2016, 186(5): 423-435. DOI:10.1667/RR14452.1 |
| [2] |
Pujol-Canadell M, Perrier JR, Cunha L, et al. Cytogenetically-based biodosimetry after high doses of radiation[J]. PLoS One, 2020, 15(4): e0228350. DOI:10.1371/journal.pone.0228350 |
| [3] |
Casadei L, Valerio M, Manetti C. Metabolomics: challenges and opportunities in systems biology studies[J]. Methods Mol Biol, 2018, 1702: 327-336. DOI:10.1007/978-1-4939-7456-6_16 |
| [4] |
Saitoh W, Takada S, Hirao J, et al. Plasma citrulline is a sensitive safety biomarker for small intestinal injury in rats[J]. Toxicol Lett, 2018, 295(10): 416-423. DOI:10.1016/j.toxlet.2018.07.009 |
| [5] |
Pannkuk EL, Laiakis EC, Garcia M, et al. Nonhuman primates with acute radiation syndrome: results from a global serum metabolomics study after 7.2 Gy total-body irradiation[J]. Radiat Res, 2018, 190(6): 576-583. DOI:10.1667/RR15167.1 |
| [6] |
Zhang T, Xu J, Liu Y, et al. Metabolomic profiling for identification of potential biomarkers in patients with dermatomyositis[J]. Metabolomics, 2019, 15(5): 77. DOI:10.1007/s11306-019-1539-9 |
| [7] |
Nalbantoglu S, Abu-Asab M, Suy S, et al. Metabolomics-based biosignatures of prostate cancer in patients following radiotherapy[J]. Omics, 2019, 23(4): 214-223. DOI:10.1089/omi.2019.0006 |
| [8] |
Homer MJ, Raulli R, Dicarlo-Cohen AL, et al. United states department of health and human services biodosimetry and radiological/nuclear medical countermeasure programs[J]. Radiat Prot Dosim, 2016, 171(1): 85-98. DOI:10.1093/rpd/ncw226 |
| [9] |
Sullivan JM, Prasanna PG, Grace MB, et al. Assessment of biodosimetry methods for a mass-casualty radiological incident: medical response and management considerations[J]. Health Phys, 2013, 105(6): 540-554. DOI:10.1097/HP.0b013e31829cf221 |
| [10] |
Yurut-Caloglu V, Caloglu M, Eskiocak S, et al. Comparison of the protective roles of L-carnitine and amifostine against radiation-induced acute ovarian damage by histopathological and biochemical methods[J]. J Cancer Res Ther, 2015, 11(2): 447-453. DOI:10.4103/0973-1482.146091 |
| [11] |
Obayashi H, Kobayashi N, Nezu Y, et al. Plasma 2-hydroxyglutarate and hexanoylcarnitine levels are potential biomarkers for skeletal muscle toxicity in male Fischer 344 rats[J]. J Toxicol Sci, 2017, 42(4): 385-396. DOI:10.2131/jts.42.385 |
| [12] |
Chen S, Zhu B, Yin C, et al. Palmitoylation-dependent activation of MC1R prevents melanomagenesis[J]. Nature, 2017, 549(7672): 399-403. DOI:10.1038/nature23887 |
| [13] |
Liu J, Zhan G, Chen D, et al. UPLC-QTOFMS-based metabolomic analysis of the serum of hypoxic preconditioning mice[J]. Mol Med Rep, 2017, 16(5): 6828-6836. DOI:10.3892/mmr.2017.7493 |
| [14] |
Pannkuk EL, Laiakis EC, Authier S, et al. Targeted metabolomics of nonhuman primate serum after exposure to ionizing radiation: potential tools for high-throughput biodosimetry[J]. RSC Adv, 2016, 6(56): 51192-51202. DOI:10.1039/C6RA07757A |
| [15] |
Holeč ek M. Branched-chain amino acids in health and disease: metabolism, alterations in blood plasma, and as supplements[J]. Nutr Metab (Lond), 2018, 15: 33. DOI:10.1186/s12986-018-0271-1 |
| [16] |
贺晓兰, 马辰莺, 徐晓婷. 宫颈癌放射治疗患者代谢产物表达与急性放射性肠炎相关性的研究[J]. 中华放射医学与防护杂志, 2020, 40(1): 1-10. He X L, Ma CY, Xu XT. Correlation between the expression of metabolites and acute radiation enteritis in patients with cervical cancer[J]. Chin J Radiol Med Prot, 2020, 40(1): 1-10. DOI:10.3760/cma.j.issn.0254-5098.2020.01.001 |
| [17] |
Hao D, Sarfaraz MO, Farshidfar F, et al. Temporal characterization of serum metabolite signatures in lung cancer patients undergoing treatment[J]. Metabolomics, 2016, 12: 58. DOI:10.1007/s11306-016-0961-5 |
| [18] |
Zhang YY, Zhou X, Li C, et al. Assessment of early triage for acute radiation injury in rat model based on urinary amino acid target analysis[J]. Mol Biosyst, 2014, 10(6): 1441-1449. DOI:10.1039/c3mb70526a |
| [19] |
Mak TD, Tyburski JB, Krausz KW, et al. Exposure to ionizing radiation reveals global dose- and time-dependent changes in the urinary metabolome of rat[J]. Metabolomics, 2015, 11(5): 1082-1094. DOI:10.1007/s11306-014-0765-4 |
| [20] |
Roh C. Metabolomics in radiation-induced biological dosimetry: a mini-review and a polyamine study[J]. Biomolecules, 2018, 8(2): 34. DOI:10.3390/biom8020034 |
 2021, Vol. 41
2021, Vol. 41


