2. 河南省肿瘤医院核医学科, 郑州 450000
2. Department of Nuclear Medicine, Henan Cancer Hospital, Zhengzhou 450000, China
随着医学科学技术的进步,核医学被广泛应用于临床诊断、治疗及医学研究等方面,在临床医学中具有重要的地位[1-2]。目前手术、131I治疗及甲状腺激素的治疗方案是分化型甲状腺癌患者最理想的选择[3]。131I摄入人体后,会被人体甲状腺滤泡上皮细胞摄取,131I衰变产生β粒子,通过电离作用破坏术后残留病变组织、微小病灶和转移灶。同时,131I也释放不同能级的γ射线,穿透性强,会对患者周围公众产生危害[4-6]。131I的物理半衰期为8.04 d,其衰变过程中释放出的γ射线能量分别为284、365和637 keV,分支比分别为6%、82%和7%。调查显示,大部分甲癌患者接受131I治疗服用的药物活度约在3.7~7.4 GBq(100~200 mCi)[2]。甲状腺癌治疗过程中服用了大剂量131I的患者成为移动的“辐射源”,可能对医护人员、陪侍的亲属造成照射。
为了解131I治疗过程中周围剂量水平,降低照射剂量,保护周围人员身体健康,开展了此调查研究。
资料与方法1.研究对象:在某开展甲状腺癌患者131I治疗的医院,选取接受131I治疗的患者78名,其中男性18例,女性60例,年龄在19~67岁之间,78名均为分化型甲状腺癌患者,甲状腺全切手术后进行131I清甲治疗。根据患者的身高体重以及治疗方案,服用有不同的药量放射性药物131I,服用的药量分别为3.7 GBq和5.55 GBq。
2.检测仪器:本研究使用的6150 AD型便携式γ剂量率测量仪(德国Automess公司)及其软件系统,经过中国计量科学研究院给出
3.患者周围剂量当量率测量:选取78名接受131I治疗患者,使用γ剂量率测量仪,距患者身体表面0.5和1 m处分别架设6150 AD型便携式γ剂量率测量仪,高度为1.4 m,使用约10 m的导线连接测量仪和笔记本电脑,测量患者时电脑可连续记录测量数据,患者自然站立标记好的检测点,通过原地转方向分别测量患者体表以及正面、背面、左右两侧4个方向的周围剂量当量率。每个测量点记录3个读数,取平均值作为测量结果。测量分别在服药后10 min,服药后1、2、3和5 d共5个时间点进行。
4.患者胸前位置累积吸收剂量监测:患者服药前,将InLight型光激发光剂量计分别佩戴于患者左胸前,服药后住院期间按要求佩戴,出院前第6天收回,在InLightTMmicroStar读数仪上测量。患者胸前累积吸收剂量的测量参照GBZ 128-2019职业性外照射个人监测规范[7]有关规定进行。
5.统计学处理:使用SSPS 20.0软件进行分析。本数据经正态性检验符合正态分布,以x±s形式表示。采用两独立样本t检验对不同药量组、不同性别组和不同年龄组的患者体表 5 cm处周围剂量当量率进行比较。P<0.05为差异有统计学意义。
结果1.患者周围剂量率测量结果:按照治疗方案服用的放射性药物131I的药量不同,78例患者中58例服用131I药物的放射性活度3.7 GBq(100 mCi),20例服用131I药物的放射性活度5.55 GBq(150 mCi),患者服用药物后不同时间不同距离不同方向的周围剂量当量率及变化情况详见表 1~4。服药后10 min患者胸前体表 5 cm处周围剂量当量率平均值为1.72 mSv/h,最低为0.52 mSv/h,最高可达4.81 mSv/h,服药后经机体代谢,测量值逐日降低,出院前胸前体表 5 cm处周围剂量当量率平均值为18.3 μSv/h, 其范围为2.66~64.47 μSv/h。其中服用剂量在3.7 GBq患者周围剂量当量率范围为2.66~64.47 μSv/h,服用剂量在5.55 GBq患者周围剂量当量率范围为3.77~33.33 μSv/h。患者服用131I后,体表 5 cm处的周围剂量当量率测量平均值达到1 709.28 μSv/h,随131I的物理衰变及人体的生物代谢,治疗患者间的体表周围剂量当量率5 d内下降趋势显著,但不同患者间仍有一定幅度差别。分析结果显示,不同服用药量组只有在服药后10 min的检测结果差异有统计学意义,5.55 GBq组体表 5 cm处剂量率高于3.7 GBq组(t=-6.11, P<0.05,表 1),其他时间点差异无统计学意义(P>0.05)。不同年龄组同样也是服药后10 min的检测结果差异有统计学意义,男性体表 5 cm处剂量率高于女性(t=4.52, P<0.05,见表 2),其他时间点差异无统计学意义(P>0.05)。不同年龄组之间的体表 5 cm处剂量率差异无统计学意义(P>0.05)。结果显示,患者4个方向不同距离的周围剂量当量率有一定差异,正面的结果明显高于其他3个方向,患者服药后前2 d的剂量率下降幅度显著(表 4),后面3 d趋于平缓,服药后5 d,患者0.5 m处4个方向的辐射水平均低于3.5 μSv/h,4个方向1 m处辐射水平均低于2 μSv/h。
|
|
表 1 131I治疗不同药量组患者体表 5 cm处周围剂量当量率测量结果(μSv/h,x±s) Table 1 Ambient dose equivalent rate at 5 cm from body surface in different dose groups of patients treated with 131I(μSv/h, x±s) |
|
|
表 2 131I治疗不同性别组患者体表 5 cm处周围剂量当量率测量结果(μSv/h,x±s) Table 2 Dose equivalent rate around 5 cm from body surface in different gender groups of patients treated with 131I(μSv/h, x±s) |
|
|
表 3 131I不同年龄组治疗患者体表 5 cm处周围剂量当量率测量结果(μSv/h,x±s) Table 3 Dose equivalent rate around 5 cm from body surface in different age groups of patients treated with 131I(μSv/h, x±s) |
|
|
表 4 131I治疗不同时间后患者环体表周围剂量当量率测量结果(μSv/h,x±s) Table 4 Ambient dose equivalent rate around the body surface of patients treated with 131I(μSv/h, x±s) |
2.累积吸收剂量测量结果:60例131I治疗甲状腺癌患者住院期间胸前佩戴的个人剂量计测量结果为15.9~58.8 mGy。由于服用131I药物后患者除主要受到内照射所致剂量外,仍会受到其他患者和周遭环境的影响,可根据患者服用药物后胸前体表位置的累积吸收剂量测量结果,了解患者服用的放射性药物对自身机体照射剂量的贡献,以及同病房居住的患者照射对其剂量贡献。
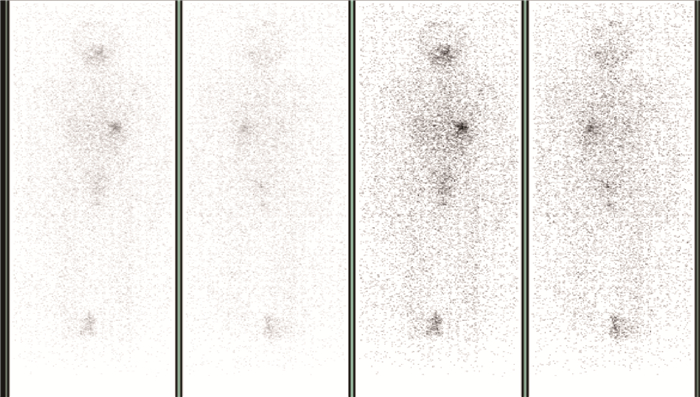
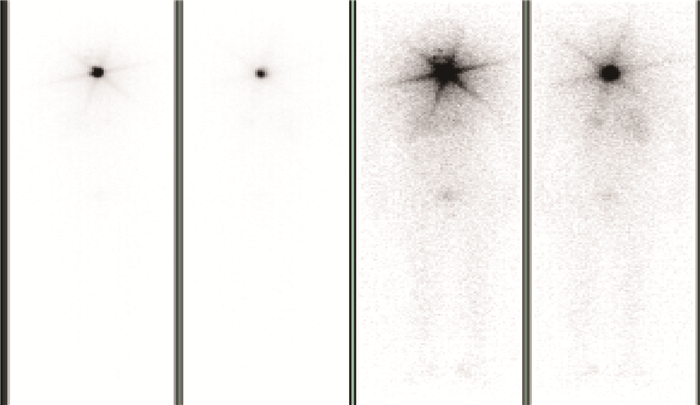
3.患者出院前SPECT扫描结果:多数患者出院时,体内的放射性药物131I含量已经较少,但仍有6.4%的患者的甲状腺依然残留着较大量的131I。131I治疗患者出院前1天通过SPECT扫描,可观察患者体内的131I分布情况。患者体表周围剂量当量率较低的患者,如图 1所示,体内的131I残余量全身分布较为均匀,突出呈现较少。如图 2所示,患者体表周围剂量当量率较高的患者,体内的131I仍有一定量的残余,影像呈现更为集中地分布在全身比例头颈部甲状腺位置。患者出院前的SPECT扫描可以定性分析患者131I的全身沉积情况,以及患者是否有肿瘤转移。
|
图 1 131I治疗患者出院前体表剂量率较低患者全身SPECT扫描图像 Figure 1 Whole body SPECT images of patients with low body surface dose rate before discharge from 131I treatment |
|
图 2 131I治疗患者出院前体表剂量率较高患者全身SPECT扫描图像 Figure 2 Whole body SPECT images of patients with high body surface dose rate before discharge from 131I treatment |
讨论
GB 18871- 2002《电离辐射防护与辐射源安全基本标准》[8]中明确规定:对于服用放射性核素治疗的患者,如果其周围的个体所接受的当量剂量经估算可能 < 5 mSv,那么该患者则允许解除隔离,《临床核医学患者防护要求》中规定,接受放射性核素治疗的患者出院时体内的放射性活度不超过400 MBq[9]。在进行辐射防护评价时,通常采用的是剂量限值和剂量约束值原则。不同国家和组织制定了关于131I治疗后患者出院指导规则,并且这些指导规则随着年代而有所变化。国际原子能机构(IAEA)1996年推荐131I治疗的甲状腺肿瘤患者出院允许最大活度为1 100 MBq[10]。2006年,IAEA推荐的出院标准有所变化,推荐采用美国核管理委员会提出的1 200 MBq或距患者l m处剂量率为70 μSv/h作为患者出院剂量指导水平[11-12]。
从患者出院前的SPECT扫描图像也可以看出,多数患者出院前体内131I残留量已经很少,少数患者的甲状腺位置依然着一定量的131I核素残留,体表 5 cm处的周围剂量当量率测量平均值仍可达到56.87 μSv/h。不同患者对于131I核素代谢的水平存在个体差异,据研究文献认为主要因素是由于患者机体对131I的代谢能力不同引起的[13]。比较本次研究数据显示,患者1 m距离的周围剂量当量率明显下降,患者出院前1 m距离4个方向的周围剂量当量率已经普遍下降到了2 μSv/h以下,因此住患者出院后家属或者陪同人员如需交流应尽量与患者保持距离在l m以上,减少不必要的照射。
60名甲状腺癌患者131I治疗住院过程中胸前位置的个人剂量当量值为15.9~58.8 mSv,个体间差异也比较大,这与患者服用的药量和机体的代谢能力有关,受检的患者有人是首次服药治疗,有人是第2次或者第3次服药治疗,他们之间对药物的代谢能力也有较大差别。此外,由于患者住院期间不是独立病房,病床之间虽然有铅屏风分隔,但在病房外活动期间,不可避免受到其他患者带来的照射,是导致受照剂量增加的一部分原因。
由于131I治疗甲状腺癌患者用药量较大,131I半衰期较长,且131I会衰变放出能量较高的γ射线,因此,需加强其治疗过程中的辐射防护与管理,并对患者周围人员剂量加以限制,严格控制患者出院剂量水平。美国核素管理委员会(NRC)有关接受131I治疗的患者出院指南中指出131I治疗后患者单独居住的时间应在2~7 d。欧洲原子能共同体对131I治疗后辐射防护指导水平要求相当严格,即使治疗用药剂量仅为400 MBq,若患者家有儿童时,出院后2~3周都应执行严格的限制措施[14-15]。对出院患者应加强辐射防护知识的告知,指导患者如何居住和活动,如何与家人和儿童、尤其是婴儿和孕妇的接触,在家庭里采用合理的距离,控制接触时间,降低对周围人群的辐射危害。
利益冲突 无
作者贡献声明 张庆召负责本研究的设计、检测、数据整理与论文撰写;李文亮负责现场检测的沟通协调及论文修改;朱卫国、梁婧、练德幸负责现场检测及数据整理;侯长松指导论文撰写和修改
| [1] |
苏婉真. 核医学辐射防护常见问题及对策[J]. 中国卫生标准管理, 2018, 9(17): 20-22. DOI: 10.3969/j.issn.1674-9316.2018.17.009. Analysis of common problems and countermeasures of radiation protection in nuclear medicine[J]. Prot Nucl Med, 2018, 9(17): 20-22. DOI: 10.3969/j.issn.1674-9316.2018.17.009. |
| [2] |
中华医学会核医学分会. 2018年全国核医学现状普查结果简报[J]. 中华核医学与分子影像杂志, 2018, 38(12): 813-814. Chinese Society of Nuclear Medicine. A brief report on the results of the national nuclear medicine survey in 2018[J]. Chin J Nucl Med Mol Imaging, 2018, 38(12): 813-814. DOI:10.3760/cma.j.issn.2095-2848.2018.12.010 |
| [3] |
Iwen KA, Brabant G. Thyroid hormone therapy in old age[J]. Internist (Berl), 2020, 61(6): 541-548. DOI:10.1007/s00108-020-00790-4 |
| [4] |
Barrington SF, O'Doherty MJ, Kettle AG, et al. Radiation exposure of the families of outpatients treated with radioiodine (iodine-131) for hyperthyroidism[J]. Eur J Nucl Med, 1999, 26(7): 686-692. DOI:10.1007/s002590050438 |
| [5] |
Cappelen T, Unhjem JF, Amundsen AL, et al. Radiation exposure to family members of patients with thyrotoxicosis treated with iodine-131[J]. Eur J Nucl Med Mol Imaging, 2006, 33(1): 81-86. DOI:10.1007/s00259-005-1888-7 |
| [6] |
Pant GS, Sharma SK, Bal CS, et al. Radiation dose to family members of hyperthyroidism and thyroid cancer patients treated with 131I[J]. Radiat Prot Dosim, 2006, 118(1): 22-27. DOI:10.1093/rpd/nci337 |
| [7] |
国家卫生健康委员会. GBZ 128-2019职业性外照射个人监测规范[S]. 北京: 人民卫生出版社, 2019. National Health Commission of the People's Republic of China. GBZ 128-2019 Specifications for individual monitoring of occupational externalexposure[S]. Beijing: People's Medical Publishing House, 2019. |
| [8] |
国家质量监督检验检疫总局. GB 18871-2002电离辐射防护与辐射源安全基本标准[S]. 北京: 中国标准出版社, 2003. General Administration of Quality Supervision, Inspection and Quarantine. GB 18871-2002 Basic standards for protection against ionizing radiation and safety of radiation sources[S]. Beijing: Standards Press of China, 2003. |
| [9] |
国家卫生和计划生育委员会. WS 533-2017临床核医学患者防护要求[S]. 北京: 人民卫生出版社, 2017. National Health and Family Planning Commission of the People's Republic of China. WS 533-2017 Requirements for patient radiation protection in clinical nuclear medicine[S]. Beijing: People's Medical Publishing House, 2017. |
| [10] |
International Atomic Energy Agency. Basic safety standards[R]. Vienna: IAEA, 1996.
|
| [11] |
International Atomic Energy Agency. Nuclear medicine resources manual[R]. Vienna: IAEA, 2006.
|
| [12] |
US Nuclear Regulatory Commission. Regulatory guide 8.39: release of patients administered with radioactive materials[R]. Washington DC: Office of Nuclear Regulatory Research, 1997.
|
| [13] |
易艳玲, 石洪成, 陈波, 等. 分化型甲状腺癌患者的131I有效半衰期[J]. 原子能科学技术, 2010, 44(z1): 612-615. Yi YL, Shi HC, Chen B, et al. Effective half-life of 131I in patients with differentiated thyroid Cancer[J]. Atomic Energy Sci Technol, 2010, 44(zl): 612-615. |
| [14] |
European Atomic Energy Community. Expert Group ex/art 31 guidance of radiation protection following iodine therapy concerning doses due to outpatients or discharged inpatients[R]. Brussels: European Atomic Energy Community, 1997.
|
| [15] |
Labbe E, Peyronnet D, Desmonts C, et al. Management and evaluation of sodium 131I iodide contamination after oral administration[J]. Nucl Med Communicat, 2020, 41(11): 1218-1220. DOI:10.1097/MNM.0000000000001276 |
 2021, Vol. 41
2021, Vol. 41


