我国是宫颈癌高发地区,近年来宫颈癌发病有年轻化的趋势,保留卵巢功能是保证这些年轻患者生活质量的重要因素[1]。早期宫颈癌患者若术后存在复发高危因素需要辅助放疗或放化疗,其常规剂量为4 500~5 000 cGy, 可导致卵巢功能永久性衰竭、患者更年期提前, 并可能发生一些更年期综合征等[2]。Hwang等[3]发现采用4野盒式放射治疗时,将卵巢移动至射野外4 cm或髂嵴上方1.5 cm以上,是保持完整卵巢功能的重要因素。因此,通过手术将卵巢移出盆腔放疗野可减少卵巢组织受量,可保护卵巢功能[4-6]。调强技术被认为能降低宫颈癌放疗中正常器官的急性和晚期不良反应[7-8],目前广泛用于宫颈癌的放射治疗中,但国内少有报道固定野调强(IMRT)与容积旋转调强(VMAT)计划在宫颈癌卵巢移位术后保护卵巢时的剂量学差异及卵巢移动位置与剂量间的关系。本研究设计了临床中常用的9野均分IMRT计划和两弧VMAT计划,分析两种技术在保护卵巢时的靶区、危及器官特别是卵巢剂量的差异,并分析了两种计划中卵巢悬吊位置与卵巢剂量的关系,以期能够通过卵巢位置预测卵巢放疗剂量。
资料与方法1. 研究对象:2015年至2019年江苏省肿瘤医院收治的31例进行宫颈癌根治手术后放疗的患者,平均年龄36.4岁,其中最小22岁,最大44岁。所有患者接受宫颈癌根治术的同时做了卵巢移位术,术后均进行放射治疗,患者至少有1个卵巢移位到宫颈癌靶区外。31例患者共有54个卵巢达到本要求。本研究经医院伦理委员会通过,所有患者签署知情同意书。
2. 放疗计划设计:患者采用仰卧位加真空垫进行固定,Siemens Somation CT(德国西门子公司)进行定位CT扫描,层厚5 mm,扫描范围上界在腰1椎体上缘、下界至股骨中段,患者定位前需要求排空尿液并喝水500 ml,同时还需口服适量造影剂(后期勾画时可以更好地分辨肠道和卵巢),等待约1 h进行定位CT扫描,治疗时采用同样的要求,以保证定位与治疗时膀胱充盈并尽量保持一致。将CT图像导入Monaco 5.1(瑞典医科达公司)治疗计划系统中进行靶区勾画。由主任医师根据临床指南进行靶区及危及器官勾画,CTV覆盖所有盆腔淋巴结区域(髂总、髂外、髂内、闭孔、骶前和宫旁),淋巴结区域被定义为围绕相关骨盆血管围绕7 mm边缘的区域,但不包括骨骼和肌肉,PTV是通过为临床靶区CTV外扩7~10 mm创建;并勾画脊髓、小肠、大肠、直肠、膀胱、骨髓、股骨头和卵巢等危及器官。在Monaco治疗计划系统中选用Elekta Versa HD直线加速器(瑞典医科达公司)进行计划设计,该加速器配备160叶多叶准直器(MLC),每个叶片在等中心处的投影厚度均为5 mm。VMAT采用射野为两个360°的弧,准直器角度均为10°,每个弧控制点为120个;IMRT采用9野均分的MLC模式,机架角度分别为0°、40°、80°、120°、160°、320°、280°、240°和200°;每个射束的准直器角度均为10°。X射线能量均为6 MV,剂量率600 MU/min,计算网格为3 mm,采用快速蒙特卡罗算法。
患者的放疗处方为95%的PTV剂量4 512 cGy,分次量188 cGy/次。计划靶区和危及器官的剂量-体积限制参考了放射治疗肿瘤学组(RTOG)1203报告[7, 9],任何PTV内至少0.03 cm3的体积不应超过110%的剂量,PTV外部任何0.03 cm3或更大的组织的连续体积不应超过规定剂量的110%。危及器官(OAR)剂量-体积限制直肠V40≤50%,膀胱V40≤45%,小肠V40≤35%,脊髓的最大剂量≤4 500 cGy。卵巢的剂量受悬吊位置的影响较大,在计划设计时需保证靶区和危及器官的受量达标的情况下尽量压低卵巢剂量,理想剂量为卵巢平均剂量(ovarian mean dose,OMD)低于300 cGy。先制定VMAT计划,达到临床目标后由医生审核,再采用相同的优化参数制定IMRT计划。采用ArcCheck剂量验证模体(美国SunNuclear公司)对两种计划进行剂量验证, 并记录执行的时间。
3. 靶区及危及器官的剂量学参数比较:靶区参照国际辐射单位与测量委员会(ICRU)83号报告[10]评估了PTV的近似最大剂量D2%(2% PTV体积受照的剂量),近似最小剂量D98%(98% PTV体积受照的剂量),靶区适形性指数(conformity index,CI)和均匀性指数(homogeneity index,HI)来评估放疗计划的质量。
其中,
| $ \mathrm{CI}=\frac{T V_{\mathrm{RI}}}{T V} \times \frac{T V_{\mathrm{RI}}}{V_{\mathrm{RI}}} $ | (1) |
式中,TVRI为处方剂量线所包裹的靶区体积,TV为靶体积;VRI为处方剂量线所包裹的总体积。CI值在0~1之间,CI值越大表明靶区适形度越高。
| $ \mathrm{HI}=\frac{D_{2 \%}-D_{98 \%}}{D_{50 \%}} $ | (2) |
式中,D2%为近似最大剂量;D98%为近似最小剂量;D50%(50% PTV体积受照的剂量)为中位剂量。HI值越低说明靶区剂量均匀性越好。危及器官根据串并联器官的性质统计了平均剂量Dmean、20 Gy的受照体积V20、40 Gy的受照体积V40、近似最大剂量D2%等参数。
4. 卵巢位置的测量:卵巢悬吊的位置差异较大,对与靶区处于相同层面的卵巢在Monaco治疗计划系统中测量了3个距离,如图 1所示。
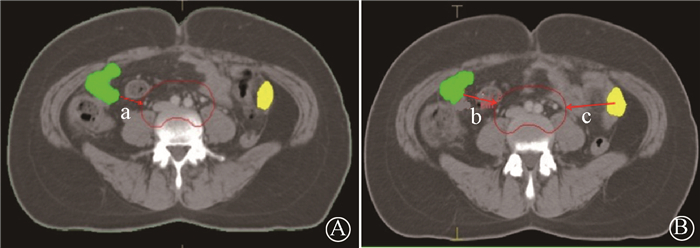
|
注:a. 卵巢到PTV的最近距离;b.卵巢体心层面卵巢到PTV最近距离;c.卵巢体心层面卵巢体心到PTV最近距离 图 1 宫颈癌患者卵巢与PTV位置关系示意图 Figure 1 Relationship of the ovary location and PTV |
5. 统计学处理:采用SPSS 16.0对两种计划的PTV、危及器官等计划参数进行分析,以x±s形式表示。对符合正态分布的两组数据进行配对t检验;对不符合正态分布的数据进行Wilcoxon秩和检验。P<0.05为差异有统计学意义。
结果1. 剂量分布:31例患者中54个卵巢进行了有效的移位(移至靶区以外)。其中9个卵巢位于靶区PTV层面以上,如图 2中A所示,卵巢的剂量较低。45个卵巢与PTV处于相同层面(占总数的83.3%),如图 2中D所示,卵巢剂量较高,且由于控制卵巢剂量,对靶区及周边危及器官的剂量分布有影响,靶区适形度均变差。
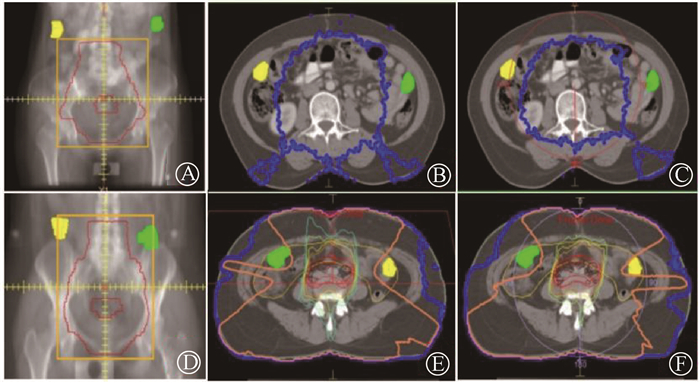
|
注:蓝色线为200 cGy的等剂量线,橙色线为500 cGy的等剂量线 图 2 宫颈癌患者放疗计划示意图 A.卵巢位于靶区层面以上的示意图;B和C.图A所示的卵巢IMRT和VMAT计划在卵巢近似中心层面的剂量分布;D.卵巢位于靶区层面相同层面的示意图;E和F.图D所示的卵巢IMRT和VMAT计划在卵巢近似中心层面的剂量分布 Figure 2 Schematic diagram of treatment planning A.schematic diagram of the ovary located above the PTV; B and C. corresponding dose distribution of the ovarian IMRT and VMAT plan shown in figure a at the approximate center level of the ovary; D. a schematic diagram of the ovary located in the same level with PTV; E and F. the dose distribution of the ovarian IMRT and VMAT plan shown in Figure D at the approximate center level of the ovary |
2. IMRT计划与VMAT计划间参数比较分析:如表 1所示,IMRT和VMAT两种放疗计划的剂量分布均能够满足靶区处方剂量要求,IMRT计划靶区近似最大剂量D2%低于VMAT计划(t=3.96,P=0.007),但适形度差于VMAT计划(t=-2.43,P=0.025),见表 1。分析卵巢的平均剂量时,分两种情况,如图 2中A所示对于卵巢位于PTV上方的情况,IMRT与VMAT计划卵巢的平均剂量均较低,且两者之间差异无统计学意义(P>0.05)。另一种为图 2中D所示的卵巢与PTV处于相同层面时,IMRT卵巢平均剂量要高于VMAT,其平均剂量分别为(459.1±239.9) cGy,(428.3±238.2) cGy (z=3.11,P=0.002)。对于其他危及器官,IMRT计划直肠、膀胱和小肠等器官近似最大剂量D2%均低于VMAT计划。VMAT对于远离靶区的危及器官如脊髓的近似最大剂量D2%低于IMRT(z=2.06,P=0.04),左右两侧股骨头的平均剂量VMAT也低于IMRT。本研究中VMAT的跳数多于IMRT,执行时间少于IMRT。两种计划剂量验证通过率均较高且差异无统计学意义(P>0.05)。
|
|
表 1 31例宫颈癌术后患者IMRT计划与VMAT计划间的参数比较 Table 1 Comparison of parameters between IMRT plan and VMAT plan of 31 patients with cervical cancer after radical operation |
3. 卵巢剂量与卵巢位置间的关系:对靶区处于相同层面的卵巢进行分析,分别统计卵巢与PTV的最近距离、卵巢体心层面卵巢到PTV的最近距离、卵巢体心到PTV的最近距离、卵巢的体积等与卵巢平均剂量间的相关关系;计算Spearman相关系数结果如表 2所示。
|
|
表 2 不同距离体积参数与卵巢平均剂量间的相关系数r值 Table 2 Correlation analysis between distance or volume with ovarian mean dose |
不论采用IMRT技术还是VMAT技术,卵巢的平均剂量与与卵巢到PTV最近距离、卵巢中心层面到PTV最近距离和卵巢体心到PTV最近距离均为强负相关,其中卵巢体心到PTV表面的最近横向距离相关度最高。卵巢平均剂量与卵巢体积无显著相关性。
4. 回归分析预测剂量与位置间的关系:由于卵巢体心到靶区表面的最近距离与卵巢的平均剂量相关度最高,对其进行回归分析,采用了指数函数的非线性拟合;IMRT、VMAT的拟合R2值分别为0.91和0.85,见图 3。
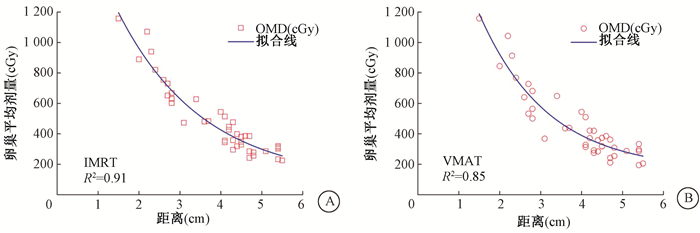
|
注:IMRT.固定野调强;VMAT.容积旋转调强;OMD.卵巢平均剂量 图 3 31例宫颈癌根治术后患者卵巢体心到靶区最近距离与卵巢平均剂量间的曲线拟合图 A.IMRT;B.VMAT Figure 3 The fitting curve of the closest distance from the ovarian volume center to the PTV and the ovarian mean dose (OMD) of 31 patients with cerical cancer after radical operation A. IMRT; B. VMAT |
拟合的公式分别为:
| $ \mathrm{IMRT}_{-} \mathrm{OMD}=2250 e^{(-\mathrm{d} / 2.1)}+94.52 $ | (3) |
| $ \mathrm{VMAT}_{-} \mathrm{OMD}=2512 e^{(-\mathrm{d} / 1.67)}+159.18 $ | (4) |
式中,d是卵巢体心层面卵巢体心到靶区的最近距离。卵巢体心到靶区的距离越大,卵巢受量越低。通过公式计算可以预测为了将OMD降低到500 cGy
或更低,采用IMRT和VMAT技术时卵巢体心与靶区的最近距离应大于3.6 cm和3.3 cm;将OMD降低到300 cGy或更低,卵巢体心与靶区的最近距离应大于5和4.8 cm。
3、讨论宫颈癌患者治疗中保护卵巢可保持卵巢的内分泌功能,维持女性生理所需要的激素,内分泌功能能否成功保留与多种因素相关,如放疗时卵巢所受剂量、患者年龄、移位位置和有无同期化疗等[11]。卵巢的放疗剂量越低,卵巢功能得以维持的概率越高。
卵巢移位术通过将卵巢移出射野外可有效降低卵巢放疗受量。Hwang等[3]推荐将卵巢移位于髂嵴上1.5 cm以上或者对穿照射的射野外4 cm,尽管妇瘤医生悬吊卵巢时都尽量采纳了这一建议,但不同患者卵巢悬吊的位置仍存在较大差异,实际放疗计划中的卵巢剂量差异较大。对于卵巢的限量,安菊生等[12]通过治疗前和治疗后监测促卵泡激素(FSH)、雌二醇(E2)水平,认为卵巢平均剂量和V8 Gy的体积是维持这些激素水平的最相关的因素;Yin等[13]研究认为将辐射剂量限制为Dmean < 532 cGy可能是IMRT放疗中保留卵巢功能的新的最佳剂量。本研究中对位于靶区层面以上的卵巢,IMRT和VMAT的卵巢平均剂量都低于532 cGy,且差异无统计学意义,并且不会因为限值卵巢剂量影响靶区和危及器官的剂量分布;但由于漏射线和散射线的存在,卵巢仍有一定剂量[14]。对于与靶区处于相同层面的卵巢,IMRT和VMAT两种放疗计划的剂量分布均能够满足靶区处方剂量和危及器官的限量要求。其中,双弧VMAT卵巢平均剂量低于9野IMRT,根据文献报道分析是因为VMAT在外周剂量跌落比IMRT更好,VMAT的外周剂量在距离PTV 5 cm时比IMRT低约8%,在距PTV 15 cm时约为30%[15-16]。VMAT计划的MU数量虽然比IMRT多,但在靶区适形度和治疗时间上VMAT优于IMRT。综上,VMAT在保护卵巢的宫颈癌术后放疗卵巢剂量、靶区适形度和效率上均有优势。
由于卵巢悬吊位置对卵巢剂量影响较大,研究中分析了IMRT和VMAT计划中几个卵巢到靶区的距离与卵巢平均剂量间的关系,发现卵巢体心到靶区的距离与卵巢的相关性因素最高。对这一因素采用指数函数的非线性拟合,可计算出卵巢平均剂量为300 cGy时,卵巢体心到靶区的距离IMRT和VMAT分别为5和4.8 cm。Yoshihiro等[17]采用了线性回归的方式分析卵巢-靶区最近距离与卵巢平均剂量关系,采用VMAT技术并将卵巢平均剂量控制在300 cGy,推荐卵巢-靶区最近距离应>6.1 cm。本研究的结果比Yoshihiro等[17]的推荐距离要小,这可能是使用了不同的计划系统、机器、物理师和医生对计划设计或要求间存在一定的差异,VMAT计划在卵巢保护的宫颈癌放疗计划中对于卵巢移位的距离要求更短,存在优势。在临床工作中可以创建自己单位的预测公式, 在计划设计前根据卵巢体心与靶区间的距离预测下卵巢剂量,为最终的计划剂量提供一些参考。研究中的两种计划都采用了钨门跟随技术,可对危及器官提供更好的保护[18]。本研究只是通过放疗计划对卵巢剂量进行分析,患者实际治疗时还进行了影像引导,这部分剂量并未计算在内[19],治疗中腹、盆部位的脏器移动度较大,分次间或分次内位置与计划位置可能会存在差异,计划剂量和实际剂量间会存在偏差,要获得卵巢实际放疗剂量需要更加全面细致的研究。
综上所述,当卵巢位于宫颈癌靶区层面以上,两种计划的卵巢剂量均可以做到较低的水平,VMAT与IMRT间卵巢剂量差异无统计学意义。卵巢与靶区处于相同层面的情况时,双弧VMAT计划的卵巢平均剂量低于9野IMRT;VMAT在保护卵巢的宫颈癌术后放疗中剂量和效率上均有优势。同时,两种计划卵巢平均剂量与卵巢体心到靶区最近距离高度负相关,可通过这一距离预测卵巢的平均剂量。
利益冲突 无
作者贡献声明 郭昌负责课题设计、数据采集和分析、论文撰写;吴一凡负责实施研究和采集数据;翟振宇指导论文;徐寒子指导课题设计、数据分析和论文修改
| [1] |
Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012[J]. CA Cancer J Clin, 2012, 62(1): 10-29. DOI:10.3322/caac.20138 |
| [2] |
Kokcu A. Premature ovarian failure from current perspective[J]. Gynecol Endocrinol, 2010, 26(8): 555-562. DOI:10.3109/09513590.2010.488773 |
| [3] |
Hwang JH, Yoo HJ, Park SH, et al. Association between the location of transposed ovary and ovarian function in patients with uterine cervical cancer treated with (postoperative or primary) pelvic radiotherapy[J]. Fertil Steril, 2012, 97(6): 1387-1393. DOI:10.1016/j.fertnstert.2012.02.052 |
| [4] |
Mossa B, Schimberni M, Di Benedetto L, et al. Ovarian transposition in young women and fertility sparing[J]. Eur Rev Med Pharmacol Sci, 2015, 19(18): 3418-3425. |
| [5] |
Selter J, Grossman Becht LC, Huang Y, et al. Utilization of ovarian transposition for fertility preservation among young women with pelvic malignancies who undergo radiotherapy[J]. Am J Obstet Gynecol, 2018, 219(4): 415-417. DOI:10.1016/j.ajog.2018.05.037 |
| [6] |
Hoekman EJ, Broeders E, Louwe LA, et al. Ovarian function after ovarian transposition and additional pelvic radiotherapy: a systematic review[J]. Eur J Surg Oncol, 2019, 45(8): 1328-1340. DOI:10.1016/j.ejso.2019.02.017 |
| [7] |
Klopp AH, Yeung AR, Deshmukh S, et al. Patient-reported toxicity during pelvic intensity-modulated radiation therapy: NRG Oncology-RTOG 1203[J]. J Clin Oncol, 2018, 36(24): 2538-2544. DOI:10.1200/JCO.2017.77.4273 |
| [8] |
Lin YZ, Chen K, Lu ZY, et al. Intensity-modulated radiation therapy for definitive treatment of cervical cancer: a meta-analysis[J]. Radiat Oncol, 2018, 13(1): 177. DOI:10.1186/s13014-018-1126-7 |
| [9] |
Lee NY, Leeman JE, Cahlon O, et al. Target volume delineation and treatment planning for particle therapy[M]. Switzerland: Springer International Publishing, 2018.
|
| [10] |
International Commission on Radiation Units and Measurements. ICRU Report 83. Prescribing, recording, and reporting photon-beam intensity-modulated radiation therapy(IMRT)[R]. Oxford: Oxford University Press, 2010.
|
| [11] |
吕晓娟, 程晓龙, 俞华. 宫颈癌放疗时保留卵巢功能的研究进展[J]. 中华放射肿瘤学杂志, 2016, 25(6): 661-664. Lyu XJ, Cheng XL, Yu H, et al. Research advances in preservation of ovarian function during radiotherapy for cervical carcinoma[J]. Chin J Radiat Oncol, 2016, 25(6): 661-664. DOI:10.3760/cma.j.issn.1004-4221.2016.06.026 |
| [12] |
安菊生, 杜霄勐, 张凤, 等. 放疗对宫颈癌根治术患者卵巢功能影响[J]. 中华放射肿瘤学杂志, 2019, 28(10): 753-757. An JS, Du XK, Zhang F, et al. Effect of radiotherapy on ovarian function in patients undergoing radical surgery for cervical cancer[J]. Chin J Radiat Oncol, 2019, 28(10): 753-757. DOI:10.3760/cma.j.issn.1004-4221.2019.10.008 |
| [13] |
Yin L, Lu SQ, Zhu J, et al. Ovarian transposition before radiotherapy in cervical cancer patients: functional outcome and the adequate dose constraint[J]. Radiat Oncol, 2019, 14(1): 100. DOI:10.1186/s13014-019-1312-2 |
| [14] |
Roche M, Crane R, Powers M, et al. Agility MLC transmission optimization in the Monaco treatment planning system[J]. J Appl Clin Med Phys, 2018, 19(5): 473-482. DOI:10.1002/acm2.12399 |
| [15] |
Cozzi L, Dinshaw KA, Shrivastava SK, et al. A treatment planning study comparing volumetric arc modulation with RapidArc and fixed field IMRT for cervix uteri radiotherapy[J]. Radiother Oncol, 2008, 89(2): 180-191. DOI:10.1016/j.radonc.2008.06.013 |
| [16] |
Jia MX, Zhang X, Yin C, et al. Peripheral dose measurements in cervical cancer radiotherapy: a comparison of volumetric modulated arc therapy and step-and-shoot IMRT techniques[J]. Radiat Oncol, 2014, 9: 61. DOI:10.1186/1748-717X-9-61 |
| [17] |
Yoshihiro U, Shingo O, Masaru I, et al. Strategies for reducing ovarian dose in volumetric modulated arc therapy (VMAT) for postoperative uterine cervical cancer[J]. Br J Radiol, 2018, 91(1081): 20160777. DOI:10.1259/bjr.20160777 |
| [18] |
Wu H, Jiang F, Yue HZ, et al. A comparative study of identical VMAT plans with and without jaw tracking technique[J]. J Appl Clin Med Phys, 2016, 17(5): 133-141. DOI:10.1120/jacmp.v17i5.6252 |
| [19] |
Qiu Y, Moiseenko V, Aquino-Parsons C, et al. Equivalent doses for gynecological patients undergoing IMRT or RapidArc with kilovoltage cone beam CT[J]. Radiother Oncol, 2012, 104(2): 257-262. DOI:10.1016/j.radonc.2012.07.007 |
 2021, Vol. 41
2021, Vol. 41


