盆腹部肿瘤在全球范围普遍高发且死亡率较高[1]。放射治疗是肿瘤的重要治疗手段,约70%的肿瘤患者需要接受放疗[2-3]。由于小肠对电离辐射的高度敏感性,盆腹部肿瘤患者放疗后往往表现出腹痛、腹泻、胆汁酸吸收不良等不良反应[4-5],严重影响了患者的生活质量[6]。
胆汁酸由肝细胞产生,进食后随胆汁排入肠腔,并在小肠末端被重吸收,之后被肝细胞摄取。这就是胆汁酸的“肠肝循环”。胆汁酸的肠肝循环能够反馈抑制胆汁酸合成,在降低炎症方面也具有重要的生理功能[7-8]。
吐温-80(Tween-80)是一种常用的乳化剂,广泛应用于食品、医药、化妆品等工业。本研究前期工作表明,Tween-80能够改变小鼠肠道菌群的组成及丰度,加重电离辐射诱导的肠损伤[9]。另有研究表明,受照大鼠小肠中胆汁酸含量降低、粪便中胆汁酸含量升高;胆汁酸水平的改变可以破坏肠道微环境,导致肠道菌群失调,进而扰乱宿主免疫稳态[10]。
本研究旨在探讨Tween-80对电离辐射抑制的胆汁酸肠肝循环的影响及丁酸对Tween-80上述抑制作用的缓解,为临床上盆腹部肿瘤患者的放疗提供饮食及用药建议,同时为缓解胆汁酸吸收障碍提供新的治疗策略。
材料与方法1. 实验动物:雄性C57BL/6 J小鼠,6~8周龄,体重18~20 g,购于北京华阜康实验动物技术有限公司[合格证号:SCXK(京)2014-0008],饲养于中国医学科学院放射医学研究所无特定病原体级实验动物中心,温度(22±2)℃、湿度40%~70%,12 h光照明暗交替,不限量供应无菌水及饲料。
2. 照射方式:使用Gammacell 40 Exactor辐照仪,采用特制的屏蔽装置,对麻醉小鼠进行单次剂量12 Gy γ射线腹部局部照射,吸收剂量率为1.0 Gy/min。照射后进行日常观察和处理。照射30 d后处死小鼠,取小鼠组织样本进行后续实验。
3. 实验分组:48只小鼠按照随机数表法分为4组:健康对照组12只,为了避免灌胃对实验小鼠产生的刺激,健康对照组小鼠照射前每天上午灌胃给予200 μl水,照射后每天上午、下午各灌胃给予200 μl水;单纯照射组12只,接受12 Gy单次剂量腹部局部照射,并灌胃给予水(同健康对照组);照射+Tween-80组小鼠12只,接受腹部局部照射前,连续7 d上午10 ∶00灌胃给予200 μl Tween-80,照射后每天上午10 ∶00灌胃给予Tween-80,下午灌胃给予水,直至麻醉处死;照射+Tween-80+丁酸组小鼠12只,照射前连续7 d上午10 ∶00接受200 μl Tween-80灌胃处理,照射后每天上午灌胃给予200 μl Tween-80,下午灌胃给予200 μl丁酸,直至麻醉处死。采用的Tween-80浓度为:1.0%V/V,200 μl/d[9, 11];丁酸浓度为:7.5 mg/ml。
4. 酶联免疫吸附试验(ELISA):组织样品中加入适量含0.1%吐温20的磷酸盐缓冲液(PBS)研磨,使其终浓度为0.1 g/ml。使用中国酶联生物科技有限公司的ELISA试剂盒。设置标准品孔、空白孔和待测样品孔;之后每孔加入酶标试剂,空白孔除外。温育后洗板;加入显色剂,37℃避光显色15 min;加入终止液;以空白孔调零,450 nm波长测定各孔吸光度(A)值。
5. 实时定量聚合酶链反应(qRT-PCR):使用TRIzol从组织中分离总RNA,反转录合成cDNA。使用Fast Start Universal SYBR Green Master (ROX)进行qRT-PCR。以GAPDH为内参,计算2-ΔΔCt实验组/2-ΔΔCt对照组,分析基因表达量。
6. 免疫组织化学染色:解剖取小鼠结肠,于4%甲醛溶液中固定过夜;之后将组织包埋于石蜡中,切片厚度为5 μm;室温下用5%牛血清白蛋白封闭1 h,之后于4℃孵育一抗过夜;室温下孵育二抗1 h后,用二氨基联苯胺(DAB)染色试剂染色,苏木素复染细胞核。
7. 统计学处理:所有实验重复3次。采用SPSS 13.0软件进行统计学分析,数据经正态性检验符合正态分布,用x±s表示,使用GraphPad Prism 8进行作图,两组间比较采用两独立样本t检验。P < 0.05为差异有统计学意义。
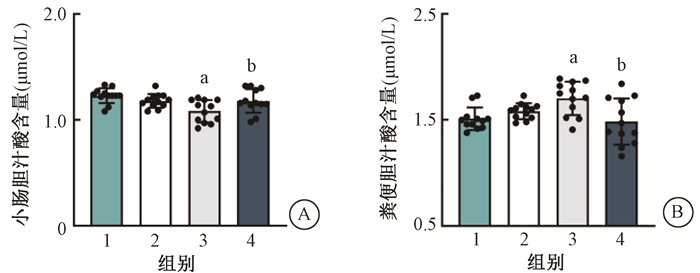
结果1. ELISA检测Tween-80及丁酸处理对受照小鼠胆汁酸肠肝循环的影响:与健康对照组相比,接受腹部局部照射的小鼠小肠中胆汁酸含量降低(4.16%),粪便中胆汁酸含量升高(4.67%),差异无统计学意义(P>0.05)。Tween-80预处理的小鼠在接受腹部局部照射后,小肠中胆汁酸含量进一步降低(7.92%,t=3.93,P<0.05),而粪便中胆汁酸含量进一步升高(7.99%,t=2.94,P<0.05);丁酸给药使得小鼠小肠中胆汁酸的含量升高(8.06%,t=9.25,P<0.05),粪便中胆汁酸的含量降低(14.41%,t=4.71,P<0.05),见图 1。上述结果表明,Tween-80能够加重辐射诱导的胆汁酸肠肝循环障碍,而丁酸能够改善Tween-80对受照小鼠胆汁酸肠肝循环的抑制作用。
|
注:1. 健康对照组;2. 单纯照射组;3. 照射+Tween-80组;4. 照射+Tween-80+丁酸组;与2组比较,at=3.93、2.94,P<0.05;与3组比较,bt=9.25、4.71,P<0.05 图 1 Tween-80及丁酸对受照小鼠小肠(A)及粪便(B)中胆汁酸含量的影响 Figure 1 Effects of Tween-80 and butyric acid on the concentrations of bile acid in small intestine (A) and feces (B) |
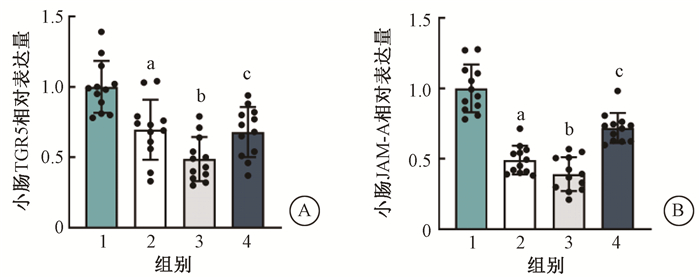
2. qRT-PCR检测Tween-80及丁酸处理后G蛋白耦联胆汁酸受体1(TGR5)及其下游连接粘附分子(JAM-A)的变化:小鼠接受腹部局部电离辐射后,小肠中TGR5表达量降低。与单纯照射组相比,摄入Tween-80的受照小鼠小肠中TGR5及其下游JAM-A的表达量进一步下调(20.93%、9.91%,t=4.85、5.14,P<0.05);丁酸能够显著上调小鼠肠道TGR5及JAM-A的表达水平(19.35%、32.71%,t=7.69、19.23,P<0.05),见图 2。
|
注:1. 健康对照组;2. 单纯照射组;3. 照射+Tween-80组;4. 照射+Tween-80+丁酸组;与1组比较,at=9.65、12.44,P<0.01;与2组比较,bt=4.85、5.14,P<0.05;与3比较,ct=7.69、19.23,P<0.01 图 2 Tween-80及丁酸对受照小鼠小肠TGR5(A)及其下游JAM-A(B)表达量的影响 Figure 2 Effects of Tween-80 and butyric acid on the expressions of TGR5 (A) and JAM-A (B) in small intestine |
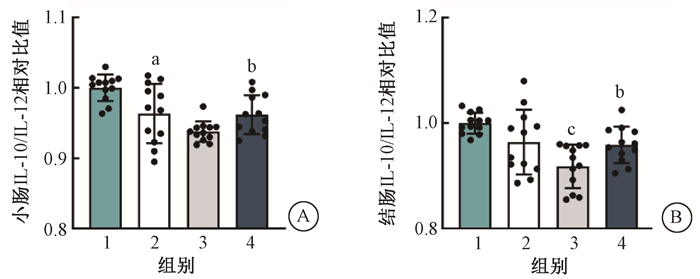
3. qRT-PCR检测Tween-80及丁酸处理对小鼠小肠及结肠IL-10/IL-12比率的影响:与单纯照射组相比,Tween-80预处理的受照小鼠结肠中IL-10与IL-12的比率显著下调(4.59%,t=3.39,P<0.05);丁酸处理后小鼠小肠及结肠IL-10/IL-12比率升高(2.39%、4.05%,t=3.38、5.92,P<0.05),见图 3。
|
注:1. 健康对照组;2. 单纯照射组;3. 照射+Tween-80组;4. 照射+Tween-80+丁酸组;与1组比较,at=3.21,P<0.05;与3组比较,bt=3.38、5.92,P<0.05;与2组比较,ct=3.39,P<0.05 图 3 Tween-80及丁酸对受照小鼠小肠(A)及结肠(B)IL-10/IL-12比值的影响 Figure 3 Effects of Tween-80 and butyric acid on the ratio of IL10/IL12 in small intestine (A) and colon (B) of irradiated mice |
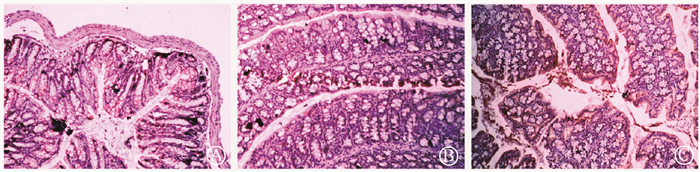
4. 免疫组织化学检测结肠中G蛋白耦联受体GPR43的表达量:与单纯照射组相比,Tween-80预处理的小鼠结肠中GPR43蛋白的含量降低,而丁酸能够缓解Tween-80造成的受照小鼠结肠GPR43蛋白含量的降低,见图 4。
|
A.单纯照射组;B.照射+Tween-80组;C.照射+Tween-80+丁酸组 图 4 Tween-80及丁酸对受照小鼠结肠GPR43蛋白含量的影响免疫组织化学染色×400 A. radiation-only group; B. radiation+Tween-80 group; C. radiation+Tween-80+butyric acid group Figure 4 Effects of Tween-80 and butyric acid on the contents of GPR43 in colon of irradiated mice Immunocytochemistry ×400 |
讨论
乳化剂是食品及药品加工中必不可少的添加剂及辅料,在食品及药品加工中可起到乳化、起泡、悬浮等作用。目前,中国已经批准使用的食品乳化剂有司盘(Span)、吐温(Tween)、大豆磷脂等。然而,越来越多的研究发现,即使在批准的安全剂量下,某些添加剂依然可能有损健康:如甜味剂可能导致葡萄糖不耐受[12];疫苗中硫柳汞的添加可能与自闭症的发展有关[13];乳化剂羧甲基纤维素钠及Tween-80能够导致肠道菌群紊乱和炎症,诱导代谢综合征,对焦虑和社会行为也会产生不利影响[11, 14-15]。在食品加工中,Tween-80常用作乳制品、豆干、面包、沙拉酱等的乳化剂、消泡剂、稳定剂。现行的《食品安全国家标准—食品添加剂使用标准》中规定了不同类型食品中Tween-80的最大添加量,如牛乳中最大使用量为l.5 g/kg;在面包中最大使用量为2.5 g/kg;豆干、腐竹中最大使用量为0.05 g/kg。另外,《中国药典》中收载Tween-80为药用辅料。Tween-80在抗肿瘤药多西他赛、依托泊苷及静脉麻醉药依托咪酯等中西药注射剂中作为增溶剂、乳化剂[16]。前期研究显示,Tween-80导致小鼠肠道菌群紊乱,进而加重电离辐射诱导的肠损伤[9]。辐射肠损伤患者往往出现腹痛、腹泻、食欲不振等反应,而胆汁酸吸收不良则认为是上述临床表现的原因之一。
胆汁酸能够促进肠道对脂质、营养物质和维生素的吸收和运输,同时也是信号分子和炎症介质,能迅速激活核受体和细胞信号通路,调节脂质、葡萄糖和能量代谢[17]。胆汁酸肠肝循环障碍患者的小肠对胆汁酸的重吸收能力降低,大量的胆汁酸溢出到结肠,进而刺激电解质和水的分泌,导致大便疏松至水样。放射性肠炎及克罗恩病等是导致胆汁酸吸收不良的常见原因[18]。研究表明,连续5 d接受2 Gy腹部局部照射的大鼠出现放射性腹泻症状与胆汁酸重吸收障碍(小肠胆汁酸含量降低、粪便中胆汁酸含量升高)有关[10]。另有研究表明,在20例接受腹部局部照射的肿瘤患者中,13例出现胆汁酸吸收障碍[19]。轻度至中度胆汁酸吸收不良的患者对胆汁酸螯合剂(如考来烯胺、考来替泊)的治疗反应良好,而胆汁酸螯合剂对重度胆汁酸吸收不良患者的治疗效果较差,甚至会加重腹泻[18]。本研究结果显示,摄入乳化剂Tween-80后,受照小鼠小肠内胆汁酸的含量降低,粪便中胆汁酸含量升高,表明乳化剂Tween-80的摄入进一步加重了辐射对小肠重吸收胆汁酸能力的抑制,导致更多的胆汁酸由于未能被重吸收而随粪便流失;而丁酸的摄入提高了受照小鼠小肠内胆汁酸的含量,且粪便中胆汁酸有所降低,表明丁酸能够缓解Tween-80加重的受照小鼠胆汁酸肠肝循环的抑制。在本研究中,接受腹部局部照射小鼠的小肠胆汁酸含量下降,而粪便中胆汁酸含量上升,说明电离辐射导致了胆汁酸肠肝循环障碍。然而,或许由于样本量的原因以及动物之间存在个体差异,受照小鼠小肠和粪便中胆汁酸含量相比于健康对照组差异无统计学意义。
胆汁酸发挥生物学功能主要是通过激活核受体FXR、膜受体TGR5以及PK、ERK、MAPK信号通路实现的,而膜受体TGR5能够激活连接粘附分子A(JAM-A)的表达和磷酸化,修复上皮屏障功能。有研究报道,表皮干细胞经照射后,TGR5的表达量降低[20]。与文献报道一致,本研究发现摄入Tween-80的受照小鼠小肠TGR5表达水平显著降低,进而下调JAM-A的表达量;而丁酸给药能够显著提高TGR5及其下游JAM-A的含量。另有研究表明,胆汁酸不能诱导经典的M1或M2型巨噬细胞的激活,而是通过诱导一种中间表型的激活(特征为IL-10/IL-12比值升高),发挥抗炎作用[21-22]。Tween-80预处理的受照小鼠小肠及结肠中IL-10/IL-12比值降低,丁酸处理显著提高了IL-10/IL-12比值,提示Tween-80对胆汁酸肠肝循环的抑制部分是通过激活TGR5、进而激活JAM-A发挥作用的。
丁酸是一种常见的短链脂肪酸,其发挥作用的分子机制是一方面通过抑制组蛋白去乙酰基酶; 另一方面通过激活G蛋白耦联受体(GPCR),释放生物活性因子,进而发挥抗炎和促进肠道转运的功能[23-24]。研究发现,丁酸能够上调GPR43基因的表达,缓解放射性肠损伤[9]。本研究检测了Tween-80及丁酸对受照小鼠结肠GPR43表达的影响,发现丁酸能够缓解Tween-80对受照小鼠结肠GPR43蛋白表达的进一步抑制,明确了丁酸保护辐射抑制的胆汁酸肝肠循环作用的潜在机制部分依赖于GPR43的激活。
胆汁酸与肠道菌群密切相关,胆汁酸能够影响肠道菌群的组成,同时,肠道菌群能够影响胆汁酸的合成与代谢[25]。研究发现,Tween-80能够诱导正常及受照小鼠肠道菌群紊乱,而丁酸能够恢复Tween-80对肠道菌群的改变[9]。这或许能够解释Tween-80对受照小鼠胆汁酸重吸收的抑制及丁酸对Tween-80效应的缓解。另外,有研究表明,约95%的胆汁酸通过顶膜钠依赖性胆盐转运体(ASBT)在回肠末端被重吸收,未被ASBT重吸收的胆汁酸进入结肠[26],而腹部局部照射导致的大鼠胆汁酸吸收障碍与小肠ASBT mRNA和蛋白表达水平降低有关[10],表明ASBT可能在照射诱导的胆汁酸重吸收障碍中发挥作用。Tween-80是否能够进一步抑制ASBT的表达及丁酸对ASBT的影响还需要进一步研究。
综上所述,本研究证实了摄入Tween-80加重腹部局部照射诱导的胆汁酸肠肝循环障碍,而肠道微生物发酵膳食纤维的主要代谢物——丁酸可以缓解Tween-80对受照小鼠胆汁酸肠肝循环的抑制。提示Tween-80作为一种广泛应用于食品和药物的乳化剂,可加重盆腹部恶性肿瘤放疗后的胆汁酸肠肝循环障碍,抑制胆汁酸的抗炎作用。因此,盆腹部肿瘤患者在放疗期间应避免摄入含Tween-80的食品或药品。另外,丁酸可以治疗放疗后Tween-80加重的胆汁酸吸收障碍,恢复胆汁酸抗炎功能。
利益冲突 无
作者贡献声明 李源负责实验操作及撰写论文;樊赛军负责设计研究方案;肖惠文、董佳丽、张书琴协助实验;崔明负责实验设计,并在论文写作及修稿过程中给予指导
| [1] |
Markham MJ, Wachter K, Agarwal N, et al. Clinical cancer advances 2020:annual report on progress against cancer from the American Society of Clinical Oncology[J]. J Clin Oncol, 2020, 38(10): 1081. DOI:10.1200/JCO.19.03141 |
| [2] |
Citrin DE. Recent developments in radiotherapy[J]. N Engl J Med, 2017, 377(22): 2200-2201. DOI:10.1056/NEJMc1713349 |
| [3] |
Hauer-Jensen M, Denham JW, Andreyev HJ. Radiation enteropathy-pathogenesis, treatment and prevention[J]. Nat Rev Gastroenterol Hepatol, 2014, 11(8): 470-479. DOI:10.1038/nrgastro.2014.46 |
| [4] |
王津晗, 徐畅, 王彦, 等. 放射性肠损伤模型及其评价研究进展[J]. 国际放射医学核医学杂志, 2017, 41(1): 33-39, 44. Wang JH, Xu C, Wang Y, et al. Progress on the evaluating and establishing methods of radiation-induced intestinal injuries animal model[J]. Int J Radiat Med Nucl Med, 2017, 41(1): 33-39, 44. DOI:10.3760/cma.j.issn.1673-4114.2017.01.007 |
| [5] |
Webb GJ, Brooke R, De Silva AN. Chronic radiation enteritis and malnutrition[J]. J Dig Dis, 2013, 14(7): 350-357. DOI:10.1111/1751-2980.12061 |
| [6] |
Kumagai T, Rahman F, Smith AM. The microbiome and radiation induced-bowel injury: evidence for potential mechanistic role in disease pathogenesis[J]. Nutrients, 2018, 10(10): 1405. DOI:10.3390/nu10101405 |
| [7] |
Tagawa H, Irie J, Itoh A, et al. Bile acid binding resin improves hepatic insulin sensitivity by reducing cholesterol but not triglyceride levels in the liver[J]. Diabetes Res Clin Pract, 2015, 109(1): 85-94. DOI:10.1016/j.diabres.2015.04.025 |
| [8] |
Chiang JY. Bile acids: regulation of synthesis[J]. J Lipid Res, 2009, 50(10): 1955-1966. DOI:10.1194/jlr.R900010-JLR200 |
| [9] |
Li Y, Xiao H, Dong J, et al. Gut microbiota metabolite fights against dietary polysorbate 80-aggravated radiation enteritis[J]. Front Microbiol, 2020, 11: 1450. DOI:10.3389/fmicb.2020.01450 |
| [10] |
Wang L, Zhou Y, Wang X, et al. Mechanism of Asbt (Slc10a2)-related bile acid malabsorption in diarrhea after pelvic radiation[J]. Int J Radiat Biol, 2020, 96(4): 510-519. DOI:10.1080/09553002.2020.1707324 |
| [11] |
Chassaing B, Koren O, Goodrich JK, et al. Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome[J]. Nature, 2015, 519(7541): 92-96. DOI:10.1038/nature14232 |
| [12] |
Suez J, Korem T, Zeevi D, et al. Artificial sweeteners induce glucose intolerance by altering the gut microbiota[J]. Nature, 2014, 514(7521): 181-186. DOI:10.1038/nature13793 |
| [13] |
Siva N. Thiomersal vaccines debate continues ahead of UN meeting[J]. Lancet, 2012, 379(9834): 2328. DOI:10.1016/s0140-6736(12)61002-2 |
| [14] |
Holder MK, Peters NV, Whylings J, et al. Dietary emulsifiers consumption alters anxiety-like and social-related behaviors in mice in a sex-dependent manner[J]. Sci Rep, 2019, 9(1): 172. DOI:10.1038/s41598-018-36890-3 |
| [15] |
Roberts CL, Keita AV, Duncan SH, et al. Translocation of Crohn's disease escherichia coli across M-cells: contrasting effects of soluble plant fibres and emulsifiers[J]. Gut, 2010, 59(10): 1331-1339. DOI:10.1136/gut.2009.195370 |
| [16] |
罗霞, 王青, 周联, 等. 中药注射剂所含吐温-80与过敏反应关系的研究[J]. 药物不良反应杂志, 2010, 12(3): 160-165. Luo X, Wang Q, Zhou L, et al. Study on relationship between Tween-80 contained in injections of Chinese herbal medicine and anaphylactic reactions[J]. ADRJ, 2010, 12(3): 160-165. DOI:10.3969/j.issn.1008-5734.2010.03.003 |
| [17] |
Li J, Dawson PA. Animal models to study bile acid metabolism[J]. Biochim Biophys Acta Mol Basis Dis, 2019, 1865(5): 895-911. DOI:10.1016/j.bbadis.2018.05.011 |
| [18] |
Westergaard H. Bile Acid malabsorption[J]. Curr Treat Options Gastroenterol, 2007, 10(1): 28-33. DOI:10.1007/s11938-007-0054-7 |
| [19] |
White KL, Henson CC, Hann M, et al. Randomised clinical trial of a gastrointestinal care bundle to reduce symptoms in patients with pelvic cancer undergoing chemoradiotherapy[J]. BMJ Open Gastroenterol, 2020, 7(1): e000432. DOI:10.1136/bmjgast-2020-000432 |
| [20] |
Chang Y, Yu J. The protective effects of TGR5 against ultraviolet B irradiation in epidermal stem cells[J]. J Cell Biochem, 2019, 120(9): 15038-15044. DOI:10.1002/jcb.28765 |
| [21] |
Calmus Y, Poupon R. Shaping macrophages function and innate immunity by bile acids: mechanisms and implication in cholestatic liver diseases[J]. Clin Res Hepatol Gastroenterol, 2014, 38(5): 550-556. DOI:10.1016/j.clinre.2014.07.007 |
| [22] |
Haselow K, Bode JG, Wammers M, et al. Bile acids PKA-dependently induce a switch of the IL-10/IL-12 ratio and reduce proinflammatory capability of human macrophages[J]. J Leukoc Biol, 2013, 94(6): 1253-1264. DOI:10.1189/jlb.0812396 |
| [23] |
Zhao Y, Chen F, Wu W, et al. GPR43 mediates microbiota metabolite SCFA regulation of antimicrobial peptide expression in intestinal epithelial cells via activation of mTOR and STAT3[J]. Mucosal Immunol, 2018, 11(3): 752-762. DOI:10.1038/mi.2017.118 |
| [24] |
Li Y, Dong J, Xiao H, et al. Gut commensal derived-valeric acid protects against radiation injuries[J]. Gut Microbes, 2020, 11(4): 789-806. DOI:10.1080/19490976.2019.1709387 |
| [25] |
贾昊宇, 杨长青. 胆汁酸的肝肠循环及肠道微生态在胆汁淤积性肝病发病和治疗中的作用[J]. 临床肝胆病杂志, 2019, 35(2): 270-274. Jia HY, Yang CQ. The role of enterohepatic circulation of bile acids and intestinal microbiota in the pathogenesis and treatment of cholestatic liver disease[J]. J Clin Hepatol, 2019, 35(2): 270-274. DOI:10.3969/j.issn.1001-5256.2019.02.007 |
| [26] |
Wahlstrom A, Sayin SI, Marschall HU, et al. Intestinal crosstalk between bile acids and microbiota and its impact on host metabolism[J]. Cell Metab, 2016, 24(1): 41-50. DOI:10.1016/j.cmet.2016.05.005 |
 2021, Vol. 41
2021, Vol. 41


